Infecção pneumocócica de células endotélias humanas primárias em fluxo constante
Summary
Este estudo descreve o monitoramento microscópico da adesão pneumococcus às cordas do fator von Willebrand produzidas na superfície de células endotélias primárias humanas diferenciadas estresse de cisalhamento em condições de fluxo definidas. Este protocolo pode ser estendido à visualização detalhada de estruturas celulares específicas e quantificação de bactérias aplicando procedimentos diferenciais de imunocoloração.
Abstract
A interação de Streptococcus pneumoniae com a superfície das células endotélias é mediada no fluxo sanguíneo através de proteínas mecanosensíveis, como o Fator Von Willebrand (VWF). Esta glicoproteína muda sua conformação molecular em resposta ao estresse de cisalhamento, expondo assim locais de ligação para um amplo espectro de interações hospedeiro-ligand. Em geral, o cultivo de células endotélias primárias um fluxo de cisalhamento definido é conhecido por promover a diferenciação celular específica e a formação de uma camada endotelial estável e rigidamente ligada que se assemelha à fisiologia do revestimento interno de um vaso sanguíneo . Assim, a análise funcional das interações entre patógenos bacterianos e a vasculatura hospedeira envolvendo proteínas mecanosensíveis requer o estabelecimento de sistemas de bomba que possam simular as forças fisiológicas de fluxo conhecidas por afetar a superfície de células vasculares.
O dispositivo microfluídico usado neste estudo permite uma recirculação contínua e sem pulso de fluidos com uma taxa de fluxo definida. O sistema controlado por computador bomba de pressão do ar aplica um estresse tesoura definida em superfícies de células endoteliis, gerando um fluxo contínuo, unidirecional e controlado médio. As mudanças morfológicas das células e o acessório bacteriano podem ser monitoradas microscópicas e quantificadas no fluxo usando slides especiais de canal projetados para visualização microscópica. Em contraste com a infecção da cultura celular estática, que em geral requer uma fixação da amostra antes da rotulagem imunológica e análises microscópicas, as lâminas microfluídicas permitem a detecção baseada em fluorescência de proteínas, bactérias e componentes celulares após a fixação da amostra; coloração de imunofluorescência em série; e detecção direta baseada em fluorescência em tempo real. Em combinação com bactérias fluorescentes e anticorpos específicos rotulados por fluorescência, este procedimento de infecção fornece um sistema de visualização de componentes múltiplos eficiente para um enorme espectro de aplicações científicas relacionadas a processos vasculares.
Introduction
A patogênese das infecções pneumocócicas é caracterizada por uma interação multifacetada com uma diversidade de compostos de matriz extracelular e componentes da hemostase humana, como plasminogênio e VWF1,2, 3,4,5,6,7,8. O multidomínio glicoproteína VWF serve como regulador-chave de uma hemostasis equilibrada, mediando recrutamento trombocito e incorporação de fibrina no local da formação de trombosvascular9. A importância do VWF funcional e ativo para o controle hemorrágico e cicatrização de feridas é demonstrada pela doença de von Willebrand, um distúrbio hemorrágico herdado comum10.
Globular VWF circula no sistema sanguíneo humano a uma concentração de até 14,0 μg/mL11,10. Em resposta a lesão vascular, a liberação local do VWF por endotelial Weibel Palade Bodies (WBP) é marcadamente aumentada11,12. Estudos anteriores mostram que a adesão pneumoccus às células endotélias humanas e sua produção da pneumolysin a toxina formadora porosa estimula significativamente a secreção luminal da VWF13. As forças hidrodinâmicas do fluxo sanguíneo induzem uma abertura estrutural dos domínios mechanoresponsive vwf. A taxas de fluxo de 10 dyn/cm2, o VWF multimeriza para longas cadeias proteicas de até várias centenas de micrômetros de comprimento que permanecem ligados ao subendotelio10,12.
Para compreender a função das cordas multimerizadas de VWF geradas o esforço da tesoura na interação do pneumococcus com a superfície endotelial, uma aproximação microfluidic-baseada da infecção da cultura da pilha foi estabelecida. Um dispositivo microfluídico com um sistema de bomba de pressão de ar controlado por software foi usado. Isto permitiu uma recirculação contínua, unidirecional do meio da cultura da pilha com uma taxa de fluxo definida. Assim, o sistema aplicou um esforço definido da tesoura na superfície das pilhas endothelial, que remanesceram unidas dentro das corrediças especializadas da canaleta. Essa abordagem possibilitou a simulação da força de cisalhamento dentro da corrente sanguínea do sistema vascular humano, na qual as cordas da VWF são geradas em células endotélias diferenciadas condições de fluxo constantedefinidas. Para isso, as células endotélias foram cultivadas em toboáguas específicos (ver Tabela de Materiais),que foram adaptados para análises microscópicas durante o fluxo. O sistema microfluídico da bomba forneceu a situação altamente definida e controlada do esforço da tesoura exigida para a formação de cordas prolongadas de VWF na camada endotelial confluent da pilha. Após a estimulação da secreção VWF-seção de células endotélias da veia umbilical humana cultivada sifluente (HUVEC) por suplementação de histamina, a formação de cordas foi induzida pela aplicação de um estresse de cisalhamento () de 10 dyn/cm2. O estresse da cisalhamento é definido como a força agindo na camada celular. É calculado aproximadamente de acordo com Cornish et. al.14 com equação 1:
Onde = estresse de cisalhamento em dyn/cm2, η = viscosidade em (dyn’ s)/cm2, h =metade da altura do canal, w = metade da largura do canal, e Φ = flowrate em mL/min.
O resultado da equação 1 depende das diferentes alturas e larguras dos diferentes slides usados (ver Tabela de Materiais). Neste estudo foi utilizado um slide de canal Luer de 0,4 μm, resultando em um fator de deslizamento de câmara de 131,6 (ver fórmula 2).
Viscosidade do meio em 37 °C é 0.0072 dyn’ s/cm² e um esforço da tesoura de 10 dyn/cm² foi usado. Isso resultou em uma taxa de fluxo de 10,5 mL/min (ver fórmula 3).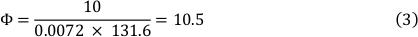
Aqui, a adaptação e o avanço de um procedimento microfluídico do culturing da pilha usando um sistema de fluxo laminar unidirecional para a investigação e a visualização de mecanismos bacterianos da infecção na vasculatura do anfitrião são descritos em detalhe. A geração de cordas VWF em camadas endotelias também pode ser estimulada usando outros sistemas de bomba que são capazes de aplicar um estresse de cisalhamento contínuo e constante15.
Após o cultivo de células endotélias primárias à confluência no fluxo e estimulação da formação de cordas VWF, pneumococci expressando proteína fluorescência vermelha (RFP)16 foram adicionados à camada de células endotelial controle microscópico constante. O apego de bactérias às cordas VWF na superfície das células endotélias foi microscópico visualizado e monitorado por até três horas em tempo real usando anticorpos específicos da VWF com rótulo fluorescente. Com essa abordagem, o papel da VWF como cofator de adesão promovendo o apego bacteriano ao endotelio vascular foi determinado8.
Além da visualização microscópica da secreção de proteínas e alterações conformais, este método poderia ser usado para monitorar etapas únicas dos processos de infecção bacteriana em tempo real e quantificar a quantidade de bactérias associadas em diferentes pontos de Infecção. O sistema de bomba controlado por software específico também fornece a possibilidade de cultura das células endotélias em condições de fluxo constante definido por até vários dias e permite uma incubação de fluxo médio pulsado definido. Além disso, este método pode ser aplicado usando diferentes tipos de células. A adaptação do protocolo de coloração também permite a detecção e visualização de bactérias internalizadas em células eucarióticas.
Este manuscrito descreve este protocolo experimental avançado que pode ser usado como uma abordagem definida, confiável e reproduzível para uma caracterização eficiente e versátil de processos fisiopatológicos.
Protocol
Representative Results
Discussion
A simulação da interação bacteriana com proteínas hospedeiras mecanosensíveis, como a VWF, requer um sistema de cultura celular perfusível que permita a geração de um fluxo definido, unidirecional e contínuo de líquidos, gerando assim um estresse de cisalhamento confiável . Vários sistemas de bombas microfluídicas já foram descritos. Uma revisão abrangente de Bergmann et al. resume os aspectos-chave dos diferentes modelos de cultura celular bie tridimensional17.
<p class="jove_…Disclosures
The authors have nothing to disclose.
Acknowledgements
O projeto foi financiado pelo DFG (BE 4570/4-1) para a SB.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

