일정한 흐름에 있는 1 차적인 인간 내피 세포의 폐렴구균 감염
Summary
본 연구는 정의된 흐름 조건에서 전단 응력 하에서 분화된 인간 1차 내피 세포의 표면에서 생성된 폰 윌레브란트 인자 문자열에 대한 폐렴구균 준수의 현미경 모니터링을 설명합니다. 이 프로토콜은 차동 면역 염색 절차를 적용하여 특정 세포 구조의 상세한 시각화 및 박테리아의 정량화로 확장 될 수있다.
Abstract
내피 세포의 표면과 연쇄상 구균 폐렴의 상호 작용은 폰 윌레브란트 인자 (VWF)와 같은 메카노 민성 단백질을 통해 혈류에서 매개됩니다. 이 당단백질은 전단 응력에 반응하여 분자 변형을 변화시켜 광범위한 숙주-리간드 상호작용에 대한 결합 부위를 노출시킵니다. 일반적으로, 정의된 전단 흐름 하에서 1 차 내피 세포의 배양은 혈관의 내벽의 생리학을 닮은 안정적이고 단단히 연결된 내피 층의 특정 세포 분화 및 형성을 촉진하는 것으로 알려져 있다. . 따라서, 세균성 병원체와 메카노민성 단백질을 포함하는 숙주 혈관구조 간의 상호작용의 기능적 분석은 표면에 영향을 미치는 것으로 알려진 생리적 유동력을 시뮬레이션할 수 있는 펌프 시스템의 확립을 요구한다. 혈관 세포.
이 연구에 사용된 미세 유체 장치는 정의된 유량으로 유체의 연속적이고 펄스없는 재순환을 가능하게 합니다. 컴퓨터 제어 식 공기 압 펌프 시스템은 연속, 단방향 및 제어 된 매체 흐름을 생성하여 내피 세포 표면에 정의 된 전단 응력적용합니다. 세포와 세균 부착의 형태학적 변화는 현미경 시각화를 위해 설계된 특수 채널 슬라이드를 사용하여 흐름에서 현미경으로 모니터링하고 정량화할 수 있습니다. 일반적으로 면역 표지 및 현미경 분석 전에 샘플 고정을 필요로하는 정적 세포 배양 감염과는 달리 미세 유체 슬라이드는 단백질, 박테리아 및 세포 성분의 형광 기반 검출을 모두 가능하게합니다. 샘플 고정 후; 직렬 면역 형광 염색; 실시간으로 직접 형광 기반 검출. 형광 박테리아 및 특정 형광 표지 항체와 함께,이 감염 절차는 혈관 과정과 관련된 과학적 응용 프로그램의 거대한 스펙트럼을위한 효율적인 다중 구성 요소 시각화 시스템을 제공합니다.
Introduction
폐렴구균 감염의 병인은 플라스미노겐 및 VWF 1,2와 같은 인간 지혈의 세포 외 매트릭스 화합물 및 구성 요소의 다양성과 다각적인 상호 작용을 특징으로합니다. 3,4,5,6,7,8. 다중 도메인 당단백질 VWF는 혈관 혈전 형성 부위에서 혈전세포 모집 및 피브린 혼입을 중재함으로써 균형 잡힌 지혈의 주요 조절자 역할을 한다9. 출혈 조절 및 상처 치유를 위한 기능적이고 활동적인 VWF의 중요성은 일반적인 상속된 출혈 장애 인 폰 윌레브란트 병10에의해 입증됩니다.
구형 VWF는 최대 14.0 μg/mL11,10의농도로 인간의 혈액 시스템에서 순환합니다. 혈관 손상에 대한 응답으로, 내피 바이벨 팔라드 바디 (WBP)에 의한 VWF의 국소 방출은현저하게 11,12증가된다. 이전 연구는 인간 내피 세포에 대한 폐렴구균 준수 및 공극 형성 독소 폐렴의 생산이 크게 루미날 VWF 분비를 자극한다는 것을 보여준다13. 혈류의 유체역학적 힘은 메카노반응성 VWF 도메인의 구조적 개방을 유도한다. 10dyn/cm2의 유량에서 VWF는 최대 수백 마이크로미터길이의 긴 단백질 문자열로 multimerizes10,12.
내피 표면과 폐렴구균의 상호 작용에서 전단 응력 하에서 생성된 다중화된 VWF 현의 기능을 이해하기 위해 미세 유체 기반 세포 배양 접근법이 확립되었습니다. 소프트웨어 제어 식 공기 압력 펌프 시스템을 갖춘 미세 유체 장치가 사용되었습니다. 이를 통해 정의된 유량으로 세포 배양 배지의 연속적이고 단방향 재순환이 가능했습니다. 따라서 시스템은 내피 세포의 표면에 정의된 전단 응력을 적용하여 특수 채널 슬라이드 내부에 부착된 상태로 유지했습니다. 이 접근법은 정의된 일정한 흐름 조건 하에서 VWF 현이 분화된 내피 세포에서 생성되는 인간 혈관 시스템의 혈류 내 전단력을 시뮬레이션할 수 있게 했습니다. 이를 위해, 내피 세포는 특정 채널 슬라이드(재료 표참조)에서 경작되었고, 이는 유동 동안 현미경 분석을 위해 조정되었다. 미세 유체 펌프 시스템은 동포 내피 세포 층에 확장 된 VWF 문자열의 형성에 필요한 고도로 정의되고 제어 된 전단 응력 상황을 제공했습니다. VWF-분비후 히스타민 보충제에 의해 인간 배꼽 내피 세포(HUVEC)를 동류성장한 인간 배꼽 내피 세포(HUVEC)의 자극 후, 현 형성은 10dyn/cm2의전단 응력(들)을 적용하여 유도되었다. 전단 응력은 세포 층에 작용하는 힘으로 정의됩니다. 그것은 코니쉬 등에 따라 대략 계산됩니다. al.14 와 방정식 1:
여기서 = dyn/cm2의전단 응력, θ =점도(dyn∙s)/cm2, h =채널 높이의 절반, 채널 너비의 절반, Φ=mL/min의 유량.
방정식 1의 결과는 사용되는 다른 슬라이드의 높이와 너비에 따라 달라집니다(재질 표참조). 본 연구에서 0.4 μm의 루어 채널 슬라이드를 사용하여 챔버 슬라이드 계수 131.6을 사용하였다(공식 2 참조).
37°C에서 배지의 점도는 0.0072 dyn∙s/cm²이고 10 dyn/cm²의 전단 응력도 사용하였다. 그 결과 10.5 mL/min의 유량이 발생했습니다(수식 3 참조).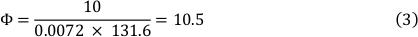
여기서, 숙주 혈관구조에서 세균 감염 메커니즘의 조사 및 시각화를 위한 단방향 층류 시스템을 이용한 미세유체 세포 배양 절차의 적응 및 발전이 상세히 기술된다. 내피 층에 VWF 스트링의 생성은 또한 연속적이고 꾸준한 전단응력(15)을적용할 수 있는 다른 펌프 시스템을 사용하여 자극될 수 있다.
VWF 현 형성의 흐름 및 자극에 합류하는 1차 내피 세포를 배작한 후, 적색 형광 단백질(RFP)을 발현하는 폐렴구균을 일정한 현미경 조절하에 내피 세포 층에 첨가하였다. 내피 세포의 표면에 VWF 문자열에 박테리아를 부착하는 것은 VWF 특이적 형광 표지 항체를 사용하여 실시간으로 최대 3 시간 동안 현미경으로 시각화및 모니터링되었습니다. 이러한 접근법으로, 혈관 내피에 세균 부착을 촉진하는 유착 보조인자로서 VWF의 역할을 결정하였고8.
단백질 분비 및 형태 변화의 현미경 시각화 이외에,이 방법은 실시간으로 세균 감염 과정의 단일 단계를 모니터링하고 서로 다른 시점에서 부착 된 박테리아의 양을 정량화하는 데 사용할 수 있습니다. 감염. 특정 소프트웨어 제어 펌프 시스템은 또한 최대 며칠 동안 정의된 일정한 유동 조건에서 내피 세포를 배양할 수 있는 가능성을 제공하고 정의된 펄스 매질 유동 배양을 가능하게 합니다. 또한,이 방법은 다른 세포 유형을 사용하여 적용 할 수 있습니다. 염색 프로토콜을 적응하면 진핵 세포로 내중화된 박테리아를 감지하고 시각화할 수 있습니다.
이 원고는 병리학 적 과정의 효율적이고 다양한 특성화를 위해 정의되고 신뢰할 수 있으며 재현 가능한 접근 법으로 사용할 수있는이 고급 실험 프로토콜을 설명합니다.
Protocol
Representative Results
Discussion
VWF와 같은 메카노에민성 숙주 단백질과의 세균 상호 작용 시뮬레이션은 정의된 단방향 및 연속적인 액체 흐름을 생성할 수 있는 이난 세포 배양 시스템을 필요로 하며, 이로 인해 신뢰할 수 있는 전단 응력 생성 . 여러 미세 유체 펌프 시스템이 이미 설명되어 있습니다. Bergmann 외에서 포괄적인 검토는 상이한 2차원 및 3차원 세포 배양모델(17)의주요 측면을 요약한다.
<p class="jov…Disclosures
The authors have nothing to disclose.
Acknowledgements
이 프로젝트는 DFG (BE 4570/4-1)에 의해 S.B에 지원되었습니다.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

