Pneumokocker infektion av primära humana endotelceller i konstant flöde
Summary
Denna studie beskriver den mikroskopiska övervakningen av pneumokocker anslutning till von Willebrands faktor strängar som produceras på ytan av differentierade mänskliga primära endotelceller under skjuvning stress i definierade flödesförhållanden. Detta protokoll kan utökas till detaljerad visualisering av specifika cellstrukturer och kvantifiering av bakterier genom att tillämpa differentiell immunofärgning procedurer.
Abstract
Interaktion av Streptococcus pneumoniae med ytan av endotelceller förmedlas i blodflödet via mechanosensitive proteiner såsom von Willebrands faktorn (VWF). Detta glykoprotein förändrar dess molekylära konformation som svar på skjuvning stress, därigenom exponera bindningsställen för ett brett spektrum av värd-ligand interaktioner. I allmänhet är odling av primära endotelceller under ett definierat skjuvflöde känt för att främja den specifika cellulära differentieringen och bildandet av ett stabilt och tätt sammanlänkat endotelskikt som liknar fysiologin hos det inre fodret i ett blodkärl . Således kräver funktionell analys av interaktioner mellan bakteriella patogener och värd kärl med mechanosensitive proteiner inrättandet av pumpsystem som kan simulera de fysiologiska flödes krafterna som är kända för att påverka ytan av vaskulära celler.
Den mikroflödessystem enhet som används i denna studie möjliggör en kontinuerlig och diskuterar återcirkulation av vätskor med en definierad flödeshastighet. Det datorstyrda luft trycks pumpsystemet tillämpar en definierad skjuvbelastning på endotelcellytor genom att generera ett kontinuerligt, enkelriktat och kontrollerat medium flöde. Morfologiska förändringar av cellerna och bakteriell kvarstad kan mikroskopiskt övervakas och kvantifieras i flödet med hjälp av speciella kanalbilder som är utformade för mikroskopisk visualisering. I motsats till statisk cellkultur infektion, som i allmänhet kräver ett prov fixering före immun märkning och mikroskopiska analyser, den mikroflödessystem slides möjliggöra både fluorescens-baserad detektion av proteiner, bakterier, och cellulära komponenter efter prov upptagning; seriell immunofluorescenscfärgning; och direkt fluorescensbaserad detektion i realtid. I kombination med fluorescerande bakterier och specifika fluorescensmärkta antikroppar, denna infektion förfarande ger en effektiv multipel komponent visualisering system för ett stort spektrum av vetenskapliga tillämpningar relaterade till vaskulära processer.
Introduction
Patogenesen av pneumokocker infektioner kännetecknas av en mångfacetterad interaktion med en mångfald av extracellulära matrix föreningar och komponenter i människans hemostas, såsom plasminogen ochVWF1,2, 3,4,5,6,7,8. Den flera domäner glykoprotein VWF fungerar som nyckel regulator av en balanserad hemostas genom att förmedla trombocyter rekrytering och fibrin inkorporering vid platsen för vaskulär tromb formation9. Betydelsen av funktionell, aktiv VWF för blödningskontroll och sårläkning framgår av von Willebrands sjukdom, en vanlig ärftlig blödningssjukdom10.
Globulära VWF cirkulerar i det humana blodsystemet med en koncentration på upp till 14,0 μg/ml11,10. Som svar på vaskulär skada, den lokala utgåvan av VWF av endotelceller Weibel Palade organ (WBP) är markant ökade11,12. Tidigare studier visar att pneumokocker anslutning till humana endotelceller och dess produktion av Porbildande toxin pneumolysin stimulerar signifikant luminala VWF sekretion13. Blodflödets hydrodynamiska krafter inducerar en strukturell öppning av de mechanoresponsive VWF-domänerna. Vid flödeshastigheter på 10 dyn/cm2 den VWF multimerizes till långa protein strängar på upp till flera hundra mikrometer i längd som förblir knutna till subendotelet10,12.
För att förstå funktionen av multimerized VWF strängar som genereras under skjuvning stress i samspelet mellan pneumokocker med endoteliala ytan, en microfluidic-baserade cellkultur infektion strategi fastställdes. En mikrofluidisk enhet med ett programvarustyrt luft trycks pumpsystem användes. Detta möjliggjorde en kontinuerlig, enkelriktad återcirkulation av cellodlingsmedium med en definierad flödeshastighet. Därmed applicerade systemet en definierad skjuvning spänning på ytbehandla av endotelceller celler, som återstod fäst insida specialiserade kanaliserar glidbanor. Detta tillvägagångssätt möjliggjorde simuleringen av skjuvning kraft inom blodströmmen av det mänskliga vaskulära systemet, där VWF strängar genereras på differentierade endotelceller under definierade konstanta flödesförhållanden. I detta syfte odlades endotelcellerna i specifika kanalbilder (se tabell över material), som anpassades för mikroskopiska analyser underflödet. Mikroflödessystem pumpsystem som den mycket definierade och kontrollerade skjuvning stress situation som krävs för bildandet av utökade VWF strängar på konfluenta endotelceller cell skiktet. Efter stimulering av VWF-utsöndring av samverkande odlas mänskliga navel ven endotelceller (HUVEC) av histamin tillskott, var strängen bildandet induceras genom att tillämpa en skjuvning stress (ԏ) av 10 dyn/cm2. Skjuvspänningen definieras som den kraft som verkar på cell skiktet. Den beräknas ungefär enligt Cornish et. Al.14 med ekvation 1:
Där ԏ = skjuvning stress i dyn/cm2, η = viskositet i (dyn ∙ s)/cm2, h = halva kanalens höjd, w = hälften av kanalbredden, och Φ = flöde i ml/min.
Resultatet av ekvation 1 beror på de olika höjderna och bredderna för de olika bilderna som används (se tabell över material). I denna studie användes en Luerkanalslide på 0,4 μm, vilket resulterade i en kammar bild faktor på 131,6 (se formel 2).
Viskositeten hos mediet vid 37 ° c är 0,0072 dyn ∙ s/cm ² och en skjuvning stress på 10 dyn/cm ² användes. Detta resulterade i en flödeshastighet på 10,5 mL/min (se formel 3).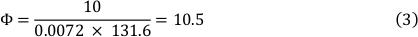
Här beskrivs anpassning och avancemang av en mikroflödessystem cell odlings procedur med hjälp av ett enkelriktat laminärt flödessystem för utredning och visualisering av bakteriella infektions mekanismer i värd kärlsystemet i detalj. Generering av VWF strängar på endotelskikt kan också stimuleras genom att använda andra pumpsystem som kan tillämpa en kontinuerlig och stadig skjuvning stress15.
Efter odling av primära endotelceller till sammanflödet i flödet och stimulering av VWF sträng formation, pneumokocker uttrycker rött fluorescens protein (RFP)16 lades till endotelcellskiktet under konstant mikroskopisk kontroll. Fastsättning av bakterier till VWF strängar på ytan av endotelceller var mikroskopiskt visualiseras och övervakas för upp till tre timmar i realtid med hjälp av VWF-specifika fluorescerande-märkta antikroppar. Med detta tillvägagångssätt, var den roll som VWF som en vidhäftning kofaktor främja bakteriell kvarstad på vaskulära endotelet bestämdes8.
Förutom den mikroskopiska visualiseringen av proteinsekretion och kon Formations förändringar, kan denna metod användas för att övervaka enstaka steg av bakteriella infektions processer i realtid och för att kvantifiera mängden bifogade bakterier vid olika tidpunkter i Infektion. Det specifika programvarustyrda pumpsystemet ger också möjlighet att odla endotelcellerna under definierade konstanta flödesförhållanden i upp till flera dagar och möjliggör en definierad inkubation mellan pulsade medel. Dessutom kan denna metod tillämpas med hjälp av olika celltyper. Anpassning av infärgnings protokollet möjliggör också detektion och visualisering av bakterier internaliseras i eukaryotiska celler.
Detta manuskript beskriver detta avancerade experimentella protokoll som kan användas som en definierad, tillförlitlig och reproducerbar metod för en effektiv och mångsidig karakterisering av patofysiologiska processer.
Protocol
Representative Results
Discussion
Simuleringen av bakteriell interaktion med mechanosensitive Host proteiner såsom VWF kräver ett parfymera cellkultursystem som möjliggör generering av ett definierat, enkelriktat och kontinuerligt flöde av vätskor, vilket skapar tillförlitlig skjuvbelastning . Flera mikrofluidiska pumpsystem har redan beskrivits. En omfattande översyn från Bergmann et al. sammanfattar de viktigaste aspekterna av olika två-och tredimensionell cellkultur modeller17.
Den mikrofl?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Projektet finansierades av DFG (BE 4570/4-1) till S.B.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

