Herstellung von expandierten Chitinschäumen und deren Verwendung bei der Entfernung von bässrigem Kupfer
Summary
Diese Studie beschreibt eine Methode, um Chitin durch chemische Techniken, die keine spezielle Ausrüstung erfordern, zu einem Schaum zu erweitern.
Abstract
Chitin ist ein wenig genutztes, natürlich reichlich vorhandenes, mechanisch robustes und chemisch beständiges Biopolymer. Diese Eigenschaften sind in einem Adsorbens wünschenswert, aber Chitin fehlt die notwendige spezifische Oberfläche, und seine Modifikation erfordert spezielle Techniken und Ausrüstung. Hierin wird ein neuartiges chemisches Verfahren zur Ausdehnung von Chitinflocken, die aus Garnelenschalenabfällen gewonnen werden, zu Schäumen mit höherer Oberfläche beschrieben. Der Prozess beruht auf der Entwicklung vonH2-Gas aus der Reaktion von Wasser mit NaH, das in einem Chitingel eingeschlossen ist. Die Zubereitungsmethode erfordert keine spezielle Ausrüstung. Pulverröntgenbeugung undN2-Physisorption deuten darauf hin, dass die Kristallitgröße von 6,6 nm auf 4,4 nm abnimmt und die spezifische Oberfläche von 12,6 ± 2,1m2/gauf 73,9 ± 0,2m2/gzunimmt. Infrarotspektroskopie und thermogravimetrische Analysen zeigen jedoch, dass der Prozess die chemische Identität des Chitins nicht verändert. Die spezifische Cu-Adsorptionskapazität des expandierten Chitins erhöht sich proportional zur spezifischen Oberfläche von 13,8 ± 2,9 mg/g auf 73,1 ± 2,0 mg/g. Die Cu-Adsorptionskapazität als Oberflächendichte bleibt jedoch relativ konstant bei durchschnittlich 10,1 ±0,8 Atom/nm2 , was wiederum auf keine Veränderung der chemischen Identität des Chitins hindeutet. Diese Methode bietet die Möglichkeit, Chitin in ein Material mit höherer Oberfläche umzuwandeln, ohne seine wünschenswerten Eigenschaften zu beeinträchtigen. Obwohl der Chitinschaum hier als Adsorbens beschrieben wird, kann man ihn sich als Katalysatorträger, Wärmeisolator und Strukturmaterial vorstellen.
Introduction
Chitin ist ein mechanisch robustes und chemisch inertes Biopolymer, das nach Cellulose in natürlicher Häufigkeit an zweiter Stellesteht 1. Es ist der Hauptbestandteil im Exoskelett von Arthropoden und in den Zellwänden von Pilzen und Hefen2. Chitin ist ähnlich wie Cellulose, jedoch mit einer Hydroxylgruppe jedes Monomers, die durch eine Acetylamingruppe ersetzt wird (Abbildung 1A, B). Dieser Unterschied erhöht die Festigkeit der Wasserstoffbindung zwischen benachbarten Polymerketten und verleiht Chitin seine charakteristische strukturelle Elastizität und chemische Inertheit2,3. Aufgrund seiner Eigenschaften und seines Reichtums hat Chitin ein erhebliches industrielles und akademisches Interesse geweckt. Es wurde als Gerüst für das Gewebewachstum4,5,6, als Komponente inVerbundwerkstoffen 7,8, 9,10,11und als Unterstützung für Adsorbentien und Katalysatoren11 , 12,13,14untersucht. Insbesondere seine chemische Stabilität macht Chitin attraktiv für Adsorptionsanwendungen, die Bedingungen beinhalten, die für gängige Adsorbentien unwirtlich sind14. Darüber hinaus macht die Fülle von Amingruppen Chitin zu einem wirksamen Adsorbens für Metallionen15. Die Protonierung der Amingruppen unter sauren Bedingungen reduziert jedoch die Metalladsorptionskapazität von Chitin16. Eine erfolgreiche Strategie besteht darin, Adsorptionsstellen einzuführen, die resistenter gegen Protonierungsind 17,18. Stattdessen wird hierin eine einfache Methode beschrieben, um die spezifische Oberfläche und damit die Anzahl der Adsorptionsstellen in Chitin zu erhöhen.
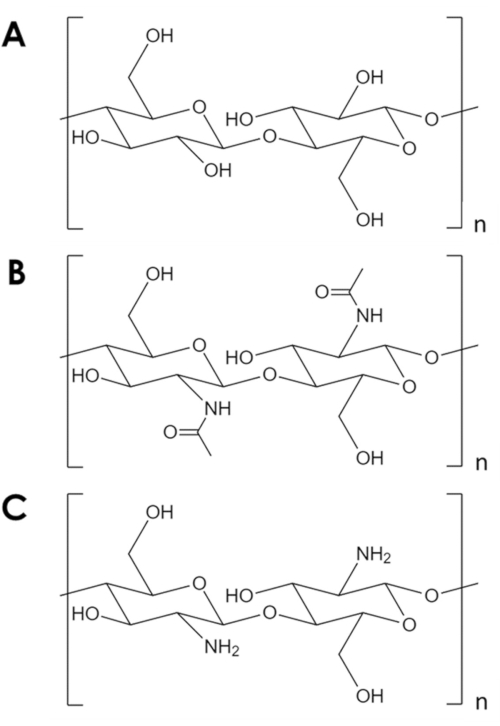
Abbildung 1. Chemische Struktur. A) Cellulose, (B) Chitin, (C) Chitosan. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Trotz seiner vielen möglichen Anwendungen wird Chitin nicht ausreichend genutzt. Die Chitinverarbeitung ist aufgrund seiner geringen Löslichkeit in den meisten Lösungsmitteln eine Herausforderung. Eine wesentliche Einschränkung seiner Verwendung in der Katalyse und Adsorption ist seine geringe spezifische Oberfläche. Während typische Kohlenstoff- und Metalloxidstützen spezifische Oberflächen in der Größenordnung 102-103 m2/g aufweisen, haben handelsübliche Chitinflocken Oberflächen in der Größenordnung von 10m2/g19,20,21. Es gibt Methoden, um Chitin zu Schäumen zu erweitern, aber sie beruhen ausnahmslos auf hohen Temperaturen und Drücken, starken Säuren und Basen oder speziellen Geräten, die eine signifikante Eintrittsbarriere darstellen5,21,22,23,24,25. Darüber hinaus neigen diese Methoden dazu, Chitin zu deacetylieren, um Chitosan zu bilden(Abbildung 1C)– ein löslicheres und reaktiveres Biopolymer5,25,26.
Hierin wird ein Verfahren beschrieben, um Chitin zu festen Schäumen zu erweitern, seine spezifische Oberfläche und Adsorptionskapazität zu erhöhen und seine chemische Integrität zu erhalten. Die Methode beruht auf der schnellen Entwicklung von Gas aus einem Chitingel und erfordert keine spezielle Ausrüstung. Die erhöhte Adsorptionskapazität des expandierten Chitins wird mit wässrigem Cu2+nachgewiesen – einer häufigen Verunreinigung im lokalen Grundwasser26.
| Einheit | Ordentliche Flocke | Gebackener Schaum | Lyophilisierten Schaum | |
| Kristallinität | % | 88 | 74 | 58 |
| Kristallgröße | Nm | 6.5 | 4.4 | 4.4 |
| Oberfläche | m2/g | 12.6 ± 2.1 | 43,1 ± 0,2 | 73,9 ± 0,2 |
| Cu Aufnahme | mg/g | 13,8 ± 2,9 | 48,6 ± 1,9 | 73,1 ± 2,0 |
| Cu Aufnahme | Atom/nm2 | 10,5 ± 2,8 | 10,7 ± 0,4 | 9,4 ± 0,3 |
Tabelle 1. Zusammenfassung der Materialeigenschaften. Chitinschäume haben eine geringere Kristallinität und Kristallgröße im Vergleich zu sauberen Chitinflocken. Die spezifische Oberfläche und Cu-Aufnahme der Chitinschäume sind jedoch proportional höher als die der reinen Chitinflocken.
Protocol
Representative Results
Discussion
Die vorgeschlagene Methode zur Herstellung von Chitinschaum ermöglicht die Herstellung solcher Schäume, ohne dass spezielle Geräte oder Techniken erforderlich sind. Die Herstellung des Chitinschaums beruht auf der Suspension von Natriumhydrid in einem Chitin-Sol-Gel. Der Kontakt mit Wasser aus der Atmosphäre induziert die Gelierung der Chitinmatrix und die Entwicklung von Wasserstoffgas durch Zersetzung des Natriumhydrids. Daher sind die kritischen Schritte der Zubereitung (1) die Bildung des Sol-Gels, (2) die Einfü…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Forschung wurde vom Combat Capabilities Development Command Army Research Laboratory (Kooperationsvertragsnummer W911NF-15-2-0020) gesponsert. Alle Meinungen, Ergebnisse und Schlussfolgerungen oder Empfehlungen, die in diesem Material zum Ausdruck gebracht werden, sind die der Autoren und spiegeln nicht unbedingt die Ansichten des Army Research Lab wider.
Wir danken dem Center for Advanced Materials Processing (CAMP) an der Montana Technological University für die Verwendung einiger der für diese Studie erforderlichen Spezialausrüstungen. Wir danken auch Gary Wyss, Nancy Oyer, Rick LaDouceur, John Kirtley und Katherine Zodrow für die technische Unterstützung und hilfreiche Diskussionen.
Materials
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
References
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658 (2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690 (2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114 (2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. . Naturally sourced chitin foam. , (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528 (2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH’s Water Treatment. , 1117 (2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -. C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).

