Preparación de espumas de quitina expandidas y su uso en la eliminación de cobre acuoso
Summary
Este estudio describe un método para expandir la quitina en una espuma mediante técnicas químicas que no requieren equipo especializado.
Abstract
La quitina es un biopolímero subexplotado, naturalmente abundante, mecánicamente robusto y químicamente resistente. Estas cualidades son deseables en un adsorbente, pero la quitina carece del área de superficie específica necesaria, y su modificación implica técnicas y equipos especializados. Aquí se describe un nuevo procedimiento químico para expandir las escamas de quitina, derivadas de los desechos de la cáscara del camarón, en espumas con mayor área de superficie. El proceso se basa en la evolución del gas H2 a partir de la reacción del agua con NaH atrapado en un gel de quitina. El método de preparación no requiere equipo especializado. La difracción de rayos X en polvo y la fisisorciónde N 2indican que el tamaño de la cristalita disminuye de 6,6 nm a 4,4 nm y el área de superficie específica aumenta de 12,6 ± 2,1 m2/ g a 73,9 ± 0,2 m2/ g. Sin embargo, la espectroscopia infrarroja y el análisis termogravimétrico indican que el proceso no cambia la identidad química de la quitina. La capacidad específica de adsorción de Cu de la quitina expandida aumenta en proporción a la superficie específica de 13,8 ± 2,9 mg/g a 73,1 ± 2,0 mg/g. Sin embargo, la capacidad de adsorción de Cu como densidad superficial permanece relativamente constante a un promedio de 10,1 ± 0,8 átomos/nm2,lo que nuevamente sugiere que no hay cambios en la identidad química de la quitina. Este método ofrece los medios para transformar la quitina en un material de mayor área de superficie sin sacrificar sus propiedades deseables. Aunque la espuma de quitina se describe aquí como un adsorbente, se puede imaginar como un soporte de catalizador, aislante térmico y material estructural.
Introduction
La quitina es un biopolímero mecánicamente robusto y químicamente inerte, solo superado por la celulosa en abundancia natural1. Es el componente principal en el exoesqueleto de artrópodos y en las paredes celulares de hongos y levaduras2. La quitina es similar a la celulosa, pero con un grupo hidroxilo de cada monómero reemplazado por un grupo acetil amina(Figura 1A,B). Esta diferencia aumenta la resistencia del enlace de hidrógeno entre las cadenas de polímeros adyacentes y le da a la quitina su resistencia estructural característica y su inercia química2,3. Debido a sus propiedades y abundancia, la quitina ha atraído un importante interés industrial y académico. Se ha estudiado como andamio para el crecimiento tisular4,5,6,como componente en materiales compuestos7,8,9,10,11,y como soporte para adsorbentes y catalizadores11,12,13,14. Su estabilidad química, en particular, hace que la quitina sea atractiva para aplicaciones de adsorción que implican condiciones inhóspitas para los adsorbentes comunes14. Además, la abundancia de grupos amina hacen de la quitina un adsorbente eficaz para los iones metálicos15. Sin embargo, la protonación de los grupos amina en condiciones ácidas reduce la capacidad de adsorción metálica de la quitina16. Una estrategia exitosa es introducir sitios de adsorción más resistentes a la protonación17,18. En su lugar, aquí se describe un método simple para aumentar el área de superficie específica y, por lo tanto, el número de sitios de adsorción en quitina.
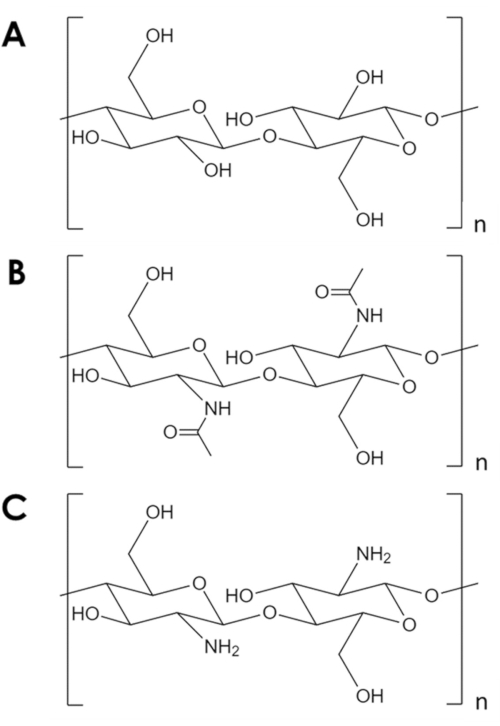
Figura 1. Estructura química. (A) celulosa, (B) quitina, (C) quitosano. Haga clic aquí para ver una versión más grande de esta figura.
A pesar de sus muchos usos potenciales, la quitina está subutilizada. El procesamiento de quitina es un desafío debido a su baja solubilidad en la mayoría de los solventes. Una limitación clave para su uso en catálisis y adsorción es su baja área de superficie específica. Mientras que los soportes típicos de carbono y óxido metálico tienen áreas de superficie específicas en el orden10 2-10 3 m2/ g, las escamas comerciales de quitina tienen áreas de superficie del orden de 10 m2/ g19,20,21. Existen métodos para expandir la quitina en espumas, pero invariablemente se basan en altas temperaturas y presiones, ácidos y bases fuertes, o equipos especializados que representan una barrera de entrada significativa5,21,22,23,24,25. Además, estos métodos tienden a desacetilatar quitina para formar quitosano(Figura 1C),un biopolímero más soluble y reactivo5,25,26.
Aquí, se describe un método para expandir la quitina en espumas sólidas, aumentar su área de superficie específica y capacidad de adsorción, y mantener su integridad química. El método se basa en la rápida evolución del gas desde el interior de un gel de quitina y no requiere equipo especializado. El aumento de la capacidad de adsorción de la quitina expandida se demuestra con Cu2+acuoso -un contaminante común en el agua subterránea local26.
| Unidad | Escama ordenada | Espuma al horno | Espuma liofilizada | |
| Cristalinidad | % | 88 | 74 | 58 |
| Tamaño del cristal | Nm | 6.5 | 4.4 | 4.4 |
| Superficie | m2/g | 12,6 ± 2,1 | 43,1 ± 0,2 | 73,9 ± 0,2 |
| Captación de Cu | mg/g | 13,8 ± 2,9 | 48,6 ± 1,9 | 73,1 ± 2,0 |
| Captación de Cu | átomo/nm2 | 10,5 ± 2,8 | 10,7 ± 0,4 | 9,4 ± 0,3 |
Tabla 1. Resumen de las propiedades del material. Las espumas de quitina tienen una cristalinidad y un tamaño de cristal más bajos en relación con las escamas de quitina ordenadas. Sin embargo, el área de superficie específica y la absorción de Cu de las espumas de quitina son proporcionalmente más altas que la de las escamas de quitina ordenadas.
Protocol
Representative Results
Discussion
El método propuesto para la fabricación de espuma de quitina permite la producción de tales espumas sin la necesidad de equipos o técnicas especializadas. La producción de la espuma de quitina se basa en la suspensión de hidruro de sodio dentro de un sol-gel de quitina. El contacto con el agua de la atmósfera induce la gelificación de la matriz de quitina y la evolución del gas hidrógeno por descomposición del hidruro de sodio. Por lo tanto, los pasos críticos de la preparación son (1) la formación del sol-…
Disclosures
The authors have nothing to disclose.
Acknowledgements
La investigación fue patrocinada por el Laboratorio de Investigación del Ejército del Comando de Desarrollo de Capacidades de Combate (Acuerdo de Cooperación Número W911NF-15-2-0020). Todas las opiniones, hallazgos y conclusiones, o recomendaciones expresadas en este material son las de los autores y no reflejan necesariamente los puntos de vista del Laboratorio de Investigación del Ejército.
Agradecemos al Centro de Procesamiento Avanzado de Materiales (CAMP) de la Universidad Tecnológica de Montana por el uso de algunos de los equipos especializados requeridos en este estudio. También agradecemos a Gary Wyss, Nancy Oyer, Rick LaDouceur, John Kirtley y Katherine Zodrow por la asistencia técnica y las útiles discusiones.
Materials
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
References
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658 (2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690 (2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114 (2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. . Naturally sourced chitin foam. , (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528 (2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH’s Water Treatment. , 1117 (2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -. C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).

