ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denne metoden beskriver rensing ved strømningscytometri av MEP og MKp fra mus lårben, tibias og bekkenben.
Abstract
Benmarg megakaryocytter er store polyploide celler som sikrer produksjon av blodplater. De oppstår fra hematopoietiske stamceller gjennom megakaryopoiesis. De siste stadiene av denne prosessen er komplekse og involverer klassisk de bipotente Megakaryocyte-Erytrocyte Progenitors (MEP) og de unipotente Megakaryocyte Progenitors (MKp). Disse populasjonene går foran dannelsen av bona fide megakaryocytter, og som sådan kan deres isolasjon og karakterisering tillate robust og objektiv analyse av megakaryocyttdannelse. Denne protokollen presenterer i detalj prosedyren for å samle hematopoietiske celler fra musebenmarg, berikelsen av hematopoietiske forfedre gjennom magnetisk uttømming og til slutt en cellesorteringsstrategi som gir svært rensede MEP- og MKp-populasjoner. For det første samles benmargsceller fra lårbenet, tibia, og også iliac crest, et bein som inneholder et høyt antall hematopoietiske forfedre. Bruken av iliac crest bein øker drastisk det totale celletallet oppnådd per mus og bidrar dermed til en mer etisk bruk av dyr. En magnetisk avstamning ble optimalisert ved hjelp av 450 nm magnetiske perler som muliggjør en svært effektiv cellesortering etter strømningscytometri. Til slutt presenterer protokollen merkings- og gatingstrategien for sortering av de to svært rensede megakaryocyttforfederpopulasjonene: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim) og MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9lys ). Denne teknikken er enkel å implementere og gir nok cellulært materiale til å utføre i) molekylær karakterisering for en dypere kunnskap om deres identitet og biologi, ii) in vitro differensieringsanalyser, som vil gi en bedre forståelse av mekanismene for modning av megakaryocytter, eller iii) in vitro-modeller for interaksjon med mikromiljøet.
Introduction
Blodplater produseres av megakaryocytter. Disse store polyploide cellene ligger i benmargen og som for alle blodlegemer de er avledet fra Hematopoietiske stamceller (HSC)1. Den klassiske produksjonsveien for megakaryocytter i benmargen stammer fra HSC og involverer generering av forskjellige forfedre som gradvis begrenser deres differensieringspotensial2. Den første forfederen som undertegner forpliktelsen til megakaryocytisk avstamning er Megakaryocyte-Erythrocyte Progenitor (MEP), en bipotent stamfar som er i stand til å produsere både erythroidceller og megakaryocytter3,4,5. MEP produserer deretter en unipotent forfeder/forløper (MKp) som vil skille seg ut i en moden megakaryocytt som er i stand til å produsere blodplater. Mekanismene som er involvert i genereringen av disse forfedrene, samt deres differensiering og modning i megakaryocytter er komplekse og bare delvis forstått. I tillegg er heterogeniteten til MEP-befolkningen når det gjelder differensieringspotensial og det iboende engasjementsnivået til disse cellene fortsatt uklart. For å dechiffrere disse prosessene er det viktig å skaffe (eller ha tilgang til) rensede populasjoner av MEP og MKp for fine molekylære og encellede analyser.
Flere studier har vist spesielle kombinasjoner av celleoverflatemarkører for identifisering av forfedre forpliktet til megakaryocytisk avstamning i musen6,7,8. Fra disse ble det utviklet en metode som tillater rensing av MEP og MKp fra mus. Denne metoden ble optimalisert for å skaffe celler i tilstrekkelig antall og kvalitet for et stort antall analyser. Med etiske hensyn i tankene, og for å minimere antall dyr som er involvert i forsøkene, fremkalte vi å høste benmargen fra lårbenet og tibia, og også fra iliac crest. Dette beinet inneholder en høy frekvens og antall hematopoietiske forfedre og er mesteparten av tiden skadet under lang benhøsting. Presentert her er en detaljert metode for pålitelig samling av dette beinet.
Det andre kriteriene for optimalisering er å produsere svært rensede cellepopulasjoner. Fluorescerende aktivert cellesortering (FACS) er en metode for valg for å oppnå rensede populasjoner av interesseceller. Imidlertid oppnås lave utbytter når cellepopulasjonen av interesse er svært sjelden. Berikelsesprosedyrer er derfor nødvendige. I denne protokollen ble en negativ utvalgsprosedyre valgt ved hjelp av magnetiske perler.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokoller som involverte dyr ble utført i samsvar med CREMEAS-komiteen for etikk for dyreforsøk ved Universitetet i Strasbourg (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg. Tillatelsesnummer: E67-482-10).
1. Mus bein samling
- Ofre dyret i samsvar med institusjonelle retningslinjer.
MERK: Dataene som presenteres i dette manuskriptet ble hentet fra C57Bl/6 mus på 8 til 12 uker gamle. Antall celler som er oppnådd, og hyppigheten av siterte populasjoner kan variere med alder og musestamme. - Spray kroppen med 70% etanol.
- Bruk saks, lag et 0,5-1 cm snitt av huden vinkelrett på ryggraden og rive huden rundt hele kroppen. Trekk ned huden fra underkroppen og fjern huden.
- Plasser dyret på disseksjonsputen, med forsiden ned. Finn bekkenbenene ved å skyve fingrene langs den eksponerte ryggraden fra toppen til bunnen. For å finne iliac crest, identifiser den lille bumpen i lumbalområdet nær bakbenene (anterosuperiorområdet til bekkenbenet). Figur 1A;B presenterer en skjematisk representasjon av musens anatomi.

Figur 1: Museanatomi. (A) Mus røntgen som viser bakbenet bein. Legg merke til avstanden mellom bekkenbenet og ryggraden (gul pil), hvor saksen må settes inn for å skille bakbenene riktig fra musens kropp (gul prikket linje). (B) Skjematisk representasjon av de benmargsrike beinene av interesse. Bekkenbenene er avbildet i rødt, lårbenene i lilla og tibias i grønt. (C) Skjematisk representasjon av musens bekkenben. Iliumet tilsvarer den margrike delen av bekkenbenet og er uthevet i rødt. Klikk her for å se en større versjon av denne figuren.
- Plasser saksen parallelt med ryggraden mot ryggvirvlene og nær iliac crest bump. Fortsett å kutte musklene langs siden av ryggraden over bekkenbenet ved å skyve saksen langs ryggvirvlene helt ned til halen.
MERK: Denne første delen av musklene kan også utføres ved hjelp av et skalpellblad. - Plasser saksen parallelt med ryggraden og fortsett å kutte mellom ryggvirvlene og iliac crest, som angitt av den gule stiplede linjen på figur 1A. Pass på at du holder deg så nær ryggvirvlene som mulig. Klipp de resterende musklene for å løsne lemmen fra kroppen.
MERK: Det skal være lite eller ingen motstand. - Gjenta på den andre siden for å løsne den andre lemmen.
- Overfør lemmer på en ren overflate og kast resten av kroppen i samsvar med institusjonelle retningslinjer.
- Utsett bekken-, lår- og tibialbenene ved å fjerne så mye omkringliggende vev som mulig med tang og skalpeller.
- Fortsett å forsiktig dislokere lårhodet fra bekkenbenet ved å holde den distale enden av lårbenet med tang mens du forsiktig kutter musklene rundt artikulasjonen med skalpellene. Vri beinene for å lette dislokasjonen.
- Skrap av den gjenværende muskelen fra bekkenbenet og kutt med en skalpell midt i hulrommet som holdt lårhodet. Iliumet holdes da det er rikt på hematopoietiske forfedre mens den trekantede svært tynne siden av beinet kastes, som vist i figur 1C.
- Fjern restvevet rundt iliumet med skalpellen og legg det rensede beinet i steril PBS supplert med 2% newborn calf serum (PBS-2%NBCS).
- Bruk saks, kutt av foten fra beinet ved ankelen.
- Hold den nedre delen av tibia med tang og skrap muskelen opp mot kneet. Kast fibulaen og kutt over det tibiale platået med skalpellen. Plasser tibia i steril PBS-2%NBCS.
- Fjern restvevet rundt lårbenet med skalpeller.
- Hold oversiden av lårbenet med tang; plasser skalpellbladet i bunnen av kneskålen. Påfør en kraft mot kneskålen parallelt med lårbenet til kneskålens løsrivelse. Plasser lårbenet i steril PBS-2%NBCS. Fjerning av kneskålen gir en ren tilgang for å sette inn nålen for margspyling.
2. Magnetisk uttømming av avledning positive celler
- I et laminært strømningsskap, overfør beinene i en steril Petri-tallerken fylt med steril PBS-2% NBCS.
- Med en skalpell kuttet av lårbenets hode.
- Fyll en 1 ml sprøyte med steril PBS-2% NBCS og fest en 21 G nål til utløpet.
- Fyll et 5 ml polypropylenrør med 2 ml steril PBS-2%NBCS.
- Hold lårbenet med tangene; Sett kanylen forsiktig inn i sporet etter at kneskålen er fjernet. Påfør rotasjon på kanylen mens du setter inn for å unngå å koble til kanylen. Pass på at nålen er helt satt inn i beinet opp til skråkanten.
- Overfør beinet med nålen inn i røret som inneholder 2 ml PBS-2% NBCS. Dispenser og aspirer PBS-2%NBCS fra sprøyten til beinet er klart.
- Fjern nålen fra lårbenet og sett den inn i hullet på motsatt side der lårbenet var. Dispenser og aspirer bufferen igjen og kast beinet.
- For iliac crest og tibia, hold beinet med tang; sett kanylen forsiktig inn i den åpne siden. Påfør rotasjon på kanylen mens du setter inn for å unngå å koble til kanylen. Pass på at nålen er helt satt inn i beinet opp til skråkanten. Overfør beinet med nålen inn i røret som inneholder 2 ml PBS-2% NBCS. Dispenser og aspirer PBS-2%NBCS fra sprøyten til beinet er klart. Kast beinene.
MERK: Bein fra opptil tre mus kan skylles inn i samme rør. Samle cellesuspensjonene. - Før den samlede cellefjæringen gjennom en 40 μm cellesilhette plassert på et sterilt 5 ml polystyrenrør.
- Fortsett med å telle cellene.
MERK: Celletelling kan utføres med et hvilket som helst hemocytometer, ved hjelp av Trypan Blue for levedyktighetsvurdering eller med en automatisert celleteller. Én mus gir vanligvis 105 ± 7 x 106 celler. - Ta til side 100 μL av cellefjæringen som Total Bone Marrow, tilsett 500 μL PBS-2% NBCS og lagre den på is for fargingsprosedyren.
- Pellet den filtrerte fjæringen ved sentrifugering ved 400 x g i 5 min ved 4 °C og kast supernatanten.
MERK: Røde blodlegemer kan lyses ved å resuspendere pelletsen i nytilberedt Lysis-løsning (1/10th i dH2O). Inkuber i 5 min til suspensjonen blir klar og lys rød og tilsett 10 volumer steril PBS. Fortsett å vaske cellene i PBS-2%NBCS ved sentrifugering ved 400 x g i 5 minutter ved 4 °C. Vær forsiktig når du fjerner supernatanten, da cellepelletet er veldig løs. Utfør en ny vask med PBS-2%NBCS ved sentrifugering ved 400 x g i 5 min ved 4 °C og fortsett til trinn 2,13. - Resuspend cellepellet i nylaget primær antistoffcocktail med et forhold på 100 μL per 1 x 107 celler. Inkuber på is i 30-45 min.
| Antistoff | Fortynning |
| Gr-1-biotin | 1:500 |
| B220-biotin | 1:500 |
| Mac-1-biotin | 1:500 |
| CD3-biotin | 1:500 |
| CD4-biotin | 1:500 |
| CD5-biotin | 1:500 |
| CD8-biotin | 1:500 |
| TER119-biotin | 1:1000 |
| CD127-biotin | 1:500 |
Tabell 1.
- Ta til side 10 μL av cellefjæringen i et sterilt 5 ml polystyrenrør merket Lin-Pos Fraction. Tilsett 90 μL PBS-2%NBCS og lagre det på is for fargingsprosedyren.
- Fortsett å vaske cellene to ganger med steril PBS-2% NBCS ved sentrifugering ved 400 x g i 5 min ved 4 °C. Pass på å gjøre den siste vasken i et sterilt 5 ml polypropylenrør.
- Under vasketrinnene, forbered perlene til den magnetiske uttømmingen.
- Resuspend perlene i hetteglasset ved å virvelere grundig i 30 s.
- Overfør et volum perler som tilsvarer to perler per målcelle til et 5 ml polypropylenrør.
- Vask perlene to ganger med PBS-2%NBCS ved å plassere røret på magneten og fjerne vaskebufferen ved hjelp av en steril pasteurpipette i glass.
- Resuspend perlene i 500 μL sterile PBS-2NBCS%.
- Resuspend pellet av merkede celler i 250 μL perler og bland forsiktig i 5 min på is. Tilsett 2 ml steril PBS-2%NBCS og bland forsiktig. Ikke rist røret.
- Plasser røret på magneten i 2 min.
- Fortsett å samle den ikke-magnetiske fraksjonen med en steril pasteurpipette i glass og legg den til de resterende 250 μL magnetiske perlene. Forsegle røret med parafilm.
- Plasser røret på en rørrull i 20 min ved 4 °C.
- Tilsett 2 ml steril PBS-2%NBCS og bland forsiktig. Ikke rist røret.
- Plasser røret i magneten i 2 min.
- Fortsett å samle den ikke-magnetiske fraksjonen i en steril 5 ml polypropylenrør merket Lin-Neg Fraction med en steril pasteurpipette.
- Pellet cellene ved sentrifugering ved 400 x g i 5 min ved 4 °C og fjern supernatanten.
- Resuspend de ikke-magnetiske cellene i 500 μL sterile PBS-2%NBCS.
- Fortsett med å telle cellene.
MERK: Én mus gir vanligvis 3,9 ± 1,1 x 106 celler. Typiske avstamningsfarging før og etter uttømming er presentert i figur 2B.
3. Cellesortering av megakaryocyttgenitorer etter strømningscytometri
- Ta rørene merket Total Bone Marrow, Lin-Pos Fraction og Lin-Neg Fraction.
- Fortsett å dele innholdet i røret Total Bone Marrow like i seks sterile 5 ml polystyrenrør. Merk rørene med tallene 1-6.
- Fortsett å merke røret Lin-Pos Fraction med tallet 7.
- Fortsett å dele innholdet i røret Lin-Neg Fraction som følger.
- Overfør 50 μL til et sterilt 5 ml polystyrenrør som inneholder 250 μL sterilt PBS-2%NBCS. Del deretter innholdet likt i 3 sterile 5 ml polystyrenrør. Merk disse rørene med tallene 8-10.
- De resterende 450 μL Lin-Neg Fraction celle suspensjon tilsvarer røret med tallet 11.
- Tilsett antistoffene på rørene som beskrevet i tabell 2.
| Rør | Etikett | Antistoff cocktail |
| Totalt benmarg | ||
| 1 | Ubegrunnet kontroll | |
| 2 | Enkel farget kontroll | CD45-FITC (1/200) |
| 3 | Enkel farget kontroll | CD45-PE (1/200) |
| 4 | Enkel farget kontroll | TER119-APC (1/200) |
| 5 | Enkel farget kontroll | CD45-PECy7 (1/200) |
| 6 | Enkel farget kontroll | CD45-APC-Cy7 biotin (1/200) |
| Lin-Pos brøk | ||
| 7 | Enkel farget kontroll | Enkel farget kontroll. Streptavidin-APC-Cy7 (1/500) |
| Lin-Neg brøk | ||
| 8 | FMO FITC-kontroll | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | FMO PE-kontroll | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | FMO PECy7-kontroll | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Positivt rør for sortering | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tabell 2.
- Inkuber på is i 30-45 min i mørket.
- Vask cellene med steril PBS-2% NBCS ved sentrifugering ved 400 x g i 5 min ved 4 °C.
- Resuspend cellepellets som følger.
- For rørene 1 til 10, resuspend pellet i 300 μL sterile PBS-2%NBCS supplert med 7AAD (2,5 μg/ml finale) (PBS-7AAD).
FORSIKTIG: 7AAD er et DNA-interkalant og må derfor håndteres med passende verneutstyr (hansker). - For rør 11, resuspend pellet i steril PBS-7AAD ved en maksimal konsentrasjon på 5 x 106 celler per ml og et minimumsvolum på 1 ml.
- For rørene 1 til 10, resuspend pellet i 300 μL sterile PBS-2%NBCS supplert med 7AAD (2,5 μg/ml finale) (PBS-7AAD).
- Forbered to polypropylenoppsamlingsrør merket MEP og MKp som inneholder 2 ml PBS-2% NBCS.
MERK: Alternativt kan celler samles inn i kulturmedium eller cellelysbuffer avhengig av den påfølgende applikasjonen for de sorterte cellene. Bruk av polystyrenrør anbefales ikke på grunn av mulig interferens med de ladede dråpene som inneholder cellene av interesse. - Hold alle rør på is i mørket.
- Fortsett til cellesorteringsoppsettet.
- Bruk rørene 1-7 til å sette opp spenning og kompensasjon, rør 7-10 for å bestemme sorteringsportene for cellepopulasjonene av interesse og rør 11 for cellesortering.
- De første trinnene i gatingstrategien tar sikte på å utelukke doble og døde celler fra analysen, som beskrevet i figur 3. Identifiser enkelt levedyktige celler og vis SSC-vs Lin-APC-Cy7 punktplott for å bekrefte effektiviteten av avstamning. Fra Lin- cellene er en port satt til å velge celler som er positive for c-kit og negative eller dim for Sca-1 og CD16/32. En CD9 vs CD150-uttrykkspunktplott for de merkede cellene gjør det mulig å identifisere fire populasjoner.
MERK: MEP- og MKP-cellene er begge positive for CD150. Tre uttrykksnivåer for CD9 kan defineres (neg, dim og high). MKp uttrykker høyt nivå av CD9 og MEP express CD9 på et mellomliggende fluorescensintensitetsnivå. MEP-populasjonen tilsvarer Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim og MKp populasjonen tilsvarer Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9bright. Diskrimineringen mellom CD9- og CD9-svakt populasjoner for CD150-positive celler angis basert på det maksimale nivået av CD9-uttrykk i cd150-negativ populasjon. Én mus gir vanligvis 5,3 ± MEP på 0,6 x10 3 MKp og 27,2 ± 2,4 x10 3.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Fenotypisk analyse av cellene identifisert som MEP og MKp ble utført ved strømningscytometri. Celler ble merket med fluorescens konjugerte antistoffer mot CD41a og CD42c, klassiske markører av megakaryocytiske og blodplater. Begge markørene ble uttrykt av cellene i MKp-populasjonen, mens disse markørene ennå ikke er oppdaget på overflaten av cellene i MEP-populasjonen (Figur 4Ai,4Aii). Polyploidy er et kjennetegn på megakaryocytter. DNA-innholdet i de sorterte populasjonene ble også analysert og demonstrert at cellene for det meste er 2N for MEP-populasjonen, og en liten andel av MKp-cellene er 4N, men høyere ploidy oppdages ikke signifikant i disse populasjonene (Figur 4Aiii).
For å bekrefte identiteten til de sorterte cellepopulasjonene ble det utført flere differensieringsanalyser for å evaluere deres evne til å skille seg ut mot megakaryocytiske og erythroid-avgrensninger. For det første ble det utført halvfaste klonogene analyser for å kvantifisere megakaryocytisk stamfar (CFU-MK) og erythroid forfedre (BFU-E). CFU-MK ble påvist i både MEP- og MKp-populasjoner, men ikke i den andre populasjonen som ble testet (figur 4B). BFU-E ble ikke oppdaget i MKp-populasjonen, men ble oppdaget i MEP-populasjonen og CD150-CD9dim cell population (Figur 4C).
Differensiering av de sorterte cellene ble også fulgt i flytende kultur i nærvær av en lav konsentrasjon av hematopoietiske cytokiner. Representative bilder fra mikroskopisk observasjon på 3rd dagen for differensiering viser at MEP og MKp produserte hovedsakelig megakaryocytter som er identifisert som store celler (Figur 5Aiii,5Aiv). Megakaryocytter ble identifisert ved hjelp av CD41- og CD42c-uttrykk og representerer henholdsvis 53,9 ± 10,4 % og 82,0 ± 2,0 % av cellene produsert fra mep- og MKp-cellepopulasjoner (figur 5B). Merkbart var ploidy av megakaryocyttene produsert analysert ved hjelp av DNA-markøren Hoescht 33242, større for megakaryocytten avledet fra MKp-befolkningen sammenlignet med MEP-befolkningen som antyder en mer moden tilstand (Figur 5C). Til slutt ble cellene produsert fra hver befolkning på 3rd-dagen utsatt for en proplateletformasjonsanalyse9. Det ble observert at bare cellene avledet fra MKp-populasjonen var i stand til å proplatelet utslipp i denne tilstanden (Figur 5D). Dette antyder et mer avansert modningsstadium for MKp-befolkningen. Videre, når kulturvarigheten forlenges opptil 4-5 dager, vil megakaryocytter generert fra MEP også utvide proplatelets.

Figur 2: Magnetisk uttømming av linavstømte celler. (A) Skjematisk representasjon av den magnetiske uttømmingsprotokollen. For det første er usorterte benmargsceller merket med biotinkonjugert rotte anti-mus antistoffcocktail. Celler inkuberes deretter med anti-rotte Ig belagte magnetiske perler og deretter utsatt for magnetisk uttømming ved hjelp av en sterk magnet. Magneten vil beholde den merkede magnetiske Lin + fraksjonen mot rørveggene, mens den umerkede ikke-magnetiske Lin-negative fraksjonen vil bli samlet inn i et nytt rør. (B) Lineage engasjerte celler kan identifiseres ved hjelp av fluorescerende konjugert streptavidin. Typisk analyse av avstamningsuttrykket i celler før magnetisk uttømming (total benmarg) og etter magnetisk uttømming (Lin-Fraction) N = 21. Klikk her for å se en større versjon av denne figuren.

Figur 3: Strategi for cellesortering av gating. (A) Valg av hendelser som tilsvarer levedyktige enkeltceller. (B) Valg av MEP- og MKP-populasjon. (i) Lin Neg-populasjonen velges fra de levedyktige enkeltcellehendelsene. (ii) Forfedre som uttrykker c-kit og med lavt eller ingen uttrykk for Sca-1 eller CD16/32 antigen velges deretter. Uttrykksnivåene (iii) CD9 og CD150 definerer fire cellepopulasjoner. MKp er definert som CD9lyseCD150+ celler, MEP er definert som CD9dimCD150+. Den høyeste grensen for CD9-uttrykket for CD9-dimm-CD150+ populasjonen er basert på det maksimale CD9-uttrykksnivået for CD150-cellene. For analyseformål ble CD9dimCD150- celler (forfedre) og CD9-CD150- (Double Negative: DN) også sortert. (C) Cellesorteringsporter er basert på Fluorescence Minus One (FMO)-kontroller. (i) FMO-kontroll for CD9-porter (ii) FMO-kontroll for CD150-porter. Klikk her for å se en større versjon av denne figuren.

Figur 4: Karakterisering av MEP- og MKP-cellepopulasjonene. (A) Flytcytometrianalyse av (i) CD41-uttrykk, (ii) CD42c-uttrykk og (iii) DNA-innhold (Hoechst33342) i cellepopulasjonene CD9+CD150dim (MEP) og CD9+CD150bright (MKp). (B) Kvantifisering av CFU-MK fra de sorterte cellepopulasjonene. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) og CD9+CD150bright (MKp) cellepopulasjoner ble sortert og belagt i kollagengel i henhold til produsentens instruksjoner. (C) Kvantifisering av BFU-E fra de sorterte cellepopulasjonene. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) og CD9+CD150bright (MKp) cellepopulasjoner ble sortert og belagt i metylcellulosegel i henhold til produsentens instruksjoner. Klikk her for å se en større versjon av denne figuren.

Figur 5: Differensieringspotensialet til MEP og MKp. CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) og CD9+CD150bright(MKp) cellepopulasjoner ble dyrket i tre dager i StemS spennplan medium supplert med SCF (7,5 ng/ml), Flt-3 (5 ng/ml), IL-6 (1 ng/ml) og TPO (10 ng/ml). (A) Representative bilder ble tatt ved fasekontrastmikroskopi. (B) Prosentandelen av CD41+CD42c+ megakaryocytter ble deretter vurdert ved flowcytometri. N = 3. (C) Ploidy nivået av CD41+CD42c+ megakaryocytter ble deretter evaluert med Hoechst av Flow cytometri. N = 3. (D) Celler produsert på dag 3 fra CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) og CD9+CD150lyse(MKp) cellepopulasjoner ble høstet og dyrket i DMEM medium supplert med 50 ng /ml TPO, 10 % fosterkalvserum og 100 U/ml hirudin. (i) Andelen proplateletdannende megakaryocytter i kulturen ble bestemt av mikroskopisk observasjon. Megakaryocytter ble identifisert basert på deres størrelse og / eller tilstedeværelsen av proplatelets. N = 2. (ii) Representativt fotografi av en proplateletbærende megakaryocytt ved fasekontrastmikroskopi. Klikk her for å se en større versjon av denne figuren.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Metoden beskrevet i dette dokumentet gjør det mulig å ekstraksjon og rensing av musen MEP og MKp. En viktig parameter i optimaliseringen av protokollen var å oppnå tilstrekkelig antall celler som ville være kompatible med de fleste molekylære og cellulære baserte analyser. Den generelle praksisen med musebensamling for hematopoietisk celleutvinning består vanligvis i høsting av både lårben og tibias av hver mus. Bekkenbenet, en annen kilde til hematopoietisk materiale, blir dermed ofte oversett. Årsakene til ikke å samle iliac crest er dårlig kunnskap om den indre anatomien til museskjelettet og det faktum at brukerne klassisk samler bakben ved å kutte over eller like over lårhodet. I tillegg antas det ofte at margcellene ikke ville bli spylt ut av iliac crest-beinet effektivt på grunn av tilstedeværelsen av trabeculae, som er fraværende i den sentrale delen av tibia og lårben. I denne protokollen blir disse to bekymringene adressert, og en standardisert, pålitelig og tidseffektiv metode presenteres som muliggjør riktig spyling av hvert bakben, inkludert bekkenbenet. Spesielt gir bruken av iliacbenet 105 ± 7 x 106 celler per mus, mens den klassiske metoden vanligvis gir 42 ± 5 x 106 celler. En stor fordel med denne metoden er reduksjonen i antall dyr som kreves for å oppnå et gitt antall målceller, og dermed gi mer etiske og kostnadseffektive eksperimentelle forhold. Denne prosedyren gjelder derfor også for enhver studie som krever benmargscellefjæring som isolering av hematopoietiske stamceller10 eller analyse av hematopoietisk stamcelleoppheng under halvfaste forhold11.
Cellesortering ved hjelp av strømningscytometri er en kraftig teknikk med stor fordel når det gjelder renhet sammenlignet med magnetiske berikelsesteknikker, men utbyttet av cellesortering for sjeldne populasjoner kan være lavere enn for mer tallrike populasjoner. Magnetisk uttømming av uønskede celler på forhånd er derfor en nyttig metode for å øke frekvensen av cellene av interesse. Her er den magnetiske uttømmingsprosedyren forskjellig fra produsentens anbefaling og tar hensyn til heterogeniteten i uttrykket av overflatemarkørene som brukes til å fjerne de uønskede avledningspositive cellene. Med de typiske ett-trinns protokollene vil avstamningspositive celler med det høyeste uttrykket av overflatemarkører raskt mette de magnetiske perlene. De vil forhindre den påfølgende fangsten av de gjenværende merkede cellene ved konkurranse og sterisk hindring, og dermed redusere uttømmingseffekten betydelig. For å løse dette problemet ble det utformet en to-trinns magnetisk uttømming som muliggjør sekvensiell fjerning av alle avstamningspositive celler, noe som gir mulighet for strenge uttømminger som passer for cellesortering.
En annen kritisk parameter for å oppnå en effektiv uttømming er de riktige merkebetingelsene til de uønskede avledningspositive cellene. Antistofftitrering er derfor spesielt optimalisert. Bruk av høyere konsentrasjoner av antistoffer vil resultere i overdreven rosetting av de magnetiske perlene og den ikke-spesifikke uttømmingen av avledningsnegative celler av interesse. Bruk av svært rensede MEP- og MKp-cellepopulasjoner er et viktig verktøy i studiet av megakaryopoiesis. For å belyse mekanismene som kontrollerer denne prosessen, undersøkte studien rollen til det cellulære mikromiljøet og har vist at en fosterlevercelle stromal cellepopulasjon ville støtte differensiering av MKp10. Den sorterte populasjonen kan også brukes til molekylære eller encellede analyser. Dette vil være spesielt relevant med tanke på den fremvoksende forestillingen om megakaryocytt-partisk HSC12,13,14. Produksjonen av megakaryocytt direkte fra HSC-befolkningen uten generering av en bipotent forfedre ville være en nødvei som svar på stress13.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen konkurrerende økonomiske interesser.
Acknowledgments
Forfatterne ønsker å takke Monique Freund, Catherine Ziessel og Ketty for teknisk assistanse. Dette arbeidet ble støttet av ARMESA (Association de Recherche et Développement en Médecine et Santé Publique), og av Grant ANR-17-CE14-0001-01 til Henri.de la. Salle.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
Biologi utgave 171Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
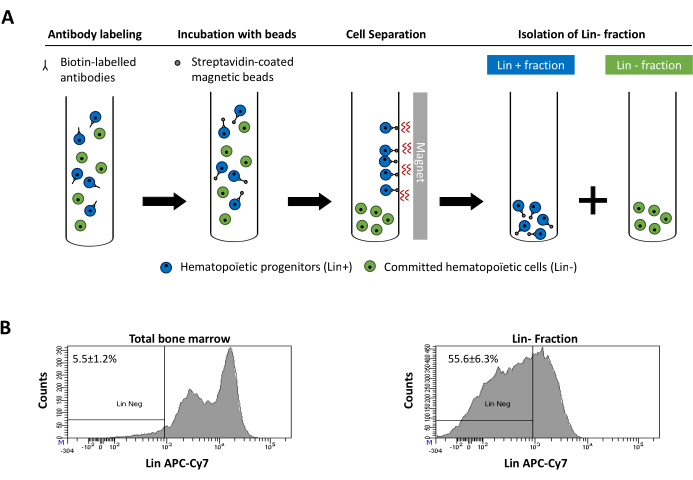
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
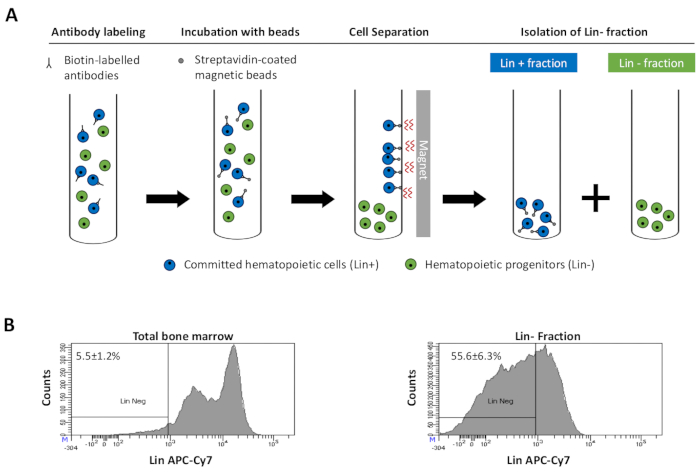
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



