एमियोट्रोफिक लेटरल स्केलेरोसिस के मॉडल में सिनैप्टिक कार्यों का वास्तविक समय फ्लोरोसेंट मापन
Summary
सिनैप्टिक ट्रांसमिशन के लिए आवश्यक उपकोशिकीय घटनाओं की कल्पना करने के लिए दो संबंधित विधियों का वर्णन किया गया है। ये प्रोटोकॉल इन विट्रो सुसंस्कृत न्यूरॉन्स के लाइव-सेल इमेजिंग का उपयोग करके प्रीसिनैप्टिक कैल्शियम प्रवाह और सिनैप्टिक पुटिका झिल्ली संलयन की गतिशीलता की वास्तविक समय की निगरानी को सक्षम करते हैं।
Abstract
न्यूरोनल अध: पतन से पहले, एमियोट्रोफिक लेटरल स्केलेरोसिस (एएलएस) और / या फ्रंटोटेम्पोरल लोब डिमेंशिया (एफटीएलडी) वाले रोगियों में मोटर और संज्ञानात्मक घाटे का कारण न्यूरॉन्स और मोटर न्यूरॉन्स और मांसपेशियों के बीच संचार की शिथिलता है। सिनैप्टिक संचरण की अंतर्निहित प्रक्रिया में झिल्ली विध्रुवीकरण-निर्भर सिनैप्टिक पुटिका संलयन और सिनैप्स में न्यूरोट्रांसमीटर की रिहाई शामिल है। यह प्रक्रिया स्थानीयकृत कैल्शियम प्रवाह के माध्यम से प्रीसिनेप्टिक टर्मिनलों में होती है जहां सिनैप्टिक पुटिकाएं रहती हैं। यहां, प्रोटोकॉल प्रतिदीप्ति-आधारित लाइव-इमेजिंग तरीकों का वर्णन करता है जो मज़बूती से विध्रुवीकरण-मध्यस्थता सिनैप्टिक पुटिका एक्सोसाइटोसिस और सुसंस्कृत न्यूरॉन्स में प्रीसिनेप्टिक टर्मिनल कैल्शियम प्रवाह गतिशीलता की रिपोर्ट करते हैं।
एक स्टायरिल डाई का उपयोग करना जिसे सिनैप्टिक पुटिका झिल्ली में शामिल किया जाता है, सिनैप्टिक पुटिका रिलीज को स्पष्ट किया जाता है। दूसरी ओर, कैल्शियम प्रविष्टि का अध्ययन करने के लिए, Gcamp6m का उपयोग किया जाता है, एक आनुवंशिक रूप से एन्कोडेड फ्लोरोसेंट रिपोर्टर। हम न्यूरोनल गतिविधि की नकल करने के लिए उच्च पोटेशियम क्लोराइड-मध्यस्थता विध्रुवीकरण को नियोजित करते हैं। सिनैप्टिक पुटिका एक्सोसाइटोसिस को स्पष्ट रूप से मापने के लिए, हम समय के एक समारोह के रूप में सामान्यीकृत स्टाइरिल डाई प्रतिदीप्ति के नुकसान को मापते हैं। इसी तरह की उत्तेजना की स्थिति में, कैल्शियम प्रवाह के मामले में, Gcamp6m प्रतिदीप्ति बढ़ जाती है। इस प्रतिदीप्ति परिवर्तन का सामान्यीकरण और परिमाणीकरण स्टाइरिल डाई प्रोटोकॉल के समान तरीके से किया जाता है। इन विधियों को फ्लोरोसेंटली टैग किए गए उत्परिवर्ती प्रोटीन के अभिकर्मक-आधारित ओवरएक्सप्रेशन के साथ मल्टीप्लेक्स किया जा सकता है। इन प्रोटोकॉल का बड़े पैमाने पर FUS-ALS और C9ORF72-ALS के मॉडल में सिनैप्टिक डिसफंक्शन का अध्ययन करने के लिए उपयोग किया गया है, जो प्राथमिक कृंतक कॉर्टिकल और मोटर न्यूरॉन्स का उपयोग करता है। ये प्रोटोकॉल आसानी से उन यौगिकों की तेजी से स्क्रीनिंग की अनुमति देते हैं जो न्यूरोनल संचार में सुधार कर सकते हैं। इस प्रकार, ये विधियां न केवल एएलएस के अध्ययन के लिए बल्कि न्यूरोडीजेनेरेटिव और विकासात्मक तंत्रिका विज्ञान अनुसंधान के सभी क्षेत्रों के लिए मूल्यवान हैं।
Introduction
प्रयोगशाला में मॉडलिंग एमियोट्रोफिक लेटरल स्केलेरोसिस (एएलएस) को 80% से अधिक मामलों की भारी छिटपुट प्रकृति के कारण विशिष्ट रूप से चुनौतीपूर्ण बनाया गया है1, जो रोग-प्रेरक 2 के रूप में जाने जाने वाले आनुवंशिक उत्परिवर्तन की विशाल संख्या के साथ युग्मित है। इसके बावजूद, एएलएस के सभी मामले एकीकृत विशेषता को साझा करते हैं कि एकमुश्त न्यूरोनल अध: पतन से पहले, प्रीसिनेप्टिक मोटर न्यूरॉन्स और पोस्टसिनेप्टिक मांसपेशी कोशिकाओं के बीच बेकार संचार होता है3,4। नैदानिक रूप से, जैसा कि रोगी शेष ऊपरी और निचले मोटर न्यूरॉन्स की कनेक्टिविटी खो देते हैं, वे पूरे रोग 5,6,7,8,9 में न्यूरोनल हाइपर- और हाइपोएक्साइटबिलिटी की विशेषताओं के साथ पेश करते हैं, जो इन synapses में जटिल अंतर्निहित आणविक परिवर्तनों को दर्शाते हैं, जिसे हम, एएलएस शोधकर्ताओं के रूप में, समझना चाहते हैं।
एकाधिक ट्रांसजेनिक मॉडल ने सचित्र किया है कि न्यूरोमस्कुलर जंक्शन की गिरावट और अव्यवस्था एएलएस-प्रेरक आनुवंशिक उत्परिवर्तन की अभिव्यक्ति के साथ होती है, जिसमें SOD110, FUS11,12, C9orf7213,14,15,16, और TDP4317,18,19 शामिल हैं। रूपात्मक मूल्यांकन के माध्यम से, जिसमें सिनैप्टिक बाउटन, रीढ़ की हड्डी के घनत्व और पूर्व / पोस्टसिनेप्टिक संगठन का मूल्यांकन शामिल है। यंत्रवत रूप से, 1 9 30 के दशक में कोल, हॉजकिन और हक्सले के ऐतिहासिक कागजात के बाद से, इन विट्रो सेल संस्कृति या ऊतक स्लाइस तैयारी में इलेक्ट्रोफिजियोलॉजिकल तकनीकों के माध्यम से सिनैप्टिक प्रतिक्रियाओं का मूल्यांकन करना भी संभव हो गया है। इन रणनीतियों के माध्यम से, एएलएस के कई मॉडलों ने सिनैप्टिक ट्रांसमिशन घाटे का प्रदर्शन किया है। उदाहरण के लिए, TDP43 का एक उत्परिवर्ती संस्करण बढ़ी हुई फायरिंग आवृत्ति का कारण बनता है और एनएससी -34 (रीढ़ की हड्डी एक्स न्यूरोब्लास्टोमा हाइब्रिड सेल लाइन 34) मोटर-न्यूरॉन जैसी कोशिकाओं 21 में एक्शन पोटेंशियल थ्रेशोल्ड को कम करता है। यह एक ही संस्करण भी एक माउस model22 में व्यवहार मोटर घाटे की शुरुआत से पहले neuromuscular जंक्शन (NMJ) पर बेकार synaptic संचरण का कारण बनता है। यह पहले दिखाया गया था कि उत्परिवर्ती एफयूएस अभिव्यक्ति के परिणामस्वरूप लोकोमोटर दोष 11 से पहले एफयूएस-एएलएस के ड्रोसोफिला मॉडल में एनएमजे पर कम सिनैप्टिक संचरण होता है। C9orf72-विस्तार वाहक से व्युत्पन्न प्रेरित प्लुरिपोटेंट स्टेम कोशिकाओं का उपयोग करके हाल ही में एक रिपोर्ट ने सिनैप्टिक पुटिकाओं 23 के आसानी से पुनरावृत्ति योग्य पूल में कमी का खुलासा किया। कुल मिलाकर, ये अध्ययन और अन्य एएलएस के रोग-प्रासंगिक मॉडल में सिनैप्टिक सिग्नलिंग के अंतर्निहित तंत्र की अधिक व्यापक समझ के निर्माण के महत्व को उजागर करते हैं। यह एएलएस के पैथोबायोलॉजी को समझने और रोगियों के लिए संभावित चिकित्सीय लक्ष्यों को विकसित करने में महत्वपूर्ण होगा।
वर्तमान और वोल्टेज क्लैंपिंग कोशिकाओं के तरीके झिल्ली गुणों को निर्धारित करने में अमूल्य रहे हैं जैसे कि चालकता, आराम झिल्ली क्षमता, और व्यक्तिगत synapses20,24 की क्वांटल सामग्री। हालांकि, इलेक्ट्रोफिजियोलॉजी की महत्वपूर्ण सीमाओं में से एक यह है कि यह तकनीकी रूप से चुनौतीपूर्ण है और केवल एक समय में एक ही न्यूरॉन से अंतर्दृष्टि प्रदान करता है। लाइव-सेल कॉन्फोकल माइक्रोस्कोपी, विशिष्ट फ्लोरोसेंट जांच के साथ युग्मित, न्यूरॉन्स के सिनैप्टिक ट्रांसमिशन की जांच करने का अवसर प्रदान करता है एक स्पैटिओटेम्पोरल तरीके से 25,26,27। हालांकि न्यूरोनल उत्तेजना का एक प्रत्यक्ष उपाय नहीं है, यह प्रतिदीप्ति दृष्टिकोण सिनैप्टिक फ़ंक्शन के दो आणविक सहसंबंधों का एक सापेक्ष माप प्रदान कर सकता है: सिनैप्टिक पुटिका रिलीज और सिनैप्टिक टर्मिनलों पर कैल्शियम क्षणिक।
जब एक कार्रवाई क्षमता न्यूरॉन्स के प्रीसिनेप्टिक टर्मिनल क्षेत्र तक पहुंचती है, तो कैल्शियम क्षणिकों को ट्रिगर किया जाता है, जिससे न्यूरोट्रांसमीटर रिलीज 28 की प्रक्रिया में विद्युत संकेत से संक्रमण की सुविधा मिलती है। वोल्टेज-गेटेड कैल्शियम चैनल इन क्षेत्रों के लिए स्थानीयकृत कसकर कैल्शियम सिग्नलिंग को विनियमित करने के लिए न्यूरोट्रांसमीटर रिलीज 29 के कैनेटीक्स को संशोधित करने के लिए। कैल्शियम transients की पहली रिपोर्ट प्रतिदीप्ति आधारित रिकॉर्डिंग या तो दोहरी तरंग दैर्ध्य संकेतक Fura-2 AM या एकल तरंग दैर्ध्य डाई Fluo-3 AM30,31,32 का उपयोग कर प्रदर्शन किया गया था। जबकि इन रंजकों ने उस समय महान नई अंतर्दृष्टि की पेशकश की थी, वे कई सीमाओं से पीड़ित हैं जैसे कि कोशिकाओं के भीतर गैर-विशिष्ट कंपार्टमेंटलाइजेशन, लेबल कोशिकाओं से सक्रिय या निष्क्रिय डाई हानि, फोटोब्लीचिंग और विषाक्तता यदि समय 33 की विस्तारित अवधि में चित्रित किया जाता है। पिछले दशक में, आनुवंशिक रूप से एन्कोडेड कैल्शियम संकेतक न्यूरोनल गतिविधि के विभिन्न रूपों की इमेजिंग के लिए वर्कहॉर्स बन गए हैं। ये संकेतक कैल्शियम चेलेटर प्रोटीन के साथ एक संशोधित फ्लोरोसेंट प्रोटीन को जोड़ते हैं जो Ca2 + आयन34 के बंधन के बाद तेजी से प्रतिदीप्ति तीव्रता को स्विच करता है। इन नए संकेतकों का आवेदन विशाल है, जो इन विट्रो और विवो सेटिंग्स दोनों में इंट्रासेल्युलर कैल्शियम क्षणिकों के बहुत आसान विज़ुअलाइज़ेशन की अनुमति देता है। इन आनुवंशिक रूप से एन्कोडेड पत्रकारों का एक परिवार, जिसे जीसीएएमपी के रूप में जाना जाता है, अब व्यापक रूप से उपयोग किया जाता है। इन संकेतकों में एक सी-टर्मिनल कैलमोडुलिन डोमेन होता है, जिसके बाद हरे रंग के फ्लोरोसेंट प्रोटीन (जीएफपी) होते हैं, और एक एन-टर्मिनल कैलमोडुलिन-बाइंडिंग क्षेत्र 35,36 द्वारा कैप किए जाते हैं। कैलमोडुलिन डोमेन के लिए कैल्शियम-बाइंडिंग कैलमोडुलिन-बाइंडिंग क्षेत्र के साथ एक बातचीत को ट्रिगर करता है, जिसके परिणामस्वरूप समग्र प्रोटीन संरचना में एक संरचनात्मक परिवर्तन होता है और जीएफपी समूह 35,36 के प्रतिदीप्ति में पर्याप्त वृद्धि होती है। इन वर्षों में, पत्रकारों के इस परिवार ने विशिष्ट कैनेटीक्स (धीमी गति से, मध्यम और तेज) के साथ विशेष कैल्शियम क्षणिकों के लिए अलग-अलग रीडआउट को सक्षम करने के लिए कई विकास किए हैं, जिनमें से प्रत्येक में थोड़ा अलग गुण हैं37,38। यहां, रिपोर्टर GcaMP6 के उपयोग पर प्रकाश डाला गया है, जिसे पहले विवो और इन विट्रो 37 दोनों में न्यूरॉन्स में एकल एक्शन पोटेंशियल और डेंड्राइटिक कैल्शियम क्षणिकों का पता लगाने के लिए दिखाया गया है।
प्रीसिनेप्टिक क्षेत्र में कैल्शियम क्षणिक सिनैप्टिक पुटिका संलयन घटनाओं को ट्रिगर करते हैं, जिससे न्यूरोट्रांसमीटर रिलीज होता है सिनैप्स में और पोस्टसिनेप्टिक सेल 28,39 में सिग्नलिंग घटनाओं की दीक्षा होती है। सिनैप्टिक पुटिकाओं को तेजी से जारी और पुनर्नवीनीकरण दोनों किया जाता है, क्योंकि सेल होमोस्टैटिक रूप से एक स्थिर कोशिका झिल्ली सतह क्षेत्र को बनाए रखता है और संलयन सक्षम झिल्ली-बाध्य पुटिकाओं के आसानी से पुन: प्रयोज्य पूल 40 को बनाए रखता है। यहां उपयोग किए जाने वाले स्टायरिल डाई में लिपिड झिल्ली के प्रति एक आत्मीयता है और विशेष रूप से आसपास के लिपिड वातावरण 41,42 के आदेश के आधार पर इसके उत्सर्जन गुणों को बदलता है। इस प्रकार, यह रीसाइक्लिंग सिनैप्टिक पुटिकाओं को लेबल करने और इन पुटिकाओं के बाद के ट्रैकिंग के लिए एक आदर्श उपकरण है क्योंकि वे बाद में न्यूरोनल उत्तेजना 41,42 के बाद जारी किए जाते हैं। प्रोटोकॉल जो उत्पन्न और अनुकूलित किया गया है, वह गफफील्ड और सहकर्मियों द्वारा शुरू में वर्णित अवधारणाओं का एक अनुकूलन है, जो हमें समय के साथ स्टाइरिल डाई-लेबल वाले सिनैप्टिक पुटिका पंक्टा की कल्पना करने की अनुमति देता है।
यहां, दो संबंधित प्रतिदीप्ति-आधारित तरीकों का वर्णन किया गया है, मज़बूती से सिनैप्टिक ट्रांसमिशन में शामिल विशिष्ट सेलुलर घटनाओं की रिपोर्टिंग। सुसंस्कृत न्यूरॉन्स में विध्रुवीकरण-मध्यस्थता वाले प्रीसिनेप्टिक टर्मिनल कैल्शियम प्रवाह और सिनैप्टिक पुटिका एक्सोसाइटोसिस की गतिशीलता की जांच करने के लिए प्रोटोकॉल को परिभाषित किया गया है। यहां, विधियों और प्रतिनिधि परिणामों को इन विट्रो मॉडल सिस्टम के रूप में प्राथमिक कृंतक कॉर्टिकल या मोटर न्यूरॉन्स का उपयोग करने पर ध्यान केंद्रित किया जाता है, क्योंकि इन सेल प्रकारों का उपयोग करके प्रकाशित अध्ययन हैं43,44। हालांकि, ये विधियां विभेदित मानव i3 कॉर्टिकल-जैसे न्यूरॉन्स 45 पर भी लागू होती हैं, क्योंकि हमें अपनी प्रयोगशाला में वर्तमान में चल रहे प्रयोगों में दोनों प्रोटोकॉल के साथ भी सफलता मिली है। सामान्य प्रोटोकॉल को चरणबद्ध रैखिक प्रारूप में रेखांकित किया गया है, जो चित्र 1 में दिखाया गया है। संक्षेप में, न्यूराइट्स में कैल्शियम गतिशीलता का अध्ययन करने के लिए, परिपक्व न्यूरॉन्स को एक साइटोमेगालोवायरस (सीएमवी) प्रमोटर 37,46 के तहत फ्लोरोसेंट रिपोर्टर जीसीएएमपी 6 एम को व्यक्त करने के लिए प्लास्मिड डीएनए के साथ संक्रमित किया जाता है। ट्रांसफेक्टेड कोशिकाओं में बेसल ग्रीन प्रतिदीप्ति का निम्न स्तर होता है, जो कैल्शियम की उपस्थिति में बढ़ता है। ब्याज के क्षेत्रों को हमारे हेरफेर के दौरान प्रतिदीप्ति परिवर्तनों की निगरानी करने के लिए निर्दिष्ट किया जाता है। यह कैल्शियम में अत्यधिक स्थानिक और अस्थायी रूप से स्थानीयकृत उतार-चढ़ाव को मापा जा सकता है37,46। सिनैप्टिक पुटिका संलयन और रिलीज का मूल्यांकन करने के लिए, परिपक्व न्यूरॉन्स को सिनैप्टिक पुटिका झिल्ली में शामिल स्टाइरिल डाई के साथ लोड किया जाता है क्योंकि वे प्रीसिनेप्टिक कोशिकाओं में न्यूरोट्रांसमीटर के साथ पुनर्नवीनीकरण, सुधार और पुनः लोड किए जाते हैं41,42,43,47,48। इस उद्देश्य के लिए उपयोग किए जाने वाले वर्तमान रंजक न्यूराइट्स के साथ सिनैप्टिक पुटिकाओं को लेबल करते हैं और लाइव-इमेजिंग प्रयोगों में इन क्षेत्रों के लिए एक प्रॉक्सी के रूप में उपयोग किए जाते हैं, जैसा कि क्राज़ेवस्की और सहकर्मियों द्वारा स्टाइरिल डाई और सिनैप्टोटाग्मिन के सह-धुंधला द्वारा दिखाया गया था। यहां शामिल हैं इसी तरह के दाग की प्रतिनिधि छवियां जो भी की गई हैं (चित्रा 2 ए)। पिछले जांचकर्ताओं ने न्यूरोमस्कुलर जंक्शन और हिप्पोकैम्पल न्यूरॉन्स 48,49,50,51,52,53,54,55,56 पर सिनैप्टिक पुटिका गतिशीलता की रिपोर्ट करने के लिए बड़े पैमाने पर इस तरह के रंगों का उपयोग किया है . डाई-लोडेड पुटिकाओं के पंक्टेट क्षेत्रों का चयन करके और पुटिका रिलीज के बाद प्रतिदीप्ति तीव्रता में कमी की निगरानी करके, कार्यात्मक सिनैप्टिक ट्रांसमिशन क्षमता और रिहाई की अस्थायी गतिशीलता का अध्ययन उत्तेजना 43 के बाद किया जा सकता है। दोनों विधियों के लिए, पोटेशियम क्लोराइड की उच्च सांद्रता वाले एक माध्यम को न्यूरोनल गतिविधि की नकल करने के लिए कोशिकाओं को विध्रुवीकृत करने के लिए नियोजित किया जाता है। इमेजिंग पैरामीटर को हमारे उत्तेजना कैप्चर अवधि के बाद बेसलाइन सामान्यीकरण में फैले उप-दूसरे अंतराल को कैप्चर करने के लिए निर्दिष्ट किया जाता है। प्रत्येक समय बिंदु पर प्रतिदीप्ति माप निर्धारित किए जाते हैं, पृष्ठभूमि के लिए सामान्यीकृत होते हैं, और प्रयोगात्मक समय अवधि में परिमाणित होते हैं। कैल्शियम-प्रवाह मध्यस्थता GCaMP6m प्रतिदीप्ति वृद्धि या प्रभावी synaptic पुटिका exocytosis styryl डाई रिलीज प्रतिदीप्ति कमी इस रणनीति के माध्यम से पता लगाया जा सकता है। इन दो प्रोटोकॉल के लिए विस्तृत पद्धतिगत सेटअप और पैरामीटर और उनके लाभों और सीमाओं पर चर्चा नीचे वर्णित हैं।
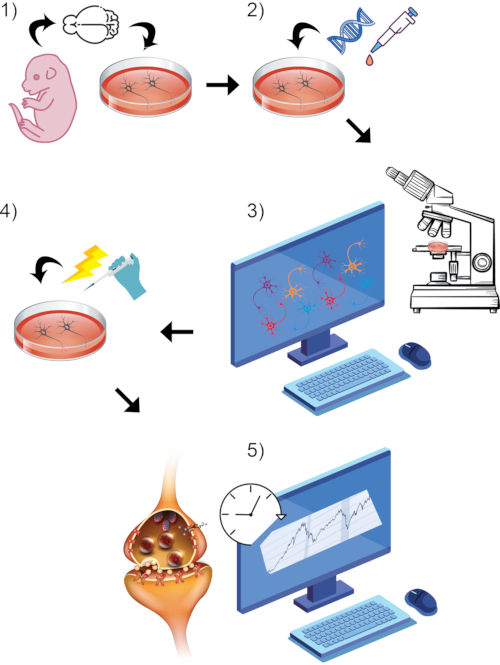
चित्रा 1: समग्र सामान्य प्रोटोकॉल प्रक्रिया का दृश्य रेंडरिंग। (1) पृथक और संस्कृति प्राथमिक कृंतक न्यूरॉन्स विट्रो में चुना परिपक्वता timepoint करने के लिए. (2) GCaMP डीएनए या स्टाइरिल डाई को सिनैप्टिक गतिविधि के पत्रकारों के रूप में पेश करें। (3) लाइव इमेजिंग सुसज्जित confocal माइक्रोस्कोप और संबंधित सॉफ्टवेयर का उपयोग कर सेटअप इमेजिंग प्रतिमान. बेसलाइन रिकॉर्डिंग अवधि प्रारंभ करें. (4) जबकि कोशिकाएं अभी भी लाइव-इमेज कैप्चर से गुजर रही हैं, उच्च केसीएल स्नान परफ्यूजन के माध्यम से न्यूरॉन्स को उत्तेजित करती हैं। (5) कैल्शियम क्षणिक या सिनैप्टिक पुटिका संलयन को मापने के लिए समय के साथ प्रतिदीप्ति तीव्रता माप का आकलन करें। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
Protocol
Representative Results
Discussion
वर्णित दोनों तरीकों के लिए सामान्य तीन कदम प्रयोगात्मक सफलता और मात्रात्मक परिणामों के लिए महत्वपूर्ण महत्व के हैं। सबसे पहले, प्रयोगों के प्रत्येक दौर से पहले ताजा एसीएसएफ की तैयारी आवश्यक है, संलग?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
हम इन तकनीकों और उनके विश्लेषणों को अनुकूलित करने के लिए महत्वपूर्ण प्रतिक्रिया और सुझावों के लिए जेफरसन वेनबर्ग एएलएस सेंटर के वर्तमान और पूर्व सदस्यों को स्वीकार करना चाहते हैं। इस काम को NIH (RF1-AG057882-01 और R21-NS0103118 से D.T.), NINDS (R56-NS092572 और R01-NS109150 से P.P.), मस्कुलर डिस्ट्रॉफी एसोसिएशन (D.T.), ALS Research (D.T.), Robert Packard Center for ALS Research (D.T.), The Family Strong 4 ALS Foundation और Farber Family Foundation (D.T.), The Family Strong 4 ALS Foundation और Farber Family Foundation (D.T.), The Family Strong 4.K., The Family Strong Foundation और Farber Family Foundation (D.T.) से वित्त पोषण द्वारा समर्थित किया गया था।
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
References
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neuroscience. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

