筋萎縮性側索硬化症のモデルにおけるシナプス機能のリアルタイム蛍光測定
Summary
シナプス伝達に必要な細胞内事象を視覚化するために、2つの関連する方法が記載されている。これらのプロトコルは、 in vitro 培養ニューロンの生細胞イメージングを使用して、シナプス前カルシウム流入およびシナプス小胞膜融合のダイナミクスのリアルタイムモニタリングを可能にする。
Abstract
神経変性の前に、筋萎縮性側索硬化症(ALS)および/または前頭葉性認知症(FTLD)患者の運動および認知障害の原因は、ニューロンと運動ニューロンおよび筋肉との間のコミュニケーションの機能不全である。シナプス伝達の根底にあるプロセスは、膜脱分極依存性シナプス小胞融合およびシナプスへの神経伝達物質の放出を含む。このプロセスは、シナプス小胞が存在するシナプス前終末への局在的なカルシウム流入によって起こる。ここで、プロトコルは、培養ニューロンにおける脱分極媒介シナプス小胞エキソサイトーシスおよびシナプス前末端カルシウム流入ダイナミクスを確実に報告する蛍光ベースのライブイメージング方法論を記載する。
シナプス小胞膜に取り込まれたスチリル色素を用いて、シナプス小胞放出が解明される。一方、カルシウムの侵入を研究するために、遺伝子コードされた蛍光レポーターであるGcamp6mが使用される。我々は、ニューロン活性を模倣するために、高い塩化カリウム媒介性脱分極を採用している。シナプス小胞エキソサイトーシスを明確に定量するために、我々は、時間の関数として正規化されたスチリル色素蛍光の損失を測定する。同様の刺激条件下では、カルシウム流入の場合、Gcamp6m蛍光が増加する。この蛍光変化の正規化および定量化は、スチリル色素プロトコールと同様の方法で行われる。これらの方法は、蛍光標識された変異タンパク質のトランスフェクションベースの過剰発現と多重化することができる。これらのプロトコルは、初代げっ歯類皮質および運動ニューロンを利用して、 FUS−ALSおよび C9ORF72−ALSのモデルにおけるシナプス機能障害を研究するために広く使用されている。これらのプロトコルは、ニューロン通信を改善し得る化合物の迅速なスクリーニングを容易に可能にする。したがって、これらの方法は、ALSの研究だけでなく、神経変性および発達神経科学研究のすべての分野にとって貴重です。
Introduction
実験室での筋萎縮性側索硬化症(ALS)のモデリングは、症例の80%以上が圧倒的に散発的な性質を持っている1と、疾患の原因であることが知られている膨大な数の遺伝子変異2のために、他に類を見ないほど困難になっています2。それにもかかわらず、ALSのすべての症例は、完全なニューロン変性の前に、シナプス前運動ニューロンとシナプス後筋細胞との間に機能不全のコミュニケーションがあるという統一的な特徴を共有しています3,4。臨床的には、患者が残りの上部および下部運動ニューロンの接続性を失うにつれて、それらは疾患全体にわたってニューロンの過興奮性および低興奮性の特徴を呈し5、6、7、8、9、これらのシナプスへの複雑な根底にある分子変化を反映しており、ALS研究者として理解しようとしている。
複数のトランスジェニックモデルが、SOD110、FUS11,12、C9orf7213、14、15、16、およびTDP4317,18,19を含むALS原因遺伝子変異の発現とともに神経筋接合部の劣化および解体が起こることを実証している。 シナプスブートン、脊椎密度、シナプス前/シナプス後組織の評価を含む形態学的評価を通じて。機構的には、1930年代にコール、ホジキン、ハクスリーの画期的な論文が発表されて以来、in vitro細胞培養または組織スライス調製物のいずれかにおいて、電気生理学的手法を通じてシナプス応答を評価することも可能であった20。これらの戦略を通じて、ALSの多くのモデルはシナプス伝達欠損を実証している。例えば、TDP43の変異変異体は、NSC-34(脊髄x神経芽腫ハイブリッド細胞株34)の運動ニューロン様細胞21において発火頻度を増強し、活動電位閾値を低下させる。この同じ変異はまた、マウスモデルにおける行動運動欠損の発症前に神経筋接合部(NMJ)で機能不全のシナプス伝達を引き起こす22。変異型FUS発現は、自発運動障害前のFUS-ALSのショウジョウバエモデルにおいてNMJにおけるシナプス伝達の減少をもたらすことが以前に示された11。C9orf72増殖キャリアに由来する誘導多能性幹細胞を用いた最近の報告は、シナプス小胞の容易に放出可能なプールの減少を明らかにした23。全体として、これらの研究や他の研究は、ALSの疾患関連モデルにおけるシナプスシグナル伝達の根底にあるメカニズムのより包括的な理解を構築することの重要性を強調しています。これは、ALSの病態生物学を理解し、患者のための潜在的な治療標的を開発する上で極めて重要である。
電流および電圧クランプ細胞の方法は、コンダクタンス、静止膜電位、および個々のシナプスの量子的含有量などの膜特性を決定する上で非常に貴重であった20,24。しかし、電気生理学の重大な限界の1つは、それが技術的に困難であり、一度に単一のニューロンからの洞察しか提供しないことです。生細胞共焦点顕微鏡は、特異的蛍光プローブと相まって、ニューロンのシナプス伝達を時空間的に調査する機会を提供する25,26,27。ニューロン興奮性の直接的な尺度ではないが、この蛍光アプローチは、シナプス機能の2つの分子相関、すなわちシナプス小胞放出およびシナプス末端におけるカルシウム過渡現象の相対的測定を提供することができる。
活動電位がニューロンのシナプス前終末領域に到達すると、カルシウム一過性が誘発され、電気信号から神経伝達物質放出の過程への移行が容易になる28。これらの領域に局在する電位依存性カルシウムチャネルは、カルシウムシグナル伝達を厳密に調節して、神経伝達物質放出の動態を調節する29。カルシウム過渡現象の最初に報告された蛍光ベースの記録は、二波長指示薬Fura-2 AMまたは単一波長色素Fluo-3 AM30、31、32のいずれかを使用して実施された。これらの色素は当時、大きな新しい洞察を提供していましたが、細胞内の非特異的な区画化、標識細胞からの能動的または受動的な色素損失、フォトブリーチング、長期間にわたって画像化された場合の毒性など、いくつかの制限に苦しんでいます33。過去10年間で、遺伝的にコードされたカルシウム指標は、様々な形態のニューロン活動を画像化するための主力製品となっている。これらの指標は、修飾蛍光タンパク質と、Ca2+イオンの結合後に蛍光強度を急速に切り替えるカルシウムキレートタンパク質とを組み合わせる34。これらの新しい指標の適用は広範であり、in vitroおよびin vivo設定の両方で細胞内カルシウム過渡現象の視覚化をはるかに容易にすることを可能にする。GCaMPとして知られるこれらの遺伝的にコードされたレポーターの1つのファミリーは、現在広く利用されている。これらの指標は、C末端カルモジュリンドメインを含み、続いて緑色蛍光タンパク質(GFP)を含み、N末端カルモジュリン結合領域によってキャップされている35、36。カルモジュリンドメインへのカルシウム結合は、カルモジュリン結合領域との相互作用を誘発し、タンパク質全体の構造における立体構造変化およびGFP部分の蛍光の実質的な増加をもたらす35,36。長年にわたり、このレポーターファミリーは、それぞれがわずかに異なる特性を有する特定の動態(低速、中速、および高速)を有する特定のカルシウム過渡現象について、異なる読み出しを可能にするために、いくつかの進化を遂げてきた37,38。ここで、レポーターGcaMP6の使用が強調されており、これは、インビボおよびインビトロの両方のニューロンにおける単一活動電位および樹状カルシウム一過性を検出することが以前に示されている37。
シナプス前領域のカルシウム一過性はシナプス小胞融合事象を誘発し、シナプスへの神経伝達物質放出を引き起こし、シナプス後細胞におけるシグナル伝達事象の開始を引き起こす28,39。シナプス小胞は、細胞が恒常的に安定した細胞膜表面積および容易に放出可能な融合可能な膜結合小胞のプールを維持するので、急速に放出され、リサイクルされる40。ここで使用されるスチリル色素は、脂質膜に対して親和性を有し、周囲の脂質環境の秩序に基づいてその発光特性を特異的に変化させる41、42。したがって、これは、シナプス小胞のリサイクルを標識し、ニューロン刺激後に後に放出されるこれらの小胞のその後の追跡のための理想的なツールである41,42。生成および最適化されたプロトコルは、Gaffieldらによって最初に記述された概念の適応であり、スチリル色素標識シナプス小胞穿刺を経時的に連続的に視覚化することを可能にする41。
ここでは、2つの関連する蛍光ベースの方法論が記載されており、シナプス伝達に関与する特定の細胞事象を確実に報告する。培養ニューロンにおける脱分極媒介シナプス前終末カルシウム流入およびシナプス小胞エキソサイトーシスのダイナミクスをプローブするためのプロトコルが定義されている。ここで、方法および代表的な結果は、これらの細胞型を用いた公表された研究があるように、インビトロモデル系として原発性げっ歯類皮質または運動ニューロンを使用することに焦点を当てている43,44。しかし、これらの方法は、分化したヒトi3皮質様ニューロン45にも適用可能であり、現在、当研究室で進行中の実験では、両方のプロトコルでも成功しています。一般的なプロトコルは、図1に示すステップワイズ線形形式で概説されています。要するに、神経突起におけるカルシウム動態を研究するために、成熟ニューロンをプラスミドDNAでトランスフェクトし、サイトメガロウイルス(CMV)プロモーター下で蛍光レポーターGCaMP6mを発現させる37、46。トランスフェクトされた細胞は、低レベルの基底緑色蛍光を有し、カルシウムの存在下で増加する。関心領域は、我々の操作全体を通して蛍光変化を監視するために指定される。これにより、カルシウムの高度に空間的および時間的に局在する変動を測定することができます37,46。シナプス小胞の融合と放出を評価するために、成熟ニューロンはシナプス前細胞で神経伝達物質でリサイクルされ、改質され、リロードされるにつれてシナプス小胞膜に取り込まれたスチリル色素をロードされる41,42,43,47,48。この目的のために使用されている現在の色素は、神経突起に沿ってシナプス小胞を標識し、Kraszewskiらによるスチリル色素とシナプトタグミンの共染色によって示されたように、ライブイメージング実験においてこれらの領域の代理として使用されている49。ここにも実施された同様の染色の代表的な画像が含まれる(図2A)。これまでの研究者らは、神経筋接合部および海馬ニューロンにおけるシナプス小胞ダイナミクスを報告するために、このような色素を広範囲に使用してきた48,49,50,51,52,53,54,55,56.色素を負荷した小胞の点状領域を選択し、小胞放出後の蛍光強度の低下をモニタリングすることにより、刺激後の機能的シナプス伝達能力および放出の時間的ダイナミクスを研究することができる43。両方の方法において、高濃度の塩化カリウムを含む培地が使用され、細胞を脱分極させてニューロン活性を模倣する。イメージングパラメータは、ベースライン正規化とそれに続く刺激キャプチャ期間にまたがる1秒未満の間隔をキャプチャするように指定されます。各時点での蛍光測定値が決定され、バックグラウンドに正規化され、実験期間にわたって定量化されます。カルシウム流入媒介性GCaMP6m蛍光増加または効果的なシナプス小胞エキソサイトーシスチリル色素放出蛍光減少は、この戦略を通して検出することができる。これら2つのプロトコルの詳細な方法論的セットアップとパラメータ、およびそれらの利点と制限事項に関する議論については、以下で説明します。
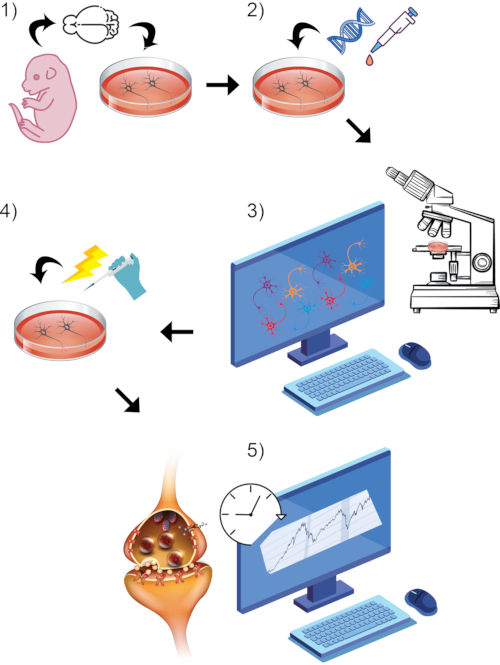
図 1: 一般的なプロトコル プロセス全体の視覚的レンダリング。 (1)初代げっ歯類ニューロンを単離し、選択した成熟時点まで インビトロで 培養する。(2)シナプス活性のレポーターとしてGCaMP DNAまたはスチリル色素を導入する。(3)ライブイメージング搭載共焦点顕微鏡と関連ソフトウェアを用いたイメージングパラダイムの設定ベースライン記録期間を開始します。(4)細胞がまだライブ画像キャプチャを受けている間、高いKCl浴灌流を介してニューロンを刺激する。(5)蛍光強度測定値を経時的に評価し、カルシウム過渡現象またはシナプス小胞融合を測定する。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
記載されている両方の方法に共通する3つのステップは、実験の成功と定量化可能な結果にとって非常に重要です。まず、各実験ラウンドの前に新鮮なaCSFの調製が不可欠であり、添付の指示に従ってください。そうしないと、適切なニューロン脱分極を妨げる可能性があります。未処理の対照ニューロンのサンプルは、適切な細胞脱分極を確実にし、そのイメージングセッションで得られた?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ジェファーソン・ワインバーグALSセンターの現在および以前のメンバーの皆様には、これらの技術とその分析を最適化するための批判的なフィードバックと提案をお寄せいただき、誠にありがとうございます。この研究は、NIH(RF1-AG057882-01およびR21-NS0103118からD.T.まで)、NINDS(R56-NS092572およびR01-NS109150からP.P.まで)、筋ジストロフィー協会(D.T.)、ロバートパッカードALS研究センター(D.T.)、Family Strong 4 ALS財団、Farber Family Foundation(B.K.J.、K.K.、P.P.)からの資金提供によって支援されました。
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
References
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neuroscience. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

