Флуоресцентное измерение синаптических функций в реальном времени в моделях бокового амиотрофического склероза
Summary
Описаны два связанных метода для визуализации субклеточных событий, необходимых для синаптической передачи. Эти протоколы позволяют в режиме реального времени отслеживать динамику пресинаптического притока кальция и слияния синаптических везикулных мембран с использованием визуализации живых клеток культивируемых нейронов in vitro .
Abstract
До дегенерации нейронов причиной двигательного и когнитивного дефицита у пациентов с боковым амиотрофическим склерозом (БАС) и/или деменцией лобно-височной доли (FTLD) является нарушение связи между нейронами и двигательными нейронами и мышцами. Основной процесс синаптической передачи включает мембранно-деполяризационно-зависимое синаптическое слияние везикул и высвобождение нейротрансмиттеров в синапс. Этот процесс происходит через локализованный приток кальция в пресинаптические терминали, где находятся синаптические везикулы. Здесь протокол описывает флуоресцентные методологии визуализации в реальном времени, которые надежно сообщают о деполяризационно-опосредованном синаптическом экзоцитозе везикул и динамике притока пресинаптического терминального кальция в культивируемых нейронах.
Используя стириловый краситель, который включен в синаптические пузырьковые мембраны, выясняется высвобождение синаптических пузырьков. С другой стороны, для изучения поступления кальция используется Gcamp6m, генетически закодированный флуоресцентный репортер. Мы используем высокую деполяризацию, опосредованную хлоридом калия, для имитации активности нейронов. Чтобы однозначно количественно оценить экзоцитоз синаптических пузырьков, мы измеряем потерю нормализованной флуоресценции стирилового красителя как функцию времени. При аналогичных условиях стимуляции, в случае притока кальция, флуоресценция Gcamp6m увеличивается. Нормализация и количественная оценка этого изменения флуоресценции выполняются аналогично протоколу стирилового красителя. Эти методы могут быть мультиплексированы с трансфекционной сверхэкспрессией флуоресцентно помеченных мутантных белков. Эти протоколы широко использовались для изучения синаптической дисфункции в моделях FUS-ALS и C9ORF72-ALS, используя первичные корковые и двигательные нейроны грызунов. Эти протоколы легко позволяют проводить быстрый скрининг соединений, которые могут улучшить нейронную связь. Таким образом, эти методы ценны не только для изучения БАС, но и для всех областей исследований нейродегенеративной и развивающей нейробиологии.
Introduction
Моделирование бокового амиотрофического склероза (БАС) в лаборатории становится уникально сложным из-за чрезвычайно спорадического характера более 80% случаев1 в сочетании с огромным количеством генетических мутаций, которые, как известно, являются причинами заболеваний2. Несмотря на это, все случаи БАС объединяет та особенность, что до прямой нейрональной дегенерации существует дисфункциональная связь между пресинаптическими двигательными нейронами и постсинаптическими мышечными клетками3,4. Клинически, поскольку пациенты теряют связность оставшихся верхних и нижних двигательных нейронов, у них проявляются особенности гипер- и гиповозбудимости нейронов на протяжении всего заболевания5,6,7,8,9, отражающие сложные молекулярные изменения этих синапсов, которые мы, как исследователи БАС, стремимся понять.
Многочисленные трансгенные модели показали, что ухудшение и дезорганизация нервно-мышечного соединения происходит с экспрессией БАС-причинных генетических мутаций, включая SOD110, FUS11,12, C9orf7213,14,15,16 и TDP4317,18,19 посредством морфологических оценок, включая оценку синаптических бутонов, плотности позвоночника и пред/постсинаптической организации. Механически, начиная с знаковых работ Коула, Ходжкина и Хаксли в 1930-х годах, также стало возможным оценивать синаптические реакции с помощью электрофизиологических методов либо в культуре клеток in vitro, либо в препаратах среза ткани20. Благодаря этим стратегиям многие модели БАС продемонстрировали дефицит синаптической передачи. Например, мутантный вариант TDP43 вызывает повышенную частоту срабатывания и снижает порог потенциального действия в NSC-34 (спинной мозг x гибридная клеточная линия 34 нейробластомы) моторно-нейроноподобных клетках21. Этот же вариант также вызывает дисфункциональную синаптическую передачу в нервно-мышечном соединении (NMJ) до начала поведенческого двигательного дефицита у мышиной модели22. Ранее было показано, что мутантная экспрессия FUS приводит к снижению синаптической передачи в NMJ в модели дрозофилы FUS-ALS до дефектов опорно-двигательного аппарата11. Недавний отчет с использованием индуцированных плюрипотентных стволовых клеток, полученных из носителей расширения C9orf72, показал уменьшение легко высвобождаемого пула синаптических везикул23. В целом, эти и другие исследования подчеркивают важность построения более полного понимания механизмов, лежащих в основе синаптической сигнализации в моделях БАС, связанных с заболеванием. Это будет иметь решающее значение для понимания патобиологии БАС и разработки потенциальных терапевтических целей для пациентов.
Методы зажимных ячеек тока и напряжения были неоценимы при определении свойств мембраны, таких как проводимость, мембранный потенциал покоя и квантовое содержание отдельных синапсов20,24. Тем не менее, одним из существенных ограничений электрофизиологии является то, что она технически сложна и дает представление только от одного нейрона за раз. Конфокальная микроскопия живых клеток в сочетании со специфическими флуоресцентными зондами дает возможность исследовать синаптическую передачу нейронов пространственно-временным способом25,26,27. Хотя этот флуоресцентный подход не является прямой мерой возбудимости нейронов, он может обеспечить относительное измерение двух молекулярных корреляций синаптической функции: высвобождения синаптических пузырьков и переходных процессов кальция на синаптических терминалях.
Когда потенциал действия достигает пресинаптической терминальной области нейронов, запускаются переходные процессы кальция, облегчающие переход от электрического сигнала к процессу высвобождения нейромедиатора28. Кальциевые каналы с напряжением, локализованные в этих областях, жестко регулируют передачу сигналов кальция для модуляции кинетики высвобождения нейротрансмиттера29. Первые зарегистрированные флуоресцентные записи переходных процессов кальция были выполнены с использованием либо двухволнового индикатора Fura-2 AM, либо одноволнового красителя Fluo-3 AM30,31,32. Хотя эти красители предлагали большое новое понимание в то время, они страдают от нескольких ограничений, таких как неспецифическая компартментализация внутри клеток, активная или пассивная потеря красителя из меченых клеток, фотоотбеливание и токсичность при изображении в течение длительных периодов времени33. В последнее десятилетие генетически закодированные показатели кальция стали рабочими лошадками для визуализации различных форм нейронной активности. Эти показатели объединяют модифицированный флуоресцентный белок с белком хелатора кальция, который быстро переключает интенсивность флуоресценции после связывания ионов Ca2+34. Применение этих новых показателей обширно, что позволяет значительно упростить визуализацию внутриклеточных переходных процессов кальция как in vitro, так и in vivo. Одно семейство этих генетически закодированных репортеров, известное как GCaMP, в настоящее время широко используется. Эти индикаторы содержат С-концевой кальмодулиновый домен, за которым следует зеленый флуоресцентный белок (GFP), и ограничены N-концевой аллодулин-связывающей областью35,36. Связывание кальция с кальмодулиновой областью вызывает взаимодействие с кальмодулин-связывающей областью, что приводит к конформационному изменению общей структуры белка и существенному увеличению флуоресценции фрагмента GFP35,36. За прошедшие годы это семейство репортеров претерпело несколько эволюций, чтобы обеспечить четкое считывание для определенных переходных процессов кальция с определенной кинетикой (медленной, средней и быстрой), каждая из которых имеет немного разные свойства37,38. Здесь было подчеркнуто использование репортера GcaMP6, который, как было ранее показано, обнаруживает потенциалы одиночного действия и дендритные переходные процессы кальция в нейронах как in vivo, так и in vitro37.
Переходные процессы кальция в пресинаптической области вызывают события слияния синаптических пузырьков, вызывая высвобождение нейротрансмиттера в синапс и инициирование сигнальных событий в постсинаптической клетке28,39. Синаптические везикулы быстро высвобождаются и рециркулируются, так как клетка гомеостатически поддерживает стабильную площадь поверхности клеточной мембраны и легко высвобождаемый пул везикул, способных к слиянию, связанных с мембраной40. Используемый здесь стириловый краситель имеет сродство к липидным мембранам и специфически изменяет свои эмиссионные свойства в зависимости от упорядочения окружающей липидной среды41,42. Таким образом, это идеальный инструмент для маркировки рециркуляции синаптических везикул и последующего отслеживания этих везикул, поскольку они позже высвобождаются после стимуляции нейронов41,42. Протокол, который был сгенерирован и оптимизирован, является адаптацией концепций, первоначально описанных Гаффилдом и его коллегами, что позволяет нам визуализировать меченую стириловым красителем синаптикальную пузырьковую пункту с течением времени непрерывно41.
Здесь описаны две связанные флуоресцентные методологии, надежно сообщающие о конкретных клеточных событиях, участвующих в синаптической передаче. Были определены протоколы для исследования динамики деполяризационно-опосредованного пресинаптического терминального притока кальция и экзоцитоза синаптических везикул в культивируемых нейронах. Здесь методы и репрезентативные результаты сосредоточены на использовании первичных кортикальных или моторных нейронов грызунов в качестве модельной системы in vitro, поскольку опубликованы исследования с использованием этих типов клеток43,44. Тем не менее, эти методы также применимы к дифференцированным человеческим i3 кортикоподобным нейронам45, поскольку мы также добились успеха с обоими протоколами в текущих экспериментах в нашей лаборатории. Общий протокол описан в пошаговом линейном формате, показанном на рисунке 1. Короче говоря, для изучения динамики кальция в нейритах зрелые нейроны трансфектируют плазмидной ДНК для экспрессии флуоресцентного репортера GCaMP6m под промотором цитомегаловируса (ЦМВ)37,46. Трансфектированные клетки имеют низкий уровень базальной зеленой флуоресценции, которая увеличивается в присутствии кальция. Области, представляющие интерес, задаются для мониторинга изменений флуоресценции во время наших манипуляций. Это позволяет измерять высоко пространственно и временно локализованные колебания кальция37,46. Для оценки слияния и высвобождения синаптических пузырьков зрелые нейроны нагружают стириловым красителем, включенным в синаптические везикулярные мембраны, поскольку они рециркулируются, реформируются и перезаряжаются нейротрансмиттерами в пресинаптических клетках41,42,43,47,48. Современные красители, используемые для этой цели, маркируют синаптические везикулы вдоль нейритов и используются в качестве прокси для этих областей в экспериментах с живой визуализацией, как было показано совместным окрашиванием стирилового красителя и синаптотагмина Крашевским и его коллегами49. Сюда включены репрезентативные изображения аналогичного окрашивания, которые также были выполнены (рисунок 2А). Предыдущие исследователи широко использовали такие красители, чтобы сообщить о динамике синаптических пузырьков в нервно-мышечном соединении и нейронах гиппокампа48,49,50,51,52,53,54,55,56 . Путем выбора пунктатных областей везикул, нагруженных красителем, и мониторинга снижения интенсивности флуоресценции после высвобождения везикул можно изучить функциональную синаптическую пропускную способность и временную динамику высвобождения после стимуляции43. Для обоих способов среда, содержащая высокую концентрацию хлорида калия, используется для деполяризации клеток для имитации активности нейронов. Параметры визуализации задаются для захвата интервалов менее секунды, охватывающих базовую нормализацию, за которой следует наш период захвата стимуляции. Измерения флуоресценции в каждой точке времени определяются, нормализуются на заднем плане и количественно оцениваются в течение экспериментального периода времени. С помощью этой стратегии можно обнаружить опосредованное притоком кальция флуоресценцию GCaMP6m или эффективное снижение флуоресценции высвобождения синаптических везикул экзоцитоза стириловых красителей. Ниже описываются подробные методологические настройки и параметры этих двух протоколов, а также обсуждение их преимуществ и ограничений.
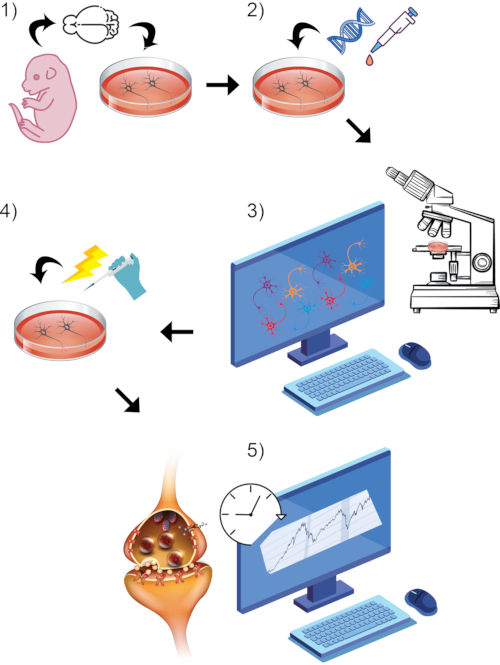
Рисунок 1: Визуальный рендеринг всего процесса общего протокола. (1) Изолировать и культивировать первичные нейроны грызунов in vitro до выбранной временной точки созревания. (2) Ввести ДНК GCaMP или стириловый краситель в качестве репортеров синаптической активности. (3) Настройка парадигмы визуализации с использованием конфокального микроскопа, оснащенного живой визуализацией, и связанного с ним программного обеспечения. Начните базовый период записи. (4) В то время как клетки все еще подвергаются захвату живого изображения, стимулируйте нейроны с помощью перфузии ванны с высоким KCl. (5) Оценка измерений интенсивности флуоресценции с течением времени для измерения переходных процессов кальция или синаптического слияния пузырьков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Три шага, общие для обоих описанных методов, имеют решающее значение для успеха экспериментов и поддающихся количественной оценке результатов. Во-первых, подготовка свежего aCSF перед каждым раундом экспериментов имеет важное значение, следуя прилагаемым инструкциям. Неспособность сде…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы хотели бы поблагодарить нынешних и бывших членов Центра ALS Джефферсона Вайнберга за критические отзывы и предложения по оптимизации этих методов и их анализа. Эта работа была поддержана финансированием nih (RF1-AG057882-01 и R21-NS0103118 to D.T), NINDS (R56-NS092572 и R01-NS109150 to P.P),Ассоциации мышечной дистрофии (D.T.), Центра роберта Паккарда по исследованию БАС (D.T.), фонда Family Strong 4 ALS и Фонда семьи Фарбер (B.K.J., K.K. и P.P.).
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
References
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neuroscience. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

