איסוף, הרחבה והתמיינות של מודלים ראשוניים של תאי אפיתל באף אנושי לכימות תדירות פעימות הריסונים
Summary
פרוטוקול זה מתאר איסוף, הרחבה והתמיינות של תאי אפיתל באף למודלים של תאי אפיתל אורגנוטיפיים של דרכי הנשימה וכימות של תדירות פעימות הריסונים באמצעות הדמיה של תאים חיים וסקריפטים שנבנו בהתאמה אישית.
Abstract
מדידות של תפקוד הריסונים (תדירות פעימה, דפוס) נקבעו ככלי אבחון למחלות בדרכי הנשימה כגון דיסקינזיה ציליארית ראשונית. עם זאת, היישום הרחב יותר של טכניקות אלה מוגבל על ידי הרגישות הקיצונית של תפקוד ציליארי לשינויים בגורמים סביבתיים כגון טמפרטורה, לחות ו- pH. בדרכי הנשימה של חולים עם סיסטיק פיברוזיס (CF), הצטברות ריר מעכבת את הכאת הריסונים. פונקציית הריסונים נחקרה במודלים ראשוניים של תאי דרכי הנשימה כאינדיקטור לפעילות ערוץ מווסת מוליכות טרנסממברנה CF (CFTR). עם זאת, נמצאה שונות ניכרת בין מטופל לחולה בתדירות הכאת הריסונים בתגובה לתרופות המווסתות CFTR, אפילו עבור חולים עם אותן מוטציות של CFTR . יתר על כן, ההשפעה של הפרשת כלוריד מווסתת CFTR לא מתפקדת על תפקוד הריסיון אינה מובנת כהלכה. אין כיום פרוטוקול מקיף המדגים הכנת דגימות של מודלים של נתיבי אוויר במבחנה , רכישת תמונות וניתוח של Cilia Beat Frequency (CBF). תנאי תרבית סטנדרטיים ורכישת תמונות המבוצעים במצב מבוקר סביבתית יאפשרו כימות עקבי וניתן לשחזור של CBF בין אנשים ובתגובה לתרופות המווסתות CFTR. פרוטוקול זה מתאר את הכימות של CBF בשלוש מערכות מודל שונות של תאי אפיתל בדרכי הנשימה: 1) יריעות אפיתל מקוריות, 2) מודלים של ממשק אוויר-נוזל המצולמים על תוספות תמיכה חדירות, ו-3) אורגנואידים תלת-ממדיים מוטמעים במטריצה חוץ-תאית. שני האחרונים משכפלים את הפיזיולוגיה של הריאות in vivo , עם ריסונים מכים וייצור של ריר. הפונקציה הציליארית נלכדת באמצעות מצלמת וידאו במהירות גבוהה בתא הנשלט על ידי הסביבה. סקריפטים שנבנו בהתאמה אישית משמשים לניתוח CBF. תרגום מדידות CBF למרפאה צפוי להיות כלי קליני חשוב לניבוי תגובה לתרופות מווסתות CFTR על בסיס פר מטופל.
Introduction
מדידות של תדירות פעימת ריסונים (CBF) ודפוס נקבעו ככלי אבחון למחלות בדרכי הנשימה כגון דיסקינזיה ריסיאלית ראשונית (PCD)1. בסיסטיק פיברוזיס (CF), תפקוד לקוי של תעלת הכלוריד של מווסת מוליכות טרנסממברנה CF (CFTR) גורם להתייבשות של נוזל פני השטח של דרכי הנשימה ולפגיעה בפינוי ליחה2. פונקציה ציליארית נחקרה במבחנה במודלים ראשוניים של תאי דרכי הנשימה כאינדיקטור לפעילות ערוץ CFTR3. עם זאת, קיימת שונות ניכרת בין חולה לחולה ב-CBF בתגובה לתרופות המווסתות CFTR, אפילו עבור חולים עם אותן מוטציות CFTR 3. יתר על כן, ההשפעה של הפרשת כלוריד מווסתת CFTR לא מתפקדת על תפקוד הריסיון אינה מובנת כהלכה. אין כיום פרוטוקול מקיף המדגים הכנת דגימות של מודלים של נתיבי אוויר במבחנה , רכישת תמונות וניתוח של CBF.
יריעות אפיתל לאף המבודדות ממברשות רירית האף משמשות ישירות למדידות של תפקוד ציליארי לאבחון PCD4. עם זאת, בעוד שאין שליטה על הגודל או האיכות של יריעות אפיתל האף המתקבלות, CBF משתנה בהתאם לשאלה אם הוא נמדד על תאים בודדים או יריעות תאים ועל קצוות יריעות אפיתל משובשות או ללא הפרעה5. ככזה, דיסקינזיות משניות הנגרמות על ידי נזק לתאים במהלך איסוף של מברשות רירית האף עשויות להשפיע על CBF. תרבית תאים ראשונית של תאי אפיתל באף והתמיינותם בממשק אוויר-נוזל (ALI) או במטריצת קרום מרתף תלת-ממדית לאורגנואידים אפיתליאליים של דרכי הנשימה יוצרים ריסונים נקיים מדיסקינזיות משניות 4,6,7,8. תאי אפיתל של דרכי הנשימה המתמיינים ב- ALI (המכונים מעתה מודלים ALI) נחשבו לכלי אבחון משני חשוב המשכפל את דפוסי הפעימה והתדירות של צחצוח רירית האף ex vivo 6 ומאפשר ניתוח של אולטרה-מבנה ציליארי, תבנית פעימה ותדירות פעימה תוך שמירה על פגמים ספציפיים למטופל9 . עם זאת, קיימים פערים במתודולוגיות המשמשות ליצירת מודלים של תאים ממוינים מדומים, ליחה. פרוטוקולי הרחבה או הבחנה שונים של תרביות יכולים לגרום לפנוטיפים אפיתליאליים מובחנים (ciliated או secretory)10 ולגרום להבדלים משמעותיים ב-CBF11. CBF כומתה במברשות אפיתל לאף 4,6,12,13,14,15,16, אורגנואידים אפיתל של דרכי הנשימה 14,17,18 ודגמי ALI 3,4,6,13,19,20, 21. עם זאת, בין פרוטוקולים אלה, יש שונות גדולה, ולעתים קרובות פרמטרים רבים אינם מבוקרים. לדוגמה, במחקרים מסוימים, CBF מצולם באתרו בעוד שהתאים של מודל ALI נשארים על תוספת התמיכה החדירה 3,19,20,21, אך אחרים מגרדים את התאים מתוספת התמיכה החדירה ומדמיינים אותם תלויים במדיה 4,6,13.
יתר על כן, היישום הרחב יותר של טכניקות המודדות את הפונקציה הציליארית מוגבל על ידי הרגישות הקיצונית של הפונקציה הציליארית לשינויים בגורמים סביבתיים. גורמים סביבתיים כגון טמפרטורה22, לחות 23,24 ו- pH 25,26 משפיעים על תפקוד הציליארי ויש לווסת אותם כדי לכמת CBF במדויק. הפרמטרים הפיזיולוגיים השונים המשמשים במעבדות שונות וכיצד הם משפיעים על CBF נבדקו בעבר27.
בספרות מדווחות טכנולוגיות הדמיה וגישות שונות למדידות CBF. עבור אבחון PCD, מיקרוסקופיית וידאו משמשת למדידת תפקוד ציליארי28,29. לאחרונה, נעשה שימוש באלגוריתם ניתוח וידאו המבוסס על מיקרוסקופיה דינמית דיפרנציאלית כדי לכמת הן CBF והן תיאום ריסונים במודלים של תאי אפיתל ALI של דרכי הנשימה 3,30. שיטה זו מאפשרת אפיון של הכאה ציליארית בתאי אפיתל דרכי הנשימה באופן מהיר ואוטומטי לחלוטין, ללא צורך בפילוח או בחירת אזורים. שיטות שונות להדמיה וכימות של CBF עשויות להוסיף להבדלים המדווחים ב-CBF בספרות (קובץ משלים 1).
פרוטוקול מתרבות לכימות לייעול השיטות הקיימות, סטנדרטיזציה של תנאי התרבות ורכישת תמונות, המבוצעות בתנאים קפדניים מבוקרים סביבתית, יאפשרו כימות עקבי וניתן לשחזור של CBF בתוך ובין פרטים.
פרוטוקול זה מספק תיאור מלא של אוסף תאי אפיתל, תנאי תרבית התפשטות והתמיינות, וכימות של CBF בשלוש מערכות מודל שונות של תאי אפיתל בדרכי הנשימה ממקור האף: 1) יריעות אפיתל מקוריות, 2) מודלים של ALI המצולמים על תוספות תמיכה חדירות ו-3) אורגנואידים תלת-ממדיים מוטמעים על-ידי מטריצה חוץ-תאית (ECM) (איור 1) ). תאי אפיתל באף המתקבלים ממברשות טורבינאט נחותות באף משמשים כנציגים של אפיתל דרכי הנשימה מכיוון שהם פונדקאית יעילה לתאי אפיתל הסימפונות31 תוך התגברות על ההליך הפולשני הקשור לאיסוף מברשות הסימפונות. שיטת תא התכנות מחדש המותנה (CRC) משמשת להרחבת תאי אפיתל ראשוניים של דרכי הנשימה ליצירת מודלים של ALI ואורגנואידים תלת-ממדיים. תכנות מחדש מותנה של תאי אפיתל דרכי הנשימה למצב דמוי תאי גזע מושרה על ידי תרבית משותפת עם מערכת תאי הזנה פיברובלסטים שנעצרה בגדילה ומעכב קינאז הקשור ל-Rho (ROCK)32. חשוב לציין ששיטת CRC מגדילה את הכפלת האוכלוסייה בתאי אפיתל בדרכי הנשימה תוך שמירה על פוטנציאל ההתמיינות הספציפי לרקמות שלהם33,34. בכל דגמי תאי האפיתל של דרכי הנשימה, הפונקציה הציליארית נלכדת בתא מבוקר טמפרטורה באמצעות מצלמת וידאו במהירות גבוהה עם הגדרות סטנדרטיות לקליטת תמונה. סקריפטים שנבנו בהתאמה אישית משמשים לכימות של CBF.
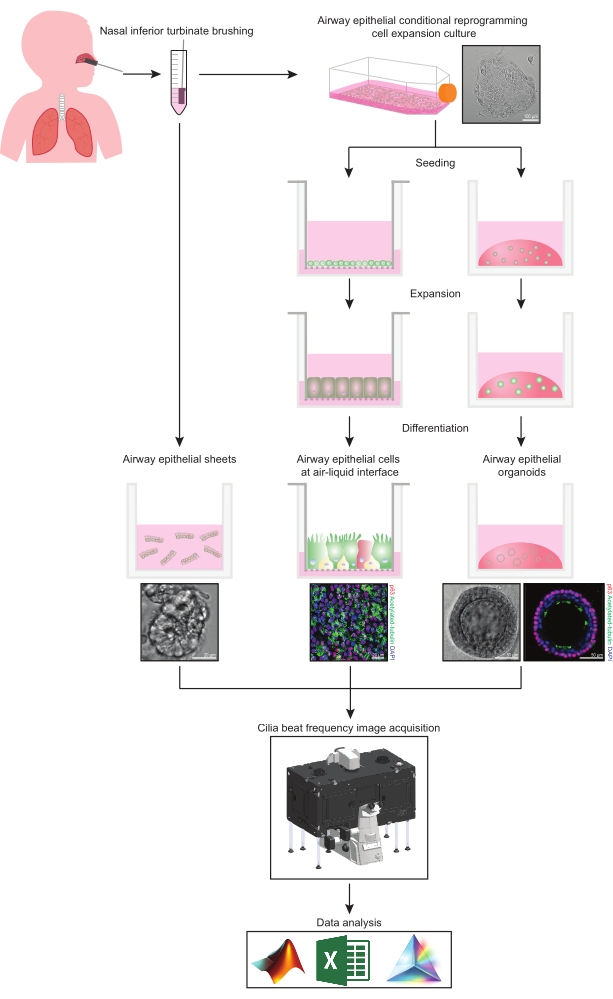
איור 1: סכימה של זרימת עבודה. לאחר צחצוח הטורבינציה הנחותה באף של המשתתפים, תאי אפיתל דרכי הנשימה מנוצלים באחת משתי דרכים. או יריעות אפיתל של דרכי הנשימה מבודדות, ותדר פעימות הריסונים מצולם מיד, או שתאי אפיתל של דרכי הנשימה מורחבים באמצעות שיטת התכנות מחדש המותנית של התא. תאי אפיתל של דרכי הנשימה המורחבים על-ידי CRC מתמיינים כדי ליצור תאי אפיתל של דרכי הנשימה בממשק אוויר-נוזל או בתרביות אפיתל אורגנואידיות של דרכי הנשימה. הדמיה של תדר פעימה ציליארית נרכשת באמצעות מיקרוסקופ הדמיה של תאים חיים עם תא סביבתי של חימום ולחות ומצלמה מדעית בקצב פריימים מהיר (>100 הרץ). ניתוח הנתונים מתבצע באמצעות סקריפטים שנבנו בהתאמה אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
ישנם גורמים רבים שיכולים לטשטש את הכימות של CBF ביריעות אפיתל האף. יש לדמות יריעות אפיתל תוך 3-9 שעות מאיסוף הדגימה מכיוון שהפונקציה הציליארית יציבה ביותר בתקופה זו37. פחות תאי דם אדומים ופסולת הם האופטימליים ביותר להדמיה, שכן אלה מפריעים לאיסוף הנתונים. בעת בחירת ROI להדמיה, חשוב ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים למשתתפי המחקר ולמשפחותיהם על תרומתם. אנו מעריכים את הסיוע של בתי החולים לילדים בסידני (SCH) מחלקת הנשימה של רנדוויק בארגון ואיסוף של ביופסימנים של חולים – תודה מיוחדת לד”ר ג’ון וידג’ר, ד”ר איבון בלסיס, ליאן פלוס, אמנדה תומפסון ורונדה בל. אנו מודים על עזרתם של איווטה סלפסטובה ורנה וון ממתקן המיקרוסקופיה הקלה של קתרינה גאוס במרכז האנליטי ע”ש מארק ויינרייט ב- UNSW Sydney. עבודה זו נתמכת על ידי המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) אוסטרליה (GNT1188987), קרן CF אוסטרליה וקרן בית החולים לילדים בסידני. המחברים רוצים להודות לברית Luminesce – חדשנות לבריאות ילדים על תרומתה ותמיכתה. Luminesce Alliance – חדשנות לבריאות ילדים הוא מיזם משותף ללא מטרות רווח בין רשת בתי החולים לילדים בסידני, מכון המחקר הרפואי לילדים והמכון לסרטן ילדים. הוא הוקם בתמיכת ממשלת NSW כדי לתאם ולשלב מחקר ילדים. Luminesce Alliance מסונפת גם לאוניברסיטת סידני ולאוניברסיטת ניו סאות’ ויילס סידני. KMA נתמך על ידי מלגת תוכנית הכשרה למחקר של ממשלת אוסטרליה. LKF נתמך על ידי מועדון רוטרי של קרן בית החולים לילדים סידני קוב / סידני ומלגות לתואר שני של אוניברסיטת UNSW.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

