Сбор, расширение и дифференциация первичных моделей эпителиальных клеток носа человека для количественной оценки частоты биения ресничек
Summary
Этот протокол описывает сбор, расширение и дифференцировку эпителиальных клеток носа в органотипические модели эпителиальных клеток дыхательных путей и количественную оценку частоты биения ресничек с помощью визуализации живых клеток и специально разработанных сценариев.
Abstract
Измерения функции ресничек (частота ударов, рисунок) были установлены в качестве диагностических инструментов для респираторных заболеваний, таких как первичная цилиарная дискинезия. Однако более широкое применение этих методов ограничено крайней восприимчивостью цилиарной функции к изменениям факторов окружающей среды, таких как температура, влажность и рН. В дыхательных путях пациентов с муковисцидозом (МВ) накопление слизи препятствует биению ресничек. Функция ресничек была исследована в моделях первичных клеток дыхательных путей в качестве индикатора активности канала трансмембранного регулятора проводимости CF (CFTR). Тем не менее, значительная вариабельность частоты биения ресничек была обнаружена в ответ на препараты, модулирующие CFTR, даже для пациентов с теми же мутациями CFTR . Кроме того, влияние дисфункциональной секреции хлоридов, регулируемой CFTR, на цилиарную функцию плохо изучено. В настоящее время не существует всеобъемлющего протокола, демонстрирующего пробоподготовку моделей дыхательных путей in vitro , получение изображений и анализ частоты биения ресничек (CBF). Стандартизированные условия культивирования и получение изображений, выполняемые в экологически контролируемых условиях, позволят обеспечить последовательную, воспроизводимую количественную оценку CBF между отдельными лицами и в ответ на препараты, модулирующие CFTR. Этот протокол описывает количественную оценку CBF в трех различных системах моделей эпителиальных клеток дыхательных путей: 1) нативные эпителиальные листы, 2) модели интерфейса воздух-жидкость, изображенные на проницаемых опорных вставках, и 3) внеклеточные матрикс-встроенные трехмерные органоиды. Последние два воспроизводят физиологию легких in vivo , с биением ресничек и выработкой слизи. Цилиарная функция захватывается с помощью высокоскоростной видеокамеры в камере, контролируемой окружающей средой. Для анализа CBF используются пользовательские скрипты. Предполагается, что перевод измерений CBF в клинику станет важным клиническим инструментом для прогнозирования ответа на CFTR-модулирующие препараты на основе каждого пациента.
Introduction
Измерения частоты биения ресничек (CBF) и паттерна были установлены в качестве диагностических инструментов для респираторных заболеваний, таких как первичная цилиарная дискинезия (PCD)1. При муковисцидозе (МВ) дисфункция хлоридного канала регулятора трансмембранной проводимости CF (CFTR) вызывает обезвоживание жидкости поверхности дыхательных путей и нарушение мукоцилиарного клиренса2. Цилиарная функция была исследована in vitro в моделях первичных клеток дыхательных путей в качестве индикатора активности канала CFTR3. Тем не менее, значительная вариабельность между пациентами существует в CBF в ответ на ПРЕПАРАТЫ, модулирующие CFTR, даже для пациентов с теми же мутациями CFTR 3. Кроме того, влияние дисфункциональной секреции хлоридов, регулируемой CFTR, на цилиарную функцию плохо изучено. В настоящее время не существует всеобъемлющего протокола, демонстрирующего выборочную подготовку моделей дыхательных путей in vitro , получение изображений и анализ CBF.
Эпителиальные листы носа, выделенные из расчесок слизистой оболочки носа, непосредственно используются для измерения цилиарной функции для диагностики ПХД4. Тем не менее, хотя нет никакого контроля над размером или качеством полученных листов эпителия носа, CBF варьируется в зависимости от того, измеряется ли он на отдельных клетках или листах клеток и на реснитчатых краях эпителиального листа, которые нарушены или не повреждены5. Таким образом, вторичные дискинезии, вызванные повреждением клеток во время сбора расчесывания слизистой оболочки носа, могут влиять на CBF. Первичная клеточная культура эпителиальных клеток носа и их дифференцировка на воздушно-жидкой границе (ALI) или в трехмерном базальном мембранном матриксе в реснитчатые эпителиальные органоиды дыхательных путей дают начало ресничкам, свободным от вторичных дискинезий 4,6,7,8. Эпителиальные клетки дыхательных путей, дифференцированные в ALI (далее называемые моделями ALI), считаются важным вторичным диагностическим средством, которое воспроизводит паттерны цилиарного биения и частоту расчесывания слизистой оболочки ex vivo носа 6 и позволяет анализировать цилиарную ультраструктуру, паттерн биения и частоту ударов при сохранении специфических для пациента дефектов9 . Тем не менее, существуют расхождения в методологиях, используемых для создания этих псевдостратифицированных, мукоцилиарных дифференцированных моделей клеток. Различные протоколы расширения культуры или дифференцировки могут индуцировать различные эпителиальные фенотипы (реснитчатые или секреторные)10 и приводить к значительным различиям в CBF11. CBF был количественно определен в эпителиальных щеткахноса 4,6,12,13,14,15,16, эпителиальных органоидах дыхательных путей 14,17,18 и моделях ALI 3,4,6,13,19,20, 21. Тем не менее, среди этих протоколов есть большие вариации, и часто многие параметры не контролируются. Например, в некоторых исследованиях CBF визуализируется in situ, в то время как ячейки модели ALI остаются на проницаемой опорной вставке 3,19,20,21, в то время как другие соскребают ячейки с проницаемой опорной вставки и изображают их суспендированными в среде 4,6,13.
Кроме того, более широкое применение методов, измеряющих цилиарную функцию, ограничено крайней восприимчивостью цилиарной функции к изменениям факторов окружающей среды. Факторы окружающей среды, такие как температура22, влажность23,24 и pH25,26, влияют на цилиарную функцию и должны регулироваться для точной количественной оценки CBF. Различные физиологические параметры, используемые в разных лабораториях, и то, как они влияют на CBF, были рассмотрены ранее27.
В литературе сообщается о различных технологиях визуализации и подходах к измерениям CBF. Для диагностики ПХД используется видеомикроскопия для измерения цилиарной функции28,29. Недавно алгоритм видеоанализа, основанный на дифференциальной динамической микроскопии, был использован для количественной оценки как CBF, так и координации ресничек в моделях ALI эпителиальных клеток дыхательных путей 3,30. Этот метод позволяет охарактеризовать цилиарное биение в эпителиальных клетках дыхательных путей быстрым и полностью автоматизированным способом, без необходимости сегментирования или выделения областей. Различные методы визуализации и количественной оценки CBF могут добавить к различиям, о которых сообщается в CBF в литературе (Дополнительный файл 1).
Протокол от культуры к количественной оценке для оптимизации существующих методов, стандартизации условий культивирования и получения изображений, выполняемый в строгих экологически контролируемых условиях, позволил бы обеспечить последовательную, воспроизводимую количественную оценку НБВ внутри и между людьми.
Этот протокол предоставляет полное описание коллекции эпителиальных клеток, условий культуры расширения и дифференцировки, а также количественной оценки CBF в трех различных системах моделей эпителиальных клеток дыхательных путей носового происхождения: 1) нативные эпителиальные листы, 2) модели ALI, изображенные на проницаемых опорных вставках и 3) внеклеточные матрицы (ECM) – встроенные трехмерные органоиды (рисунок 1) ). Эпителиальные клетки носа, полученные из носовых нижних носовых расчесок, используются в качестве представителей эпителия дыхательных путей, поскольку они являются эффективным суррогатом эпителиальных клетокбронхов 31 при преодолении инвазивной процедуры, связанной со сбором бронхиальных расчесок. Метод условного перепрограммирования клеток (CRC) используется для расширения эпителиальных клеток первичных дыхательных путей для создания моделей ALI и трехмерных органоидов. Условное перепрограммирование эпителиальных клеток дыхательных путей в состояние, подобное стволовым клеткам, индуцируется кокультурой с остановленной ростом фидерной клеточной системой фибробластов и ингибитором Rho-ассоциированной киназы (ROCK)32. Важно отметить, что метод CRC увеличивает удвоение популяции в эпителиальных клетках дыхательных путей, сохраняя при этом их тканеспецифический потенциал дифференцировки33,34. Во всех моделях эпителиальных клеток дыхательных путей цилиарная функция захватывается в камере с контролируемой температурой с помощью высокоскоростной видеокамеры со стандартизированными настройками получения изображения. Для количественной оценки CBF используются пользовательские скрипты.
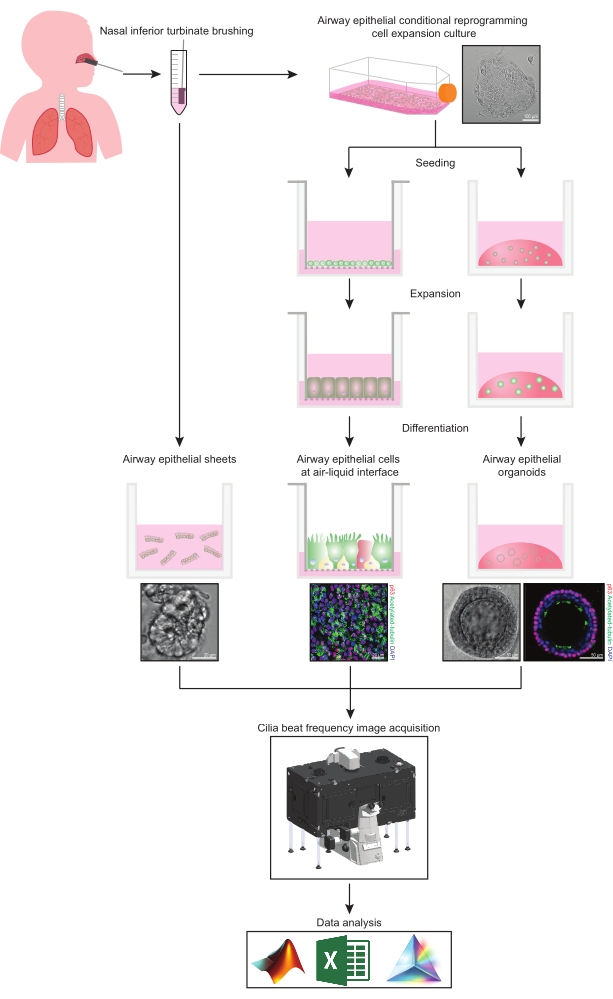
Рисунок 1: Схема рабочего процесса. После расчесывания нижней части носа участников, эпителиальные клетки дыхательных путей используются одним из двух способов. Либо эпителиальные листы дыхательных путей изолированы, и частота биения ресничек визуализируется немедленно, либо эпителиальные клетки дыхательных путей расширяются с помощью метода условного перепрограммирования клеток. CRC-расширенные эпителиальные клетки дыхательных путей дифференцируются для создания эпителиальных клеток дыхательных путей на воздушно-жидком интерфейсе или эпителиальных органоидных культурах дыхательных путей. Визуализация частоты цилиарного биения получена с помощью микроскопа визуализации живых клеток с камерой нагрева и влажности окружающей среды и научной камерой с высокой частотой кадров (>100 Гц). Анализ данных выполняется с помощью пользовательских скриптов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Существует множество факторов, которые могут скрыть количественную оценку CBF в листах эпителия носа. Эпителиальные листы должны быть изображены в течение 3-9 часов после сбора проб, так как цилиарная функция наиболее стабильна в течение этого времени37. Меньшее количество к?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим участников исследования и их семьи за их вклад. Мы ценим помощь сиднейской детской больницы (SCH) Randwick в организации и сборе биообразцов пациентов – особая благодарность доктору Джону Видгеру, доктору Ивонн Белессис, Линн Плюш, Аманде Томпсон и Ронде Белл. Мы признаем помощь Иветы Слапетовой и Рене Ван из Центра световой микроскопии Катарины Гаус в Аналитическом центре Марка Уэйнрайта в UNSW Sydney. Эта работа поддерживается Национальным советом по здравоохранению и медицинским исследованиям (NHMRC) Австралии (GNT1188987), Cf Foundation Australia и Sydney Children’s Hospital Foundation. Авторы хотели бы поблагодарить Luminesce Alliance – Innovation for Children’s Health за его вклад и поддержку. Luminesce Alliance – Innovation for Children’s Health является некоммерческим совместным предприятием между Сетью детских больниц Сиднея, Детским медицинским научно-исследовательским институтом и Детским институтом рака. Он был создан при поддержке правительства Нового Южного Уэльса для координации и интеграции педиатрических исследований. Luminesce Alliance также связан с Сиднейским университетом и Университетом Нового Южного Уэльса в Сиднее. KMA поддерживается стипендией Австралийской правительственной исследовательской учебной программы. LKF поддерживается Ротари клубом Сиднейской бухты / Фондом детской больницы Сиднея и стипендиями для аспирантов Университета UNSW.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

