Récupération assistée du pétrole à l’aide d’une combinaison de biosurfactants
Summary
Nous illustrons les méthodes impliquées dans le criblage et l’identification des microbes producteurs de biosurfactants. Les méthodes de caractérisation chromatographique et d’identification chimique des biosurfactants, déterminant l’applicabilité industrielle du biosurfactant dans l’amélioration de la récupération de l’huile résiduelle sont également présentées.
Abstract
Les biosurfactants sont des composés tensioactifs capables de réduire la tension superficielle entre deux phases de polarités différentes. Les biosurfactants sont apparus comme des alternatives prometteuses aux tensioactifs chimiques en raison de leur toxicité moindre, de leur biodégradabilité élevée, de leur compatibilité environnementale et de leur tolérance aux conditions environnementales extrêmes. Nous illustrons ici les méthodes utilisées pour le criblage des microbes capables de produire des biosurfactants. Les microbes producteurs de biosurfactant ont été identifiés à l’aide de tests d’effondrement de gouttes, d’épandage d’huile et d’indice d’émulsion. La production de biosurfactants a été validée en déterminant la réduction de la tension superficielle du milieu due à la croissance des membres microbiens. Nous décrivons également les méthodes impliquées dans la caractérisation et l’identification des biosurfactants. Une chromatographie sur couche mince du biosurfactant extrait, suivie d’une coloration différentielle des plaques, a été effectuée pour déterminer la nature du biosurfactant. LCMS, RMN 1H et FT-IR ont été utilisés pour identifier chimiquement le biosurfactant. Nous illustrons également les méthodes permettant d’évaluer l’application de la combinaison de biosurfactants produits pour améliorer la récupération de l’huile résiduelle dans une colonne de sable simulée.
Introduction
Les biosurfactants sont les molécules tensio-actives amphipathiques produites par des micro-organismes qui ont la capacité de réduire la surface et la tension interfaciale entre deux phases1. Un biosurfactant typique contient une partie hydrophile qui est généralement composée d’une fraction sucrée ou d’une chaîne peptidique ou d’un acide aminé hydrophile et une partie hydrophobe composée d’une chaîne d’acides gras saturés ou insaturés2. En raison de leur nature amphipathique, les biosurfactants s’assemblent à l’interface entre les deux phases et réduisent la tension interfaciale à la frontière, ce qui facilite la dispersion d’une phase dans l’autre 1,3. Divers types de biosurfactants qui ont été rapportés jusqu’à présent comprennent les glycolipides dans lesquels les glucides sont liés à des acides aliphatiques ou hydroxy-aliphatiques à longue chaîne via des liaisons ester (par exemple, les rhamnolipides, les tréhalolipides et les sophorolipides), les lipopeptides dans lesquels les lipides sont attachés à des chaînes polypeptidiques (par exemple, la surfactine et la lichénysine) et les biosurfactants polymères qui sont généralement composés de complexes polysaccharide-protéine (par exemple, émulsan, liposan, alasan et lipomannane)4. D’autres types de biosurfactants produits par les micro-organismes comprennent les acides gras, les phospholipides, les lipides neutres et les biosurfactants particulaires5. La classe de biosurfactants la plus étudiée est celle des glycolipides et parmi eux la plupart des études ont été rapportées sur les rhamnolipides6. Les rhamnolipides contiennent une ou deux molécules de rhamnose (qui forment la partie hydrophile) liées à une ou deux molécules d’acide gras à longue chaîne (généralement de l’acide hydroxy-décanoïque). Les rhamnolipides sont des glycolipides primaires rapportés en premier chez Pseudomonas aeruginosa7.
Les biosurfactants ont gagné en attention par rapport à leurs homologues chimiques en raison de diverses propriétés uniques et distinctives qu’ils offrent8. Il s’agit notamment d’une plus grande spécificité, d’une toxicité plus faible, d’une plus grande diversité, d’une plus grande facilité de préparation, d’une biodégradabilité plus élevée, d’une meilleure moussage, d’une compatibilité environnementale et d’une activité dans des conditions extrêmes9. La diversité structurelle des biosurfactants (figure S1) est un autre avantage qui leur donne un avantage sur leurs homologues chimiques10. Ils sont généralement plus efficaces et efficients à des concentrations plus faibles, car leur concentration micellaire critique (CMC) est généralement plusieurs fois inférieure à celle des tensioactifs chimiques11. Ils ont été signalés comme étant très thermostables (jusqu’à 100 °C) et peuvent tolérer un pH plus élevé (jusqu’à 9) et des concentrations élevées de sel (jusqu’à 50 g/L)12 , offrant ainsi plusieurs avantages dans les processus industriels, qui nécessitent une exposition à des conditions extrêmes13. La biodégradabilité et la toxicité plus faible les rendent adaptés à des applications environnementales telles que la bioremédiation. En raison des avantages qu’ils offrent, ils ont reçu une attention accrue dans diverses industries comme l’industrie alimentaire, agricole, détergente, cosmétique et pétrolière11. Les biosurfactants ont également attiré beaucoup d’attention dans l’assainissement des hydrocarbures pour l’élimination des contaminants pétroliers et des polluants toxiques14.
Nous rapportons ici la production, la caractérisation et l’application de biosurfactants produits par Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 et Paenibacillus sp. IITD108. Les étapes du criblage, de la caractérisation et de l’application d’une combinaison de biosurfactants pour la récupération assistée du pétrole sont décrites à la figure 1.
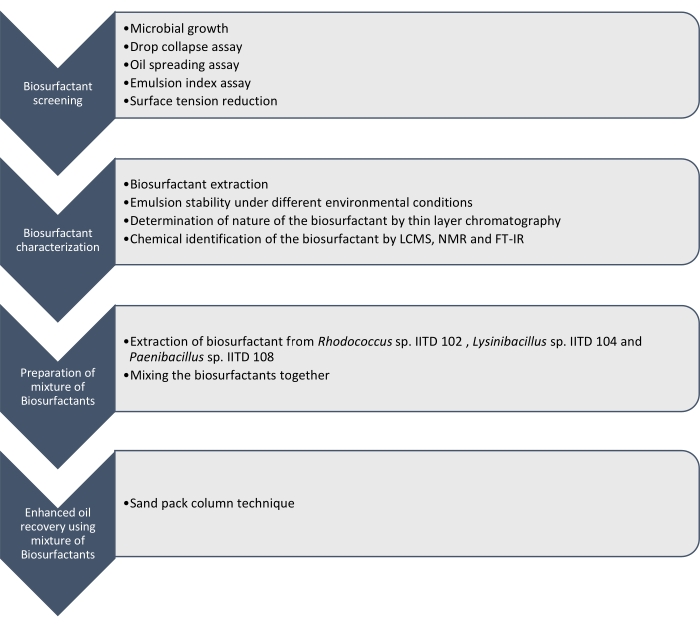
Figure 1 : Méthode de récupération assistée de l’huile à l’aide d’une combinaison de biosurfactants. Le flux de travail par étapes est affiché. Les travaux se sont déroulés en quatre étapes. Tout d’abord, les souches microbiennes ont été cultivées et examinées pour la production de biosurfactant par divers essais, notamment le test d’effondrement des gouttes, le test d’étalement d’huile, le test d’indice d’émulsion et la mesure de la tension superficielle. Ensuite, les biosurfactants ont été extraits du bouillon sans cellules et leur nature a été identifiée à l’aide de la chromatographie sur couche mince et ils ont été identifiés à l’aide de LCMS, RMN et FT-IR. Dans l’étape suivante, les biosurfactants extraits ont été mélangés ensemble et le potentiel du mélange résultant pour une récupération assistée du pétrole a été déterminé à l’aide de la technique de la colonne de sable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le criblage de ces souches microbiennes pour produire des biosurfactants a été effectué par effondrement de gouttes, propagation d’huile, dosage de l’indice d’émulsion et détermination de la réduction de la tension superficielle du milieu sans cellules due à la croissance des microbes. Les biosurfactants ont été extraits, caractérisés et identifiés chimiquement par LCMS, RMN 1H et FT-IR. Enfin, un mélange de biosurfactants produits par ces microbes a été préparé et a été utilisé pour récupérer l’huile résiduelle dans une colonne de sable simulée.
La présente étude illustre seulement les méthodes impliquées dans le criblage, l’identification, la caractérisation structurelle et l’application de la combinaison de biosurfactants sur l’amélioration de la récupération de l’huile résiduelle. Il ne fournit pas de caractérisation fonctionnelle détaillée des biosurfactants produits par les souches microbiennes15,16. Diverses expériences telles que la détermination critique des micelles, l’analyse thermogravimétrique, la mouillabilité de surface et la biodégradabilité sont effectuées pour une caractérisation fonctionnelle détaillée de tout biosurfactant. Mais comme cet article est un document sur les méthodes, l’accent est mis sur le criblage, l’identification, la caractérisation structurelle et l’application de la combinaison de biosurfactants pour améliorer la récupération de l’huile résiduelle; ces expériences n’ont pas été incluses dans cette étude.
Protocol
Representative Results
Discussion
Les biosurfactants sont l’un des groupes les plus polyvalents de composants biologiquement actifs qui deviennent des alternatives attrayantes aux tensioactifs chimiques. Ils ont un large éventail d’applications dans de nombreuses industries telles que les détergents, les peintures, les cosmétiques, l’alimentation, les produits pharmaceutiques, l’agriculture, le pétrole et le traitement de l’eau en raison de leur meilleure mouillabilité, de leur CMC plus faible, de leur structure diversifiée et de leur res…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à remercier le Département de biotechnologie du Gouvernement indien pour son soutien financier.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
References
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

