Recuperação aprimorada do óleo usando uma combinação de biosurfactantes
Summary
Ilustramos os métodos envolvidos na triagem e identificação dos micróbios produtores biosurfactantes. Também são apresentados métodos de caracterização cromatografia e identificação química dos biosurfactantes, determinando a aplicabilidade industrial do biosurfactante no aprimoramento da recuperação residual do óleo.
Abstract
Biosurfactantes são compostos ativos na superfície capazes de reduzir a tensão superficial entre duas fases de diferentes polaridades. Os biosurfactantes vêm surgindo como alternativas promissoras aos surfactantes químicos devido à menor toxicidade, alta biodegradabilidade, compatibilidade ambiental e tolerância a condições ambientais extremas. Aqui, ilustramos os métodos utilizados para a triagem de micróbios capazes de produzir biosurfactantes. Os micróbios produtores de biosurfactantes foram identificados usando o colapso da queda, a propagação do óleo e os ensaios do índice de emulsão. A produção biosufactante foi validada determinando a redução da tensão superficial da mídia devido ao crescimento dos membros microbianos. Descrevemos também os métodos envolvidos na caracterização e identificação de biosurfactantes. A cromatografia de camada fina do biosurfactante extraído seguido de coloração diferencial das placas foi realizada para determinar a natureza do biosurfactante. LCMS, 1H NMR e FT-IR foram utilizados para identificar quimicamente o biosurfactante. Ilustramos ainda os métodos para avaliar a aplicação da combinação de biosurfactantes produzidos para melhorar a recuperação residual do óleo em uma coluna simulada de embalagem de areia.
Introduction
Biosurfactantes são as moléculas anfípáticas de superfície ativa produzidas por microrganismos que têm a capacidade de reduzir a superfície e a tensão interfacial entre duas fases1. Um biosurfactante típico contém uma parte hidrofílica que é geralmente composta de uma moiety de açúcar ou uma cadeia de peptídeos ou aminoácidos hidrofílicos e uma parte hidrofóbica que é composta de uma cadeia de ácidos graxos saturados ou insaturados2. Devido à sua natureza anfípppica, os biosurfactantes se reúnem na interface entre as duas fases e reduzem a tensão interfacial no limite, o que facilita a dispersão de uma fase para a outra 1,3. Vários tipos de biosurfactantes que foram relatados até agora incluem glicolipídios nos quais os carboidratos estão ligados a ácidos alifáticos de cadeia longa ou hidroxia-alifáticos através de ligações éster (por exemplo, rhamnolipids, trehalolipids e sophorolipids), lipopeptides nos quais lipoides são ligados a cadeias de polipeptídeos (por exemplo, surfactina e lichenysina), e biosurfactantes poliméricas que são geralmente compostos de complexos de proteínas polissacarídeos (por exemplo, emulsano, liposano, alasan e lipomannan)4. Outros tipos de biosurfactantes produzidos pelos microrganismos incluem ácidos graxos, fosfolipídios, lipídios neutros e biosurfactantesde partículas 5. A classe mais estudada de biosurfactídeos é a glicoslipids e entre eles a maioria dos estudos foram relatados sobre rhamnolipids6. Os rhamnolipids contêm uma ou duas moléculas de rhamnose (que formam a parte hidrofílica) ligadas a uma ou duas moléculas de ácido graxo de cadeia longa (geralmente ácido hidroxi-decanoico). Rhamnolipids são glicolipídios primários relatados primeiro de Pseudomonas aeruginosa7.
Os biosurfactantes têm ganhado cada vez mais foco em comparação com suas contrapartes químicas devido a várias propriedades únicas e distintas que oferecem8. Estes incluem maior especificidade, menor toxicidade, maior diversidade, facilidade de preparação, maior biodegradabilidade, melhor espuma, compatibilidade ambiental e atividade em condições extremas9. A diversidade estrutural dos biosurfactantes (Figura S1) é outra vantagem que lhes dá uma vantagem sobre as contrapartes químicas10. Eles são geralmente mais eficazes e eficientes em concentrações mais baixas, pois sua concentração crítica de micelas (CMC) é geralmente várias vezes menor do que os surfactantes químicos11. Eles têm sido relatados como altamente termostáveis (até 100 °C) e podem tolerar maior pH (até 9) e altas concentrações de sal (até 50 g/L)12 , assim, oferecem várias vantagens em processos industriais, que requerem exposição a condições extremas13. A biodegradabilidade e a menor toxicidade as tornam adequadas para aplicações ambientais, como a bioremediação. Devido às vantagens que oferecem, eles têm recebido maior atenção em várias indústrias como alimentos, agrícolas, detergentes, cosméticos e indústria petrolífera11. Os biosurfactantes também ganharam muita atenção na remediação do óleo para a remoção de contaminantes de petróleo e poluentes tóxicos14.
Aqui relatamos a produção, caracterização e aplicação de biosurfactantes produzidos por Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108. As etapas envolvidas na triagem, caracterização e aplicação de uma combinação de biosurfactantes para maior recuperação do óleo estão descritas na Figura 1.
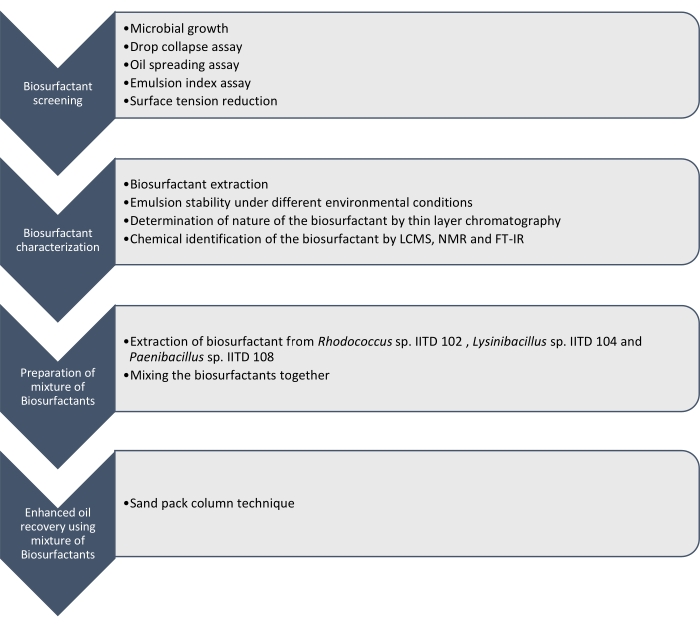
Figura 1: Um método para maior recuperação do óleo usando uma combinação de Biosurfactantes. O fluxo de trabalho stepwise é mostrado. O trabalho foi realizado em quatro etapas. Primeiro, as cepas microbianas foram cultivadas e rastreadas para a produção de biosurfactantes por vários ensaios, que incluíram ensaio de colapso de queda, ensaio de espalhamento de óleo, ensaio de índice de emulsão e medição de tensão superficial. Em seguida, os biosurfactantes foram extraídos do caldo livre de células e sua natureza foi identificada por meio de cromatografia de camada fina e foram ainda identificadas usando LCMS, NMR e FT-IR. Na etapa seguinte, os biosurfactantes extraídos foram misturados e o potencial da mistura resultante para maior recuperação do óleo foi determinado utilizando-se a técnica da coluna de blocos de areia. Clique aqui para ver uma versão maior desta figura.
A triagem dessas cepas microbianas para produzir biosurfactantes foi feita pelo colapso da queda, propagação do óleo, ensaio do índice de emulsão e determinação de redução da tensão superficial do meio livre de células devido ao crescimento dos micróbios. Os biosurfactantes foram extraídos, caracterizados e quimicamente identificados por LCMS, 1H NMR e FT-IR. Finalmente, foi preparada uma mistura de biosurfactantes produzidos por esses micróbios e utilizada para recuperar o óleo residual em uma coluna simulada de embalagem de areia.
O presente estudo ilustra apenas os métodos envolvidos na triagem, identificação, caracterização estrutural e aplicação da combinação biosurfactante no aprimoramento da recuperação residual do óleo. Não fornece uma caracterização funcional detalhada dos biosurfactantes produzidos pelas cepas microbianas15,16. Vários experimentos como determinação crítica de micela, análise termogravimétrica, capacidade de wettability superficial e biodegradabilidade são realizados para caracterização funcional detalhada de qualquer biosurfactante. Mas como este artigo é um artigo de métodos, o foco é a triagem, identificação, caracterização estrutural e aplicação da combinação biosurfactante no aprimoramento da recuperação residual do óleo; esses experimentos não foram incluídos neste estudo.
Protocol
Representative Results
Discussion
Os biosurfactantes são um dos mais versáteis grupos de componentes biologicamente ativos que estão se tornando alternativas atraentes para surfactantes químicos. Eles têm uma ampla gama de aplicações em inúmeras indústrias, como detergentes, tintas, cosméticos, alimentos, produtos farmacêuticos, agricultura, petróleo e tratamento de água devido à sua melhor capacidade de lintibilidade, menor CMC, estrutura diversificada e simpatia ambiental18. Isso levou a um maior interesse em desco…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer ao Departamento de Biotecnologia, Governo da Índia, pelo apoio financeiro.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
References
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

