Strumenti per il trattamento superficiale di microelettrodi intracorticali planari al silicio
Summary
Il presente protocollo descrive gli strumenti per la manipolazione di microelettrodi intracorticali planari al silicio durante i trattamenti per la modifica della superficie tramite deposizione di gas e reazioni acquose della soluzione. L’assemblaggio dei componenti utilizzati per gestire i dispositivi durante la procedura è spiegato in dettaglio.
Abstract
I microelettrodi intracorticali hanno un grande potenziale terapeutico. Ma sono sfidati con una significativa riduzione delle prestazioni dopo periodi di impianto modesti. Un contributo sostanziale al declino osservato è il danno al tessuto neurale prossimale all’impianto e la successiva risposta neuroinfiammatoria. Gli sforzi per migliorare la longevità del dispositivo includono modifiche chimiche o applicazioni di rivestimento sulla superficie del dispositivo per migliorare la risposta del tessuto. Lo sviluppo di tali trattamenti superficiali è tipicamente completato utilizzando sonde “fittizie” non funzionali che mancano dei componenti elettrici necessari per l’applicazione prevista. La traduzione in dispositivi funzionali richiede un’ulteriore considerazione data la fragilità degli array di microelettrodi intracorticali. Gli strumenti di movimentazione facilitano notevolmente i trattamenti superficiali dei dispositivi assemblati, in particolare per le modifiche che richiedono lunghi tempi procedurali. Gli strumenti di manipolazione qui descritti sono utilizzati per i trattamenti superficiali applicati tramite deposizione in fase gassosa ed esposizione alla soluzione acquosa. La caratterizzazione del rivestimento viene eseguita utilizzando l’ellissometria e la spettroscopia fotoelettronica a raggi X. Un confronto delle registrazioni della spettroscopia di impedenza elettrica prima e dopo la procedura di rivestimento sui dispositivi funzionali ha confermato l’integrità del dispositivo dopo la modifica. Gli strumenti descritti possono essere facilmente adattati per dispositivi elettrodi alternativi e metodi di trattamento che mantengono la compatibilità chimica.
Introduction
I dispositivi neuroprotesici mirano a ripristinare le capacità sensoriali e motorie compromesse o assenti in una vasta gamma di popolazioni di pazienti, comprese quelle con lesioni del midollo spinale, sclerosi laterale amiotrofica (SLA), paralisi cerebrale e amputazioni 1,2,3. I microelettrodi intracorticali (IME) possono stabilire un percorso di comunicazione tra i neuroni corticali e i dispositivi utilizzati per controllare le neuroprotesi. Un netto vantaggio dei microelettrodi intracorticali è la loro capacità di registrare segnali neurali ad alta risoluzione spaziale e temporale, che è preferita per la successiva elaborazione del segnale e il controllo delle interfacce cervello-computer 4,5. Sfortunatamente, le prestazioni dei microelettrodi intracorticali si riducono drasticamente entro pochi mesi a un anno dopo l’impianto 2,6,7,8. La perdita di qualità e stabilità del segnale influisce negativamente sull’applicazione della tecnologia.
Un contributo significativo al declino delle prestazioni osservato è la risposta biotica al danno tissutale associato all’impianto e alla neuroinfiammazione cronica 9,10,11. L’impianto di IME infligge danni al tessuto cerebrale, con conseguente rilascio di molecole di segnalazione che avviano cascate di processi di difesa cellulare reazionari. L’interfacciamento cronico esacerba la risposta del corpo estraneo, portando a una neuroinfiammazione sostenuta che danneggia il tessuto prossimale al dispositivo; spesso riconosciuti come sintomi di neuroinfiammazione, cicatrici e neurodegenerazione locale che contribuiscono al declino della registrazione della qualità del segnale 12,13,14,15. Composto da un denso conglomerato di astrociti con microglia e macrofagi attivati trascinati, la cicatrice che incapsula l’elettrodo crea un ambiente locale sfavorevole con ridotto trasporto di materiale e accumulo locale di fattori infiammatori 16,15,16,17,18.
Molti studi hanno descritto la risposta del cervello ai microelettrodi intracorticali o approcci per mitigare la risposta7. La ricerca e lo sviluppo per migliorare la risposta dei tessuti hanno coinvolto una serie di strategie, tra cui modifiche alla struttura generale, alla topologia superficiale, ai materiali e all’applicazione dei rivestimenti. Questi sforzi intendono ridurre al minimo i danni subiti dall’evento di impianto, introdurre un’interfaccia più favorevole tra il dispositivo e le cellule prossimali o ridurre lo sforzo tissutale dopo che i dispositivi sono stati impiantati7. I metodi specificamente mirati alla risposta biologica cronica hanno portato a diversi rivestimenti bioattivi che mirano a stabilizzare il sito di impianto e promuovere chimicamente la salute delle cellule. Gli esempi includono polimeri conduttivi come il poli(etilene diossitiofene) (PEDOT)19,20, i nanotubi di carbonio21, gli idrogel22 e l’aggiunta di molecole e farmaci bioattivi per colpire specifici processi cellulari23,24,25. Il nostro gruppo di ricerca, in particolare, ha esplorato molti meccanismi per promuovere una riduzione della risposta infiammatoria ai microelettrodi impiantati tra cui, ma non solo, minimizzando il trauma associato all’impianto del dispositivo26, minimizzando il disallineamento della rigidità del dispositivo/tessuto 27,28,29,30,31,32,33, ottimizzando la sterilizzazione procedure 34,35, riduzione dello stress/danno ossidativo 28,36,37,38,39,40,41,42, esplorazione di materiali elettrodici alternativi43 e imitazione della nanoarchitettura della matrice extracellulare naturale 44,45,46 . Recente interesse è lo sviluppo di rivestimenti superficiali biomimetici per mitigare la risposta neuroinfiammatoria all’interfaccia tissutale microelettroda direttamente39.
La modifica dell’interfaccia offre il vantaggio unico di colpire direttamente la ferita e il tessuto prossimale necessario per la registrazione del segnale. Un trattamento superficiale che promuove la guarigione senza esacerbare la risposta immunitaria può beneficiare della durata della registrazione di qualità e rimuovere le limitazioni nella realizzazione del potenziale terapeutico e di ricerca dei microelettrodi intracorticali. Il lavoro presentato descrive i metodi per l’applicazione di trattamenti superficiali a array di microelettrodi che richiedono tempi di reazione prolungati pur adattandosi alla fragilità dei dispositivi. La tecnica presentata ha lo scopo di condividere i metodi di modifica della superficie con dispositivi funzionali in cui il dispositivo non può essere maneggiato durante l’applicazione del trattamento. Gli strumenti sono presentati per la gestione di sonde fittizie non funzionali e array di microelettrodi planari in silicio funzionale.
L’approccio presentato per modificare la superficie dell’elettrodo consente la sospensione sicura di sonde fittizie non funzionali o array di elettrodi planari funzionali in silicio per la deposizione e la reazione in fase gassosa con soluzioni acquose. Diversi pezzi stampati in 3D vengono utilizzati per gestire questi dispositivi fragili (Figura 1 e Figura 2). Viene fornito un esempio di una procedura che utilizza fasi di fase gassosa e soluzione per la modifica della superficie con un rivestimento antiossidante che comporta l’immobilizzazione di Mn(III)tetrakis (acido 4-benzoico) porfirina (MnTBAP). MnTBAP è una metalloporfirina sintetica che possiede proprietà antiossidanti con dimostrata mediazione dell’infiammazione47,48. L’esempio fornito sugli array di elettrodi planari funzionali al silicio convalida un aggiornamento di un protocollo precedentemente riportato per dispositivi non funzionali40. L’adattamento di una tecnica di deposizione in fase gassosa di Munief et al. supporta la compatibilità del protocollo con gli elettrodi funzionali49. La deposizione in fase gassosa viene utilizzata per funzionalizzare la superficie in preparazione della reazione acquosa che coinvolge la chimica del reticolante della carbodiimmide per immobilizzare il MnTBAP attivo. La metodologia di manipolazione sviluppata qui è fornita come una piattaforma che può essere modificata per ospitare altri rivestimenti e dispositivi simili.
Il protocollo illustra l’approccio utilizzando sonde fittizie non funzionali che comprendono un gambo di silicio e una linguetta stampata in 3D con dimensioni simili agli array di elettrodi planari funzionali in silicio. L’imballaggio del connettore del dispositivo è considerato analogo alla scheda stampata in 3D della sonda fittizia non funzionale nelle istruzioni fornite.
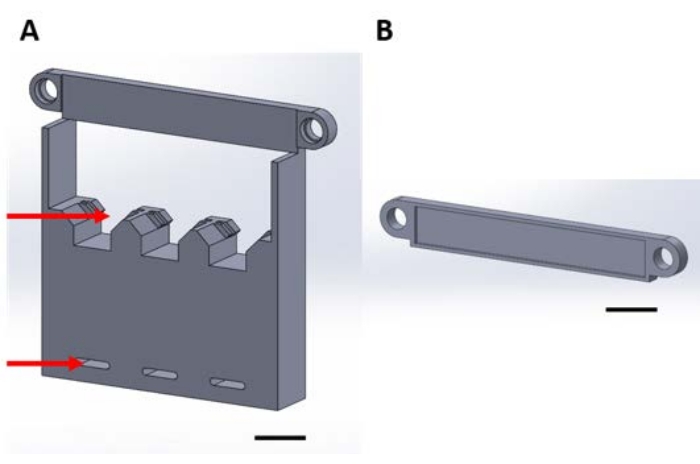
Figura 1: Pezzi stampati in 3D per la gestione di dispositivi funzionali durante la deposizione in fase gassosa in un essiccatore a vuoto. (A) La base della struttura include supporti per quadrati di silicio campione di 1 cm x 1 cm (freccia superiore) e fori per il fissaggio alla piastra dell’essiccatore (freccia inferiore). (B) La piastra è utilizzata per fissare la sospensione dei dispositivi. Da qui in poi, ogni pezzo in questa figura sarà indicato come pezzo 1A o 1B. Barra della scala = 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
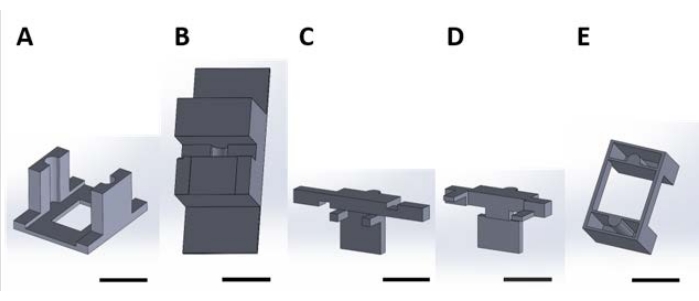
Figura 2: Pezzi stampati in 3D per la manipolazione di dispositivi funzionali per la reazione superficiale che si verifica nella soluzione acquosa. (A) Pezzo guida da incollare al coperchio della piastra di coltura. (B) Pezzi da banco utilizzati per stabilizzare i pezzi (C) e (D) durante l’assemblaggio. (C) e (D) fissano insieme la sospensione dei dispositivi per il posizionamento nella piastra del pozzo e (E) fissano ulteriormente i pezzi (C) e (D) al coperchio della piastra del pozzo. Da qui in poi, i singoli pezzi in ogni pannello di questa figura saranno indicati come numeri di pezzo corrispondenti al numero di pannello di questa figura. Barra della scala = 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo descritto è stato progettato per il trattamento superficiale di array di microelettrodi planari al silicio. Gli strumenti stampati in 3D sono personalizzati per array di microelettrodi in stile Michigan con connettori a basso profilo50. Le sonde non funzionali sono state assemblate aderendo una sonda di silicio a schede stampate in 3D utilizzando un adesivo biocompatibile. Le schede stampate in 3D sono state progettate con dimensioni simili ai connettori incorporati nei dispositivi …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo studio è stato supportato in parte dal Merit Review Award IRX002611 (Capadona) e dal Research Career Scientist Award IK6RX003077 (Capadona) del Dipartimento degli Affari dei Veterani degli Stati Uniti (USA) Rehabilitation Research and Development Service. Inoltre, questo lavoro è stato supportato in parte anche dal National Institute of Health, dal National Institute of Neurological Disorders and Stroke R01NS110823 (Capadona / Pancrazio) e dal National Science Foundation Graduate Research Fellowship Program (Krebs).
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

