Silikon Planar İntrakkortikal Mikroelektrotların Yüzey İşlemi için Araçlar
Summary
Mevcut protokol, gaz biriktirme ve sulu çözelti reaksiyonları yoluyla yüzey modifikasyonu işlemleri sırasında silikon düzlemsel intrakortikal mikroelektrotların işlenmesi için kullanılan araçları açıklamaktadır. Prosedür boyunca cihazları işlemek için kullanılan bileşenlerin montajı ayrıntılı olarak açıklanmaktadır.
Abstract
İntrakortikal mikroelektrotlar büyük terapötik potansiyele sahiptir. Ancak mütevazı implantasyon sürelerinden sonra önemli performans düşüşü ile karşı karşıya kalmaktadırlar. Gözlenen düşüşe önemli bir katkıda bulunan, implantın proksimalindeki nöral dokuya verilen hasar ve ardından nöroinflamatuar yanıttır. Cihazın ömrünü uzatma çabaları, doku tepkisini iyileştirmek için cihaz yüzeyine kimyasal modifikasyonlar veya kaplama uygulamalarını içerir. Bu tür yüzey işlemlerinin geliştirilmesi tipik olarak, amaçlanan uygulama için gerekli olan elektriksel bileşenlerden yoksun fonksiyonel olmayan “kukla” problar kullanılarak tamamlanır. İşlevsel cihazlara çeviri, intrakortikal mikroelektrot dizilerinin kırılganlığı göz önüne alındığında ek dikkat gerektirir. Taşıma aletleri, özellikle uzun prosedürel süreler gerektiren modifikasyonlar için, monte edilmiş cihazlara yüzey işlemlerini büyük ölçüde kolaylaştırır. Burada açıklanan taşıma aletleri, gaz fazı biriktirme ve sulu çözeltiye maruz kalma yoluyla uygulanan yüzey işlemleri için kullanılır. Kaplamanın karakterizasyonu elipsometri ve x-ışını fotoelektron spektroskopisi kullanılarak gerçekleştirilir. İşlevsel cihazlarda kaplama prosedüründen önce ve sonra elektriksel empedans spektroskopisi kayıtlarının karşılaştırılması, modifikasyonu takiben cihaz bütünlüğünü doğruladı. Açıklanan araçlar, kimyasal uyumluluğu koruyan alternatif elektrot cihazları ve arıtma yöntemleri için kolayca uyarlanabilir.
Introduction
Nöroprotez cihazları, omurilik yaralanması, Amyotrofik Lateral Skleroz (ALS), serebral palsi ve amputasyonları olanlar da dahil olmak üzere çok çeşitli hasta popülasyonlarında bozulmuş veya bulunmayan duyusal ve motor yetenekleri geri kazanmayı amaçlamaktadır 1,2,3. İntrakortikal mikroelektrotlar (IME’ler), kortikal nöronlar ile nöroprotezleri kontrol etmek için kullanılan cihazlar arasında bir iletişim yolu oluşturabilir. İntrakortikal mikroelektrotların belirgin bir avantajı, nöral sinyalleri yüksek uzamsal ve zamansal çözünürlükte kaydetme yetenekleridir, bu da sonraki sinyal işleme ve beyin-bilgisayar arayüzlerinin kontrolü için tercih edilir 4,5. Ne yazık ki, intrakortikal mikroelektrotların performansı, implantasyondan sonraki aylar ila bir yıl içinde önemli ölçüde azalır 2,6,7,8. Sinyal kalitesi ve kararlılığının kaybı, teknolojinin uygulanmasını olumsuz yönde etkiler.
Gözlenen performans düşüşüne önemli bir katkıda bulunan, implantasyonla ilişkili doku hasarına ve kronik nöroinflamasyona verilen biyotik yanıttır 9,10,11. IME’lerin implantasyonu beyin dokusuna zarar verir ve reaksiyoner hücresel savunma süreçlerinin kaskadlarını başlatan sinyal moleküllerinin salınmasına neden olur. Kronik arayüz, yabancı cisim tepkisini şiddetlendirir ve cihaza proksimal dokuya zarar veren sürekli nöroinflamasyona yol açar; genellikle nöroinflamasyon, skarlaşma ve lokal nörodejenerasyon semptomları olarak kabul edilir ve sinyal kalitesinin kaydının azalmasına katkıda bulunur12,13,14,15. Sürüklenmiş aktif mikroglia ve makrofajlara sahip yoğun bir astrosit kümelenmesinden oluşan elektrodu kapsülleyen skar, azaltılmış malzeme taşınması ve enflamatuar faktörlerin lokal birikimi ile elverişsiz bir yerel ortam yaratır16,15,16,17,18.
Birçok çalışma, beynin intrakortikal mikroelektrotlara tepkisini veya yanıtı hafifletmek için yaklaşımları tanımlamıştır7. Doku tepkisini iyileştirmeye yönelik araştırma ve geliştirme, genel yapı, yüzey topolojisi, malzemeler ve kaplamalar uygulamasında değişiklikler de dahil olmak üzere bir dizi strateji içermektedir. Bu çabalar, implantasyon olayından kaynaklanan hasarı en aza indirmeyi, cihaz ile proksimal hücreler arasında daha elverişli bir arayüz oluşturmayı veya cihazlar implante edildikten sonra doku gerginliğini azaltmayı amaçlamaktadır7. Özellikle kronik biyolojik yanıtı hedef alan yöntemler, implantasyon bölgesini stabilize etmeyi ve kimyasal olarak hücre sağlığını geliştirmeyi amaçlayan çeşitli biyoaktif kaplamalara yol açmıştır. Örnekler arasında poli (etilen dioksitiyofen) (PEDOT) 19,20, karbon nanotüpler 21, hidrojeller22 gibi iletkenpolimerler ve spesifik hücresel süreçleri hedeflemek için biyoaktif moleküllerin ve ilaçların eklenmesi23,24,25 sayılabilir. Özellikle araştırma grubumuz, implante mikroelektrotlara verilen enflamatuar yanıtın azaltılmasını teşvik etmek için, cihaz implantasyonu 26 ile ilişkili travmayı en aza indirmek, cihaz / doku sertliği uyumsuzluğunu en aza indirmek 27,28,29,30,31,32,33, sterilizasyonu optimize etmek dahil ancak bunlarla sınırlı olmamak üzere birçok mekanizmayı araştırmıştır. prosedürler34,35, oksidatif stresi / hasarı azaltmak 28,36,37,38,39,40,41,42, alternatif elektrot malzemelerini keşfetmek 43 ve doğal hücre dışı matrisin nano-mimarisini taklit etmek 44,45,46 . Son zamanlarda ilgi çekici olan, mikroelektrot doku arayüzündeki nöroinflamatuar yanıtı doğrudan hafifletmek için biyomimetik yüzey kaplamalarının geliştirilmesidir39.
Arayüzün modifikasyonu, sinyal kaydı için gerekli olan yarayı ve proksimal dokuyu doğrudan hedeflemenin benzersiz yararını sunar. İmmün yanıtı şiddetlendirmeden iyileşmeyi destekleyen bir yüzey işlemi, kaliteli kayıt ömrüne fayda sağlayabilir ve intrakortikal mikroelektrotların terapötik ve araştırma potansiyelini gerçekleştirmedeki sınırlamaları ortadan kaldırabilir. Sunulan çalışma, cihazların kırılganlığını barındırırken uzun reaksiyon süreleri gerektiren mikroelektrot dizilerine yüzey işlemleri uygulamak için yöntemleri detaylandırmaktadır. Sunulan teknik, yüzey modifikasyon yöntemlerini, cihazın tedavi uygulaması boyunca kullanılamadığı fonksiyonel cihazlarla paylaşmayı amaçlamaktadır. Araçlar, işlevsel olmayan kukla probları ve fonksiyonel silikon düzlemsel mikroelektrot dizilerini işlemek için sunulmuştur.
Elektrot yüzeyini değiştirmek için sunulan yaklaşım, gaz fazı birikimi ve sulu çözeltilerle reaksiyon için fonksiyonel olmayan kukla probların veya fonksiyonel silikon düzlemsel elektrot dizilerinin güvenli bir şekilde askıya alınmasına izin verir. Bu kırılgan cihazları işlemek için birkaç 3D baskılı parça kullanılır (Şekil 1 ve Şekil 2). Mn (III) tetrakis (4-benzoik asit) porfirinin (MnTBAP) immobilizasyonunu içeren antioksidatif bir kaplama ile yüzey modifikasyonu için hem gaz hem de çözelti fazı adımlarını kullanan bir prosedüre bir örnek verilmiştir. MnTBAP, inflamasyon aracılığı47,48 gösterilmiş antioksidan özelliklere sahip sentetik bir metalloporfirindir. İşlevsel silikon düzlemsel elektrot dizileri hakkında sağlanan örnek, işlevsel olmayan cihazlar40 için daha önce bildirilen bir protokole yapılan bir güncellemeyi doğrulamaktadır. Munief ve ark.’nın bir gaz fazı biriktirme tekniğinin uyarlanması, protokolün fonksiyonel elektrotlarla uyumluluğunu destekler49. Gaz fazı birikimi, aktif MnTBAP’yi hareketsiz hale getirmek için karbodiimid çapraz bağlayıcı kimyasını içeren sulu reaksiyona hazırlık olarak yüzeyi amin işlevselleştirmek için kullanılır. Burada geliştirilen taşıma metodolojisi, diğer kaplamalara ve benzeri cihazlara uyum sağlamak için değiştirilebilen bir platform olarak sağlanmaktadır.
Protokol, fonksiyonel silikon düzlemsel elektrot dizilerine benzer boyutlara sahip bir silikon sap ve 3D baskılı sekmeden oluşan işlevsel olmayan kukla probları kullanarak yaklaşımı göstermektedir. Cihazın konektör ambalajı, verilen talimatta işlevsel olmayan kukla probun 3D baskılı sekmesine benzer olarak kabul edilir.
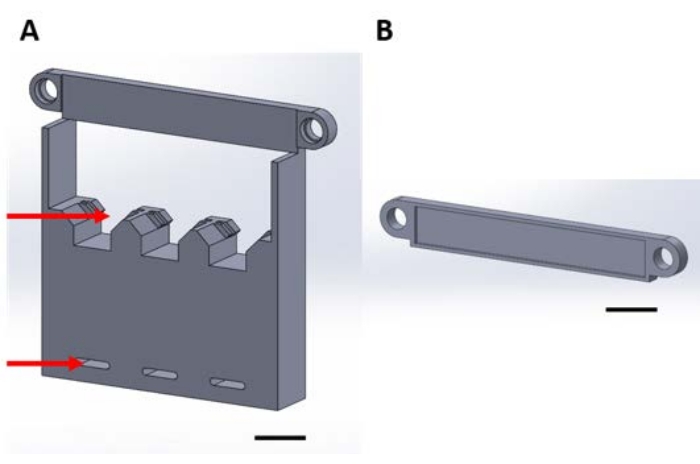
Şekil 1: Bir vakum kurutucusunda gaz fazı biriktirme sırasında fonksiyonel cihazların taşınması için 3D baskılı parçalar. (A) Yapının tabanı, 1 cm x 1 cm numune silikon kareleri (üst ok) için tutucular ve kurutucu plakaya (alt ok) sabitlemek için delikler içerir. (B) Plaka, cihazların süspansiyonunu sabitlemek için kullanılır. Bundan sonra, bu şekildeki her parça parça 1A veya 1B parçası olarak anılacaktır. Ölçek çubuğu = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
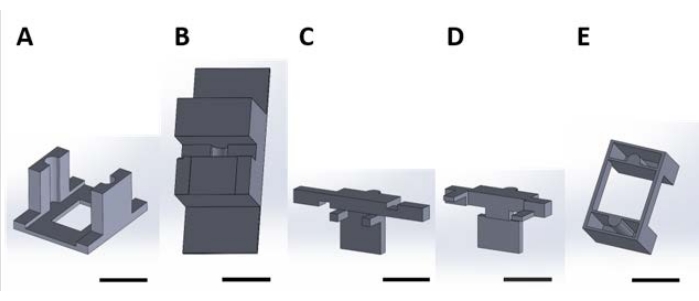
Şekil 2: Sulu çözeltide meydana gelen yüzey reaksiyonu için fonksiyonel cihazların taşınması için 3D baskılı parçalar. (A) Kültür plakasının kapağına yapıştırılacak kılavuz parça. (B) Montaj sırasında (C) ve (D) parçalarını stabilize etmek için kullanılan tezgah üstü parçalar. (C) ve (D) birlikte kuyu plakasına yerleştirilmek üzere cihazların süspansiyonunu sabitler ve (E) ayrıca (C) ve (D) parçalarını kuyu plakası kapağına sabitler. Bundan sonra, bu şeklin her panelindeki ayrı ayrı parçalar, bu şeklin panel numarasına karşılık gelen parça numaraları olarak anılacaktır. Ölçek çubuğu = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Tanımlanan protokol, silikon düzlemsel mikroelektrot dizilerinin yüzey işlemi için tasarlanmıştır. 3D baskılı araçlar, düşük profilli konektörlere sahip Michigan tarzı mikroelektrot dizileri için özelleştirilmiştir50. İşlevsel olmayan problar, biyouyumlu bir yapıştırıcı kullanılarak 3D baskılı tırnaklara bir silikon prob yapıştırılarak monte edildi. 3D baskılı sekmeler, kullanılan ticari olarak temin edilebilen cihazlara dahil edilen konektörlere benzer boyut…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma kısmen Amerika Birleşik Devletleri (ABD) Gazi İşleri Bakanlığı Rehabilitasyon Araştırma ve Geliştirme Servisi’nden Merit Review Award IRX002611 (Capadona) ve Research Career Scientist Award IK6RX003077 (Capadona) tarafından desteklenmiştir. Ek olarak, bu çalışma kısmen Ulusal Sağlık Enstitüsü, Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü R01NS110823 (Capadona / Pancrazio) ve Ulusal Bilim Vakfı Lisansüstü Araştırma Burs Programı (Krebs) tarafından da desteklenmiştir.
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

