Verktøy for overflatebehandling av silisium plane intrakortikale mikroelektroder
Summary
Denne protokollen beskriver verktøy for håndtering av silisiumplante intrakortikale mikroelektroder under behandlinger for overflatemodifisering via gassavsetning og vandige løsningsreaksjoner. Monteringen av komponentene som brukes til å håndtere enhetene gjennom hele prosedyren, forklares i detalj.
Abstract
Intrakortikale mikroelektroder har stort terapeutisk potensial. Men de utfordres med betydelig ytelsesreduksjon etter beskjedne implantasjonsvarigheter. En betydelig bidragsyter til den observerte nedgangen er skaden på nevralvevet proksimalt til implantatet og påfølgende nevroinflammatorisk respons. Innsats for å forbedre enhetens levetid inkluderer kjemiske modifikasjoner eller beleggapplikasjoner på enhetens overflate for å forbedre vevsresponsen. Utvikling av slike overflatebehandlinger utføres vanligvis ved hjelp av ikke-funksjonelle “dummy” -sonder som mangler de elektriske komponentene som kreves for den tiltenkte applikasjonen. Oversettelse til funksjonelle enheter krever ytterligere vurdering gitt skjørheten til intrakortikale mikroelektrodearrayer. Håndteringsverktøy forenkler i stor grad overflatebehandlinger til monterte enheter, spesielt for modifikasjoner som krever lange prosedyretider. Håndteringsverktøyene som er beskrevet her, brukes til overflatebehandlinger som brukes via gassfaseavsetning og eksponering for vandig løsning. Karakterisering av belegget utføres ved hjelp av ellipsometri og røntgenfotoelektronspektroskopi. En sammenligning av elektrisk impedans spektroskopiopptak før og etter beleggingsprosedyren på funksjonelle enheter bekreftet enhetens integritet etter modifisering. De beskrevne verktøyene kan lett tilpasses for alternative elektrodeenheter og behandlingsmetoder som opprettholder kjemisk kompatibilitet.
Introduction
Neuroprostetiske enheter tar sikte på å gjenopprette nedsatte eller fraværende sensoriske og motoriske evner i et bredt spekter av pasientpopulasjoner, inkludert de med ryggmargsskade, amyotrofisk lateral sklerose (ALS), cerebral parese og amputasjoner 1,2,3. Intrakortikale mikroelektroder (IME) kan etablere en kommunikasjonsvei mellom kortikale nevroner og enhetene som brukes til å kontrollere nevroprostetikk. En klar fordel med intrakortikale mikroelektroder er deres evne til å registrere nevrale signaler ved høy romlig og tidsmessig oppløsning, som foretrekkes for etterfølgende signalbehandling og kontroll av hjerne-datamaskingrensesnitt 4,5. Dessverre reduseres ytelsen til intrakortikale mikroelektroder dramatisk i løpet av måneder til et år etter implantasjon 2,6,7,8. Tapet på signalkvalitet og stabilitet påvirker anvendelsen av teknologien negativt.
En betydelig bidragsyter til den observerte ytelsesnedgangen er den biotiske responsen på implantasjonsassosiert vevsskade og kronisk nevroinflammasjon 9,10,11. Implantasjon av IME påfører skade på hjernevev, noe som resulterer i frigjøring av signalmolekyler som initierer kaskader av reaksjonære cellulære forsvarsprosesser. Kronisk grensesnitt forverrer fremmedlegemeresponsen, noe som fører til vedvarende nevroinflammasjon som skader vev proksimalt til enheten; ofte anerkjent som symptomer på nevroinflammasjon, arrdannelse og lokal nevrodegenerasjon som bidrar til nedgangen i opptaket av signalkvaliteten 12,13,14,15. Bestående av et tett konglomerat av astrocytter med innbrente aktivert mikroglia og makrofager, skaper arret som innkapsler elektroden et ugunstig lokalmiljø med redusert materialtransport og lokal akkumulering av inflammatoriske faktorer 16,15,16,17,18.
Mange studier har beskrevet hjernens respons på intrakortikale mikroelektroder eller tilnærminger for å redusere responsen7. Forskning og utvikling for å forbedre vevsresponsen har involvert en rekke strategier, inkludert modifikasjoner av den generelle strukturen, overflatetopologien, materialene og beleggapplikasjonen. Disse anstrengelsene har til hensikt å minimere skade påført fra implantasjonshendelsen, introdusere et gunstigere grensesnitt mellom enheten og proksimale celler, eller redusere vevstammen etter at enheter er implantert7. Metoder spesielt rettet mot kronisk biologisk respons har ført til flere bioaktive belegg som tar sikte på å stabilisere implantasjonsstedet og kjemisk fremme cellehelsen. Eksempler inkluderer ledende polymerer som poly (etylendioksytiofen) (PEDOT) 19,20, karbonnanorør21, hydrogeler22 og tilsetning av bioaktive molekyler og legemidler for å målrette mot spesifikke cellulære prosesser 23,24,25. Vår forskningsgruppe har spesielt utforsket mange mekanismer for å fremme en reduksjon av inflammatorisk respons på implanterte mikroelektroder, inkludert, men ikke begrenset til, minimering av traumer forbundet med enhetsimplantasjon26, minimering av enheten / vevsstivhetsforskjellen 27,28,29,30,31,32,33, optimalisering av sterilisering prosedyrer34,35, redusere oksidativt stress / skade 28,36,37,38,39,40,41,42, utforske alternative elektrodematerialer43, og etterligne nanoarkitekturen til den naturlige ekstracellulære matrisen 44,45,46 . Nylig interesse er utviklingen av biomimetiske overflatebelegg for å redusere nevroinflammatorisk respons ved mikroelektrodevevsgrensesnittet direkte39.
Modifisering av grensesnittet gir den unike fordelen av direkte målretting av såret og det proksimale vevet som er nødvendig for signalopptak. En overflatebehandling som fremmer helbredelse uten å forverre immunresponsen, kan være til nytte for levetiden til kvalitetsregistrering og fjerne begrensninger i å realisere det terapeutiske og forskningspotensialet til intrakortikale mikroelektroder. De presenterte arbeidene beskriver metoder for påføring av overflatebehandlinger på mikroelektrodearrayer som krever utvidede reaksjonstider samtidig som de imøtekommer skjørheten til enhetene. Den presenterte teknikken er ment å dele overflatemodifiseringsmetoder til funksjonelle enheter der enheten ikke kan håndteres gjennom hele behandlingsapplikasjonen. Verktøyene presenteres for håndtering av ikke-funksjonelle dummyprober og funksjonelle silisiumplante mikroelektrodearrayer.
Den presenterte tilnærmingen til å modifisere elektrodeoverflaten muliggjør sikker suspensjon av ikke-funksjonelle dummyprober eller funksjonelle silisiumplanare elektrodearrayer for gassfaseavsetning og reaksjon med vandige løsninger. Flere 3D-printede stykker brukes til å håndtere disse skjøre enhetene (figur 1 og figur 2). Et eksempel er gitt av en prosedyre som benytter både gass- og løsningsfasetrinn for overflatemodifisering med et antioksidativt belegg som involverer immobilisering av Mn (III) tetrakis (4-benzosyre) porfyrin (MnTBAP). MnTBAP er et syntetisk metalloporfyrin som har antioksidantegenskaper med påvist mekling av betennelse47,48. Det angitte eksemplet på funksjonelle silisiumplanre elektrodearrayer validerer en oppdatering av en tidligere rapportert protokoll for ikke-funksjonelle enheter40. Tilpasningen av en gassfaseavsetningsteknikk fra Munief og medarbeidere støtter protokollens kompatibilitet med funksjonelle elektroder49. Gassfaseavsetningen benyttes til å aminfunksjonalisere overflaten som forberedelse til den vandige reaksjonen som involverer karbodimid-tverrbindingskjemi for å immobilisere den aktive MnTBAP. Håndteringsmetoden utviklet her er gitt som en plattform som kan modifiseres for å imøtekomme andre belegg og lignende enheter.
Protokollen illustrerer tilnærmingen ved hjelp av ikke-funksjonelle dummyprober som består av et silisiumskaft og en 3D-trykt fane med lignende dimensjoner som de funksjonelle silisiumplanar elektrodear arrays. Kontaktemballasjen til enheten anses å være analog med den 3D-printede fanen til den ikke-funksjonelle dummy-sonden i den medfølgende instruksjonen.
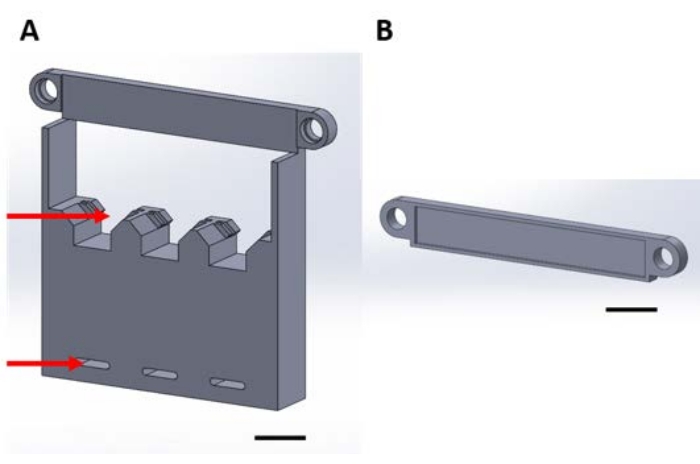
Figur 1: 3D-printede stykker for håndtering av funksjonelle enheter under gassfaseavsetningen i en vakuumtørker. (A) Strukturens base inkluderer holdere for 1 cm x 1 cm prøve silisiumfirkanter (øverste pil) og hull for sikring til tørkeplate (nederst pil). (B) Platen brukes til å sikre suspensjonen av enheter. Herfra og fremover vil hvert stykke i denne figuren bli referert til som enten stykke 1A eller 1B. Skalalinje = 1 cm. Klikk her for å se en større versjon av denne figuren.
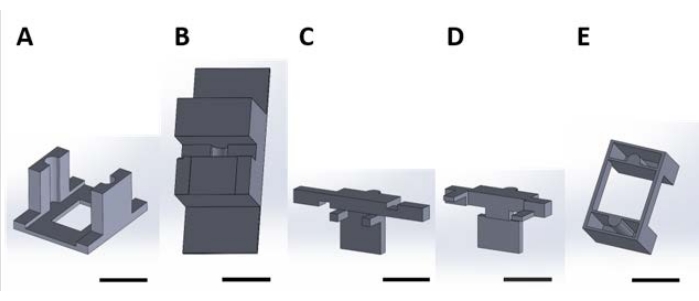
Figur 2: 3D-printede stykker for håndtering av funksjonelle enheter for overflatereaksjonen som forekommer i den vandige løsningen. (B) Stasjonære deler som brukes til å stabilisere deler (C) og (D) under montering. (C) og (D) sikrer sammen opphenget av innretninger for plassering i brønnplaten, og (E) fester delene (C) og (D) ytterligere til brønnplatelokket. Herfra og fremover vil individuelle brikker i hvert panel av denne figuren bli referert til som stykkenumre som tilsvarer panelnummeret til denne figuren. Skalalinje = 1 cm. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Den beskrevne protokollen ble designet for overflatebehandling av silisium plane mikroelektrodearrayer. De 3D-printede verktøyene er tilpasset mikroelektrodearrayer i Michigan-stil med lavprofilkontakter50. Ikke-funksjonelle sonder ble satt sammen ved å feste en silisiumsonde til 3D-printede faner ved hjelp av et biokompatibelt lim. De 3D-printede fanene ble designet med lignende dimensjoner som kontaktene som er integrert på de kommersielt tilgjengelige enhetene som brukes. Filer for de 3D-pri…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne studien ble støttet delvis av Merit Review Award IRX002611 (Capadona) og Research Career Scientist Award IK6RX003077 (Capadona) fra UNITED STATES (US) Department of Veterans Affairs Rehabilitation Research and Development Service. I tillegg ble dette arbeidet også støttet delvis av National Institute of Health, National Institute of Neurological Disorders and Stroke R01NS110823 (Capadona / Pancrazio) og National Science Foundation Graduate Research Fellowship Program (Krebs).
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

