ביובנק לרפואה תרגומית: נהלי הפעלה סטנדרטיים לניהול דגימות אופטימלי
Summary
ביובנקים הם משאבים חיוניים למחקר ביו-רפואי והיחידה לרפואה תרגומית ודיגיטלית במכון האירופי לאונקולוגיה היא מודל בתחום זה. כאן אנו מספקים תיאור מפורט של נהלי ההפעלה הסטנדרטיים של ביו-בנקים לניהול סוגים שונים של דגימות ביולוגיות אנושיות.
Abstract
ביובנקים הם תשתיות מחקר מרכזיות שמטרתן איסוף, אחסון, עיבוד ושיתוף של דגימות ביולוגיות אנושיות באיכות גבוהה ונתונים נלווים למחקר, אבחון ורפואה מותאמת אישית. היחידה לרפואה תרגומית ודיגיטלית במכון האירופי לאונקולוגיה (IEO) היא נקודת ציון בתחום זה. ביובנקים משתפים פעולה עם חטיבות קליניות, קבוצות מחקר פנימיות וחיצוניות ותעשייה, ותומכים בטיפול בחולים ובהתקדמות המדעית, כולל אבחון חדשני, גילוי סמנים ביולוגיים ותכנון ניסויים קליניים. בהתחשב בתפקיד המרכזי של ביו-בנקים במחקר המודרני, נהלי הפעלה סטנדרטיים של ביו-בנקאות (SOPs) צריכים להיות מדויקים ביותר. SOPs ובקרות על ידי מומחים מוסמכים מבטיחים את האיכות הגבוהה ביותר של דגימות ליישום אסטרטגיות מותאמות אישית מבוססות מדע, אבחון, פרוגנוסטיות וטיפוליות. עם זאת, למרות מאמצים רבים ליצור סטנדרטיזציה והרמוניה של ביו-בנקים, פרוטוקולים אלה, הפועלים על פי מערכת קפדנית של כללים, בקרות איכות והנחיות המבוססות על עקרונות אתיים ומשפטיים, אינם נגישים בקלות. מאמר זה מציג את נהלי ההפעלה הסטנדרטיים של ביובנק של מרכז סרטן גדול.
Introduction
ביו-בנקים הם ביו-רפוזיטורים שמטרתם איסוף, אחסון, עיבוד ושיתוף של דגימות ביולוגיות אנושיות ונתונים נלווים למחקר ואבחון. תפקידם חיוני לא רק לגילוי ואימות סמנים ביולוגיים אלא גם לפיתוח תרופות חדשות1. לפיכך, הרוב המכריע של תוכניות המחקר התרגומי והקליני מסתמכות על גישה לביו-פסימנים באיכות גבוהה. מבחינה זו, ביובנקים נחשבים לגשר בין המחקר האקדמי לבין תעשיית התרופות/ביוטכנולוגיה 2,3,4,5. בשל ההזדמנויות חסרות התקדים שמספקים איסוף ביג דאטה ובינה מלאכותית, תפקידם של הביו-בנקים בחקר הסרטן מתפתח ללא הרף6.
הספקטרום הרחב של ביו-חומרים המטופלים על ידי ביו-בנקים משולב עם מידע קליניקופתולוגי, כולל נתונים דמוגרפיים וסביבתיים, סוג הגידול, דרגה היסטולוגית, שלב, נוכחות של פלישה לימפווסקולרית וסטטוס סמנים ביולוגיים 7,8. ככל שיהיו יותר דגימות ונתונים באיכות גבוהה יותר, כך המחקר יקדם וישפיע על אספקת שירותי בריאות9 מהר יותר. קיימת מסגרת רגולטורית קפדנית המבוססת על עקרונות אתיים ומשפטיים שצריכים לעקוב אחר SOPs, בקרות איכות והנחיות שאומצו באופן נרחב (למשל, המכון הלאומי לסרטן של ארה”ב, הקונפדרציה הבריטית של ביו-בנקים לסרטן, והאגודה הבינלאומית של האיחוד האירופי למאגרים ביולוגיים וסביבתיים)10,11.
הפיתוח של SOPs עבור כל ההיבטים העיקריים של ביובנקים מביא מספר יתרונות במונחים של איכות, עקיבות, עקביות, יכולת שכפול, וזמני תפנית12,13. היבט חשוב נוסף של יישום SOP מיוצג על ידי אופטימיזציה של ניהול ביובנק, המאפשר פתרון בעיות טוב יותר נהלים חלופיים עבור עובדי ביובנקוחוקרים 14. כל ההיבטים האלה הם חלק מזרימת העבודה של ביו-בנק (איור 1).
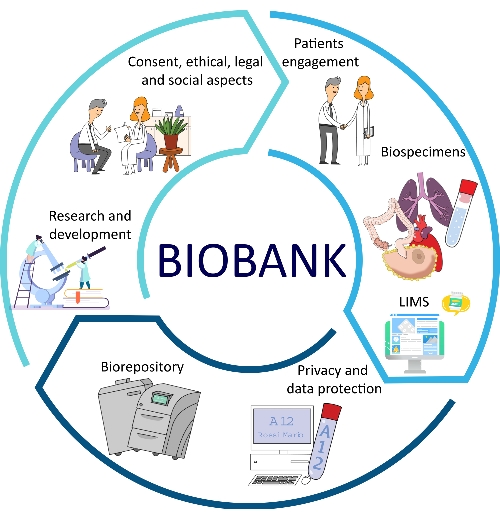
איור 1: גורמים שונים התורמים לאופטימיזציה של ביו-בנקאות. קיצור: LIMS = מערכת ניהול מידע מעבדתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
נתונים ספציפיים ורגישים אלה דורשים נהלים סטנדרטיים ניהוליים מחמירים בביו-בנקאות. טופס פרויקט מפורט ומאומת צריך להיות זמין לכל החוקרים שצריכים לקבל גישה לדגימות ולנתונים של ביובנק. המידע המובא בבקשה צריך לכלול את מתודולוגיית המחקר ועיצובו, מטרותיו, יעדיו ותקציבו. יש להקים ועדה מדעית טכנית של ביובנק עם תפקיד ההון של הערכת יישומים לפרויקטים מחקריים. גוף זה צריך לכלול חברים מהיחידה הביו-בנקאית, חטיבות קליניות, קבוצות מחקר, הגנה על נתונים, לשכה משפטית ומשרד העברת טכנולוגיה.
יחידת ביובנק לרפואה תרגומית ודיגיטלית של המכון האירופי לאונקולוגיה (IEO) היא התייחסות עולמית לביובנקים מבחינת איכות וכמות השירותים הניתנים, כמו גם חדשנות. מתקן מוסמך מלא זה (UNI EN ISO 9001:2015-Certiquality) הוא חלק בלתי נפרד מהצומת האיטלקי BBMRI-ERIC (כלומר, תשתית מחקר ביו-בנקאית ומשאבים ביומולקולריים) ומקיים אינטראקציה הן עם יחידות קליניות והן עם תשתית מחקר.
יש הטרוגניות רבה בסוגי הביו-פסימנים המאוחסנים על ידי ביו-בנקים. אלה כוללים דגימות רקמה – טריות-קפואות או משומרות פרפין – ביופלואידים (למשל, פלזמה, סרום, דם, שתן, צואה), תרביות תאים ותאי דם חד-גרעיניים היקפיים (PBMCs). הביובנק שלנו פועל בסינרגיה עם תשתית המחקר האירופית לביו-בנקאות (BBMRI-ERIC), שהיא אחת מרשתות הביו-בנקים הגדולות באירופה ומספקת פורטל לגישה לביו-בנקים ולמשאבים ביומולקולריים המתואמים על ידי צמתים לאומיים15. בנוסף ל- BBMRI-ERIC, האגודה הבינלאומית למאגרים ביולוגיים וסביבתיים (ISBER) מילאה גם תפקיד חשוב בסטנדרטיזציה של נהלי הפעלה עבור ביו-בנקאות16.
יחידת ביובנק, המהווה חלק מהאגף לפתולוגיה, מחויבת למרכזיותו של המטופל, תמיכה בפיתוח מחקר קליני, שיפור מתמיד, שיפור המשאב האנושי, שיתוף פעולה בינלאומי, תמיכה באירועי הדרכה, בטיחות במקום העבודה וצמיחה מדעית וטכנולוגית. החזון המשותף הוא להקים את ציוני הדרך הלאומיים והאירופיים עבור ביובנקים במונחים של איכות וכמות השירותים והחדשנות. הדגימות הביולוגיות שנאספו משמשות לזיהוי סמנים ביולוגיים חדשים ותרופות חדשות (למשל, לפיתוח טיפולים מותאמים אישית יותר ויותר) ולהבטחת הטיפול הזמין הטוב ביותר לחולים באמצעות מצוינות במחקר.
כל דגימה ביולוגית נאספת ומטופלת לאחר אימות מוקדם לקיומו של הסכם ההשתתפות במחקר המדעי שהביע המטופל15. דגימות ביולוגיות שנאספו משמשות לביצוע פרויקטים מחקריים או ניסויים קליניים וכוללות עודף (כלומר, לא נחוץ למטרות אבחון) דגימות כירורגיות פתולוגיות ולא פתולוגיות, ביופסיות נוזליות (למשל, דם, סרום, פלזמה ושתן) ודגימות ביולוגיות אחרות. ביו-חומרים אלה מאוחסנים על פי פרוטוקולים ייעודיים לשימור בהקפאה. מאמר זה מספק את הפרוטוקולים הביו-בנקאיים של מרכז סרטן גדול.
Protocol
Representative Results
Discussion
למרות שהאונקולוגיה התקדמה מאוד, סרטן נותר גורם מוביל לתחלואה ותמותה ברחבי העולם20. הבנת ההטרוגניות של הגידול, התפתחותו הזמנית לאורך זמן ותוצאות הטיפול הממוקד תלויות אך ורק באיסוף נתונים מדויק בהקשר של טיפול קליני שגרתי21. מבחינה זו, גישת “הרב-אומיקה” צוברת תאוצה בפתולוגיה אונקולוגית מנבאת22. הערכת הסמנים הביולוגיים המסורתית מבוססת הרקמות משולבת באמצעות מספר ביואנליטים חדשים, כגון דם, פלזמה, שתן, רוק וצואה23,24,25,26. לכן, ביובנקים מוכרים כיום כתשתיות מרכזיות לשיפור הפרקטיקה הקלינית. במבט לאחור על ההיסטוריה של חקר הסרטן, אנו מבינים שהתגליות המרשימות ופורצות הדרך ביותר לעולם לא היו מתאפשרות ללא בדיקה ישירה של רקמת סרטן או ביופסיות נוזליות. עם הזמן, מקור רקמת הסרטן וסוג הביופסיה הנוזלית שיש לבחון התפתחו מניתוחים גסים, “מפגשים מקריים” אקראיים, ובמקרים מסוימים, סחר לא חוקי לאוספי סרטן מאורגנים ולבנקים אונקולוגיים מודרניים אסטרטגיים. ההתייחסות לסוגיות אתיות רבות השתנתה במידה ניכרת הן בפועל והן בגורמים העיקריים המבדילים בין בנקים אונקולוגיים מודרניים לבין אוספי האונקולוגיה של העבר.
בשל ההתקדמות בחקר הסרטן והכמות העצומה של מידע מולקולרי המסופק כיום על ידי טכנולוגיות מודרניות, זה הופך להיות ברור יותר ויותר כי ביובנקים, במיוחד אלה במרכזי סרטן, עשויים להתמודד עם כמה סוגים של בעיות מתודולוגיות. בין אלה, הטכנולוגיה הפכה לאתגר אוניברסלי שעדיין מונע סטנדרטיזציה והרמוניזציה של SOP. היבט קריטי נוסף לשמירה על פעילות הליבה הביו-בנקאית הוא להחזיק בתוכנת LIMS משולבת המסוגלת לקבל ולתחזק באופן אוטומטי את כל מזהי בית החולים ואת כל הנתונים הקליניים הקודיפיקטיביים המגיעים מתוכנת בית החולים. ראוי לציין כי תוכנות יקרות ערך אחרות המשמשות לניהול ביובנקים וכמה תוכנות חופשיות ניתן להשיג עבור biobank ניהול 27,28,29,30,31. צעד קריטי נוסף בביו-בנקים הוא יישום הסכם ההשתתפות לכל המטופלים וההסכמה המשפטית והאתית הדרושה לאחסון נתונים קליניים וביו-פסימנים10,32.
בהקשר זה, לפרוטוקול זה יש הנחיות מוגדרות היטב שאינן מתירות איסוף ואחסון של biospecimens בהעדר הסכמה. זהו גם נושא קריטי שכן מטופלים יכולים לבטל את השתתפותם גם לאחר שהדגימות שלהם אוחסנו; לפיכך, שיטות לקחת במהירות דגימות כאלה מתוך מערכת biobanking יושמו. ביופסימנים המגיעים מחולים שגויסו על ידי הביובנק שלנו פועלים לפי פרוטוקולים קפדניים לאיסוף ואחסון. בהקשר זה, כמה היבטים חשובים הוערכו כדי לפקח על תהליך זה והם משתפרים ללא הרף. בפרט, הסמכת ISO9001 דורשת מספר אינדיקטורים לביצועים, כגון זמן איסכמי חם, אשר צריך להישמר במשך פחות מ -30 דקות או 60 דקות בהתאם למקור הרקמה. בנוסף, ביופסיות נוזליות ונוזלים ביולוגיים נאספים באמצעות פרוטוקולים סטנדרטיים לאחר נהלי זמן קפדניים 15,33,34,35,36.
תכונות ספציפיות הן בעלות חשיבות רבה בתהליכי העבודה של ביו-בנקים. אלה כוללים נוכחות של פתולוג מוסמך, אשר מבטיח את הדגימה של הרקמה מסיבות אבחון, ואת איסוף של רקמות עבור biobanking במסגרת זמן תואם איכות גבוהה של דגימות (זמן איסכמי הוא אינדיקציה חשובה עבור סוגים מסוימים של מחקר, כגון בדיקות תלויות RNA, אשר דורשים פחות זמן איסכמי חם). יתר על כן, ניהול השטח הנדרש לאחסון דגימות הוא בעל חשיבות רבה בביו-בנקים. מספר הביופסיות הנוזליות שנאספו יכול להיות מונע על ידי תכנון המחקר. לעתים קרובות ניתן לאסוף ביופסיות נוזליות הן במהלך התקופה שלפני הניתוח והן בתקופת המעקב, כפי שהוגדרו על ידי כל תכנון מחקר.
הודות לקמפיינים של בדיקות סקר למניעת סרטן ואבחון מוקדם של גידולים, כלומר גידולי שד קטנים בשלבים מוקדמים של התפתחות, כמו גם הזמינות של טכניקות כירורגיות זעיר פולשניות, הפחיתו את מספר דגימות הרקמות הזמינות למחקר (מכיוון שרוב דגימות הרקמות משמשות תמיד למטרות אבחון). היכולת לאסוף ולאחסן דגימות ביולוגיות השתפרה משמעותית בשנים האחרונות. ניתן לראות זאת עבור נוזלים ביולוגיים, המשקפים את היכולת המוגברת של ביובנק זה לתמוך בקבוצות המחקר של מכון זה בביקוש הגובר לחומר מבואר שמקורו בחולה. למרות שיפורים אלה, חווינו כמה מגבלות למחקרים רב-מרכזיים הדורשים תיאום בין ביו-בנקים ממקומות שונים בעולם, שניתן לשלב רק על ידי יישום נהלים דומים.
לאחר ששללה את רוב הסוגיות האתיות והטכניות הנוגעות לביובנקאות, כולל איסוף כל המידע הקליני והדמוגרפי, המטרה הבאה היא ליישם את הדיגיטליזציה של כל התכשירים והכתמים ההיסטולוגיים המשמשים למטרות אבחון ומחקר. יש לכך חשיבות בסיסית לדור הבא של מחקרים שייהנו מאוד מהפתולוגיה הדיגיטלית והביו-בנק המשולבים במלואם, שהולכים להפוך לסטנדרט לעתיד. רק סדרה גדולה של חולים עם נתונים משולבים ותמונות דיגיטליות עשויה לתדלק מחקרי בינה מלאכותית (AI) רב-מרכזיים וגדולים לשיפור הטיפול בחולי סרטן. לסיכום, אנו מאמינים כי בריאות טובה אינה מסתיימת באבחון וטיפול. שיטות עבודה מומלצות כוללות מציאת דרכים לאבחון מתמיד ולשיפור הטיפול בכל מחלה, בפרט אלה המשפיעות קשות על תוחלת החיים או על איכותה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להודות לכל החולים שהשתתפו באופן פעיל במהלך העשור האחרון בתוכניות המחקר שלנו באמצעות תרומה של biospecimens שלהם. בלעדיהם, מחקר זה לא היה אפשרי. אנו מודים גם לכל אנשי הצוות העובדים ב- IEO, לאחיות, לטכנאים, לביולוגים, לרופאים ולמנהלי כל היחידות הקליניות והמחקריות. המחברים מודים לפרופ’ פייר פאולו די פיורה ולפרופ’ ג’יאנקרלו פרונרי על ההנחייתם. לבסוף, אנו מקדישים עבודה זו לפרופ’ אומברטו ורונסי, מייסד IEO, וגישתו החלוצית לשילוב חקר הסרטן והטיפול בחולים.
Materials
| Blue Max Con Tubes 15 mL | Falcon B.D | 352096 | |
| Blue Max Con Tubes 50 mL | Euroclone Spa | FLC352070 | |
| Box with 81 position for tissue storage | Ettore Pasquali Srl. | 06.0945.00 | |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek | 63950 | Preservation and isolation of both cf-DNA and cf-RNA from a single tube and in particular preserve cf-DNA/ct-DNA for 30 days at ambient temperature and for up to 8 days at 37 °C |
| Cryomold Standard (25 X 20 X 5 mm) | Olympus Italia S.r.l. | 4557 | Disposable plastic Cryomold molds create a uniformly shaped, flat-surface specimen block when used with O.C.T |
| Dimethyl Sulfoxide Plastic Bottle – 1 L | Vwr International S.R.L. | MFCD00002089 | It acts to preserve the reconstitution of the medium for the storage of frozen cells |
| Dpbs 1x W/o Ca And Mg – 500 mL | Microtech Srl | TL1006-500ML | Washing Buffer cell |
| Dualfilter T.I.P.S 1,000 µL | Euroclone Spa | 4809 | |
| Dualfilter T.I.P.S 200 µL | Euroclone Spa | 4823 | |
| Easytrack Barcode Reader for single tube datamatrix | Twin Helix Srl | TH-ETR4400 | 2D barcode tubes reader with USB connection |
| Fetal Bovine Serum Origin Brazileu S/fil | Microtech S.R.L | RM10532-500ML | Defrost at +4 °C, usually for two days, and once melted, start decomplementation at 56 °C for 45 min Let it cool down to room temperature, and aliquot it. Refroze them to -20 °C, and remember to defrost them every time the aliquots are needed |
| Ficoll Paque Plus (ge) 6 x 500 mL | Euroclone Spa | GEH17144003 | Ficoll is a medium for density gradient, It is sterile and ready for use. It alloes to get peripheral blood mononuclear cells, bone marrow and umbilical cord blood |
| Fixing solution Killik of 100 mL (OCT) | Bio-optica Milano S.p.a. | 05-9801 | Gel inclusion medium that solidifies at cold the water-soluble tissue (e.g., biopsies, frustules) |
| FLASH-FREEZE | Milestone | n.a. | Freezing appliance |
| Forma 8600 Series Chest Freezers (Temperature Range: -50 °C to -86 °C) 85 liters | Thermo Fisher Scientific Srl | 803CV | Orizzontal freezer |
| Isopentane 500 mL | Vwr International S.R.L. | 24872260 | Liquid included in theFLASH-FREEZE camera for freezing |
| Nautilus Lims Software | Thermo Scientific™ | n.a. | The software implementation is able to track all patients’ biological samples. Receives Personal and Clinical information automatically during registration due to the integration with IEO operating systems. Nautilus is integrated with the web service through three IEO operative systems: BAC – IEO central registry with personal information, wHospital – medical record |
| Pasteur pipette 10 mL | Euroclone Spa | CC4488 | |
| Pasteur pipette 3 mL | Euroclone Spa | APT1502 | |
| PATHOX | Dedalus ItaliTesi Elettronica e Sistemi Informativi S.p.A.a S.p.A. | n.a. | PATHOX – management system for the Pathology unit where several factors are registered for the Biobank, such as the histological samples, the related diagnoses, and biomarkers |
| Petri dishes, polystyrene – size 100 mm x 20 mm, slippable | Euroclone Spa | FLC353003 | |
| Set of 4 adapters 19 x 5/7 mL vac | Thermo Fisher Scientific Srl | 75003680 | |
| Set of 4 adapters 4 x 50 conical | Thermo Fisher Scientific Srl | 75003683 | |
| Set of 4 adapters 9 x 15 mL conical | Thermo Fisher Scientific Srl | 75003682 | |
| Single-use slide for counting cell | Biosigma S.P.A. | 347143/001 | Specifically used for individual cell count |
| Stamps Freezerbondz for tissue boxes, nitrogen-liquid proof , H 9,53 mm x L 25,40 mm | Twin Helix Srl | THT-152-492-3 | |
| Thermo Scientific TSX Series Ultra-Low Freezers (-50 °C to -86 °C) 949 liters | Thermo Fisher Scientific Srl | TSX70086V | Vertical freezer |
| Thermo Scientific Refrigerated Centrifuge SL16R | Thermo Fisher Scientific Srl | 75004030 | |
| Tissue box labels in Permanent | Twin Helix Srl | THT-199-482-3 | |
| Tuerks Solution | Merck Life Science S.R.L. | 1092770100 | In light microscopy, it is specifically used as stain for leukocyte |
| TX-400 Rotor TX-400 swinging bucket hol | Thermo Fisher Scientific Srl | 75003181 | |
| White box for storage | Bio Optica | 07-7300 | |
| wHospital Software | wHealth Lutech Group | n.a. | wHospital – medical record management system with personal information, administrative cases, and the informed consent of the patients |
References
- Pagni, F., et al. Targeting immune-related biological processes in solid tumors: We do need biomarkers. International Journal of Molecular Sciences. 20 (21), 5452 (2019).
- Braun, K. L., et al. Cancer patient perceptions about biobanking and preferred timing of consent. Biopreservation and Biobanking. 12 (2), 106-112 (2014).
- Bycroft, C., et al. The UK Biobank resource with deep phenotyping and genomic data. Nature. 562 (7726), 203-209 (2018).
- Saifuddin, S. R., et al. King’s Health Partners’ Prostate Cancer Biobank (KHP PCaBB). BMC Cancer. 17 (1), 784 (2017).
- Lopez, G., et al. Molecular insights into the classification of luminal breast cancers: The genomic heterogeneity of progesterone-negative tumors. International Journal of Molecular Sciences. 20 (3), 510 (2019).
- Kinkorová, J. Biobanks in the era of personalized medicine: Objectives, challenges, and innovation: Overview. The EPMA Journal. 7 (1), 4 (2015).
- Luo, J., et al. Intravital biobank and personalized cancer therapy: The correlation with omics. International Journal of Cancer. 135 (7), 1511-1516 (2014).
- Invernizzi, M., et al. Quality of life interventions in breast cancer survivors: State of the art in targeted rehabilitation strategies. Anticancer Agents in Medicinal Chemistry. 22 (4), 801-810 (2021).
- Roux, J., Zeghidi, M., Villar, S., Kozlakidis, Z. Biosafety and biobanking: Current understanding and knowledge gaps. Biosafety and Health. 3 (5), 244-248 (2021).
- Sanchini, V., et al. A trust-based pact in research biobanks. From theory to practice. Bioethics. 30 (4), 260-271 (2016).
- Vaught, J., Kelly, A., Hewitt, R. A review of international biobanks and networks: Success factors and key benchmarks. Biopreservation and Biobanking. 7 (3), 143-150 (2009).
- Ferrin, I., et al. Isolation, culture, and expansion of mesenchymal stem cells. Methods in Molecular Biology. 1590, 177-190 (2017).
- Hermansen, J. U., et al. The Norwegian childhood cancer biobank. Cancer Reports. , 1555 (2021).
- Schmelz, M., et al. A plan for emergency shutdown and reopening for a consortium of biobanks. Biopreservation and Biobanking. 19 (5), 394-398 (2021).
- Salvaterra, E., Corfield, J. . Advances in Biobanking Practice Through Public and Private Collaborations. , (2017).
- Snapes, E., Simeon-Dubach, D. ISBER best practices for repositories, moving toward the fifth edition. Biopreservation and Biobanking. 20 (1), 107-108 (2022).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harbour Protocols. (8), 4991 (2008).
- Staining methods in frozen section: Best lab practices. Laboratory Best Practice Blog. UC Davis Health Available from: https://health.ucdavis.edu/blog/lab-best-practice/staining-methods-in-frozen-section-best-lab-practices/2020/03 (2020)
- Craciun, L., et al. Tumor banks: A quality control scheme proposal. Frontiers in Medicine. 6, 225 (2019).
- Ma, X., Yu, H. Global burden of cancer. The Yale Journal of Biology and Medicine. 79 (3-4), 85-94 (2006).
- Angerilli, V., et al. The role of the pathologist in the next-generation era of tumor molecular characterization. Diagnostics. 11 (2), 339 (2021).
- Correa-Aguila, R., Alonso-Pupo, N., Hernández-Rodríguez, E. W. Multi-omics data integration approaches for precision oncology. Molecular Omics. , (2022).
- Salati, M., et al. ctDNA analysis in the personalized clinical management of gastroesophageal adenocarcinoma: Turning hope into reality. Future Oncology. 17 (33), 4607-4618 (2021).
- Mirzayi, C., et al. Reporting guidelines for human microbiome research: The STORMS checklist. Nature Medicine. 27 (11), 1885-1892 (2021).
- Cortvrindt, C., Speeckaert, R., Delanghe, J. R., Speeckaert, M. M. Urinary epidermal growth factor: A promising "next generation" biomarker in kidney disease. American Journal of Nephrology. , (2022).
- Fusco, N., Fumagalli, C., Guerini-Rocco, E. Looking for sputum biomarkers in lung cancer secondary prevention: Where are we now. Journal of Thoracic Disease. 9 (11), 4277-4279 (2017).
- Im, K., Gui, D., Yong, W. H. An introduction to hardware, software, and other information technology needs of biomedical biobanks. Methods in Molecular Biology. 1897, 17-29 (2019).
- Paul, S., Gade, A., Mallipeddi, S. The state of cloud-based biospecimen and biobank data management tools. Biopreservation and Biobanking. 15 (2), 169-172 (2017).
- Fthenou, E., et al. implementation, and integration of heterogenous information technology infrastructures in the Qatar biobank. Biopreservation and Biobanking. 17 (6), 494-505 (2019).
- Tukacs, E., et al. Model requirements for Biobank Software Systems. Bioinformation. 8 (6), 290-292 (2012).
- Willers, C., et al. A versatile, secure, and sustainable all-in-one biobank-registry data solution: The A3BC REDCap model. Biopreservation and Biobanking. , (2021).
- D’Abramo, F., Schildmann, J., Vollmann, J. Research participants’ perceptions and views on consent for biobank research: A review of empirical data and ethical analysis. BMC Medical Ethics. 16, 60 (2015).
- Policiuc, L., et al. The foundation of personalized medicine is the establishment of biobanks and their standardization. Journal of BUON. 23 (3), 550-560 (2018).
- Lygirou, V., Makridakis, M., Vlahou, A. Biological sample collection for clinical proteomics: Existing SOPs. Methods in Molecular Biology. 1243, 3-27 (2015).
- Pisapia, P., Malapelle, U., Troncone, G. Liquid biopsy and lung cancer. Acta Cytologica. 63 (6), 489-496 (2019).
- Spruessel, A., et al. Tissue ischemia time affects gene and protein expression patterns within minutes following surgical tumor excision. Biotechniques. 36 (6), 1030-1037 (2004).

