Translasyonel Tıp için Biyobanka: Optimal Numune Yönetimi için Standart Çalışma Prosedürleri
Summary
Biyobankalar biyomedikal araştırmalar için çok önemli kaynaklardır ve Avrupa Onkoloji Enstitüsü’ndeki Translasyonel ve Dijital Tıp Birimi için Biyobanka bu alanda bir modeldir. Burada, biyobankaların farklı insan biyolojik numunelerinin yönetimi için standart çalışma prosedürlerinin ayrıntılı bir açıklamasını sunuyoruz.
Abstract
Biyobankalar, yüksek kaliteli insan biyolojik örneklerinin ve araştırma, teşhis ve kişiselleştirilmiş tıp için ilişkili verilerin toplanmasını, depolanmasını, işlenmesini ve paylaşılmasını amaçlayan kilit araştırma altyapılarıdır. Avrupa Onkoloji Enstitüsü’ndeki (IEO) Translasyonel ve Dijital Tıp Birimi için Biyobanka, bu alanda bir dönüm noktasıdır. Biyobankalar, yenilikçi teşhis, biyobelirteç keşfi ve klinik araştırma tasarımı dahil olmak üzere hastaların tedavisini ve bilimsel ilerlemesini destekleyen klinik bölümler, iç ve dış araştırma grupları ve endüstri ile işbirliği yapmaktadır. Biyobankaların modern araştırmalardaki merkezi rolü göz önüne alındığında, biyobankacılık standart çalışma prosedürleri (SÇP’ler) son derece hassas olmalıdır. Sertifikalı uzmanlar tarafından yapılan SÇP’ler ve kontroller, bilime dayalı, tanısal, prognostik ve terapötik kişiselleştirilmiş stratejilerin uygulanması için en yüksek kalitede numuneler alınmasını sağlar. Bununla birlikte, biyobankaları standartlaştırmak ve uyumlu hale getirmek için sayısız çabaya rağmen, etik ve yasal ilkelere dayanan katı kurallar, kalite kontrolleri ve kılavuzlar izleyen bu protokollere kolayca erişilememektedir. Bu yazıda büyük bir kanser merkezinin biyobanka standart çalışma prosedürleri sunulmaktadır.
Introduction
Biyobankalar, insan biyolojik örneklerinin ve araştırma ve teşhis için ilişkili verilerin toplanmasını, depolanmasını, işlenmesini ve paylaşılmasını amaçlayan biyodepolardır. Rolleri sadece biyobelirteçlerin keşfi ve doğrulanması için değil, aynı zamanda yeni ilaçların geliştirilmesi için de çok önemlidir1. Bu nedenle, translasyonel ve klinik araştırma programlarının büyük çoğunluğu yüksek kaliteli biyoörneklere erişime dayanmaktadır. Bu bakımdan, biyobankalar akademik araştırmalar ile ilaç/biyoteknoloji endüstrisi arasında bir köprü olarak kabul edilmektedir 2,3,4,5. Büyük veri toplama ve yapay zekanın sağladığı benzeri görülmemiş fırsatlar sayesinde, biyobankaların kanser araştırmalarındaki rolü sürekli olarak gelişmektedir6.
Biyobankalar tarafından işlenen biyomateryallerin geniş spektrumu, demografik ve çevresel veriler, tümör tipi, histolojik derece, evre, lenfovasküler invazyon varlığı ve biyobelirteçlerin durumu 7,8 dahil olmak üzere klinikopatolojik bilgilerle birleştirilmiştir. Ne kadar yüksek kaliteli örnekler ve veriler elde edilebilirse, araştırma o kadar hızlı ilerleyecek ve sağlık hizmeti sunumunu etkileyecektir9. Yaygın olarak benimsenen SÇP’lere, kalite kontrollerine ve yönergelere (örneğin, ABD Ulusal Kanser Enstitüsü, İngiltere Kanser Biyobankaları Konfederasyonu ve AB Uluslararası Biyolojik ve Çevresel Depolar Derneği) uyması gereken etik ve yasal ilkelere dayanan katı bir düzenleyici çerçeve vardır10,11.
Biyobankaların tüm önemli yönleri için SÇP’lerin geliştirilmesi, kalite, izlenebilirlik, tutarlılık, tekrarlanabilirlik ve geri dönüş süreleri açısından çeşitli avantajlar sağlamaktadır12,13. SÇP uygulamasının bir diğer önemli yönü de biyobanka çalışanları ve araştırmacıları için daha iyi problem çözme ve alternatif prosedürlere olanak tanıyan biyobanka yönetiminin optimizasyonu ile temsil edilmektedir14. Tüm bu yönler biyobanka iş akışının bir parçasıdır (Şekil 1).
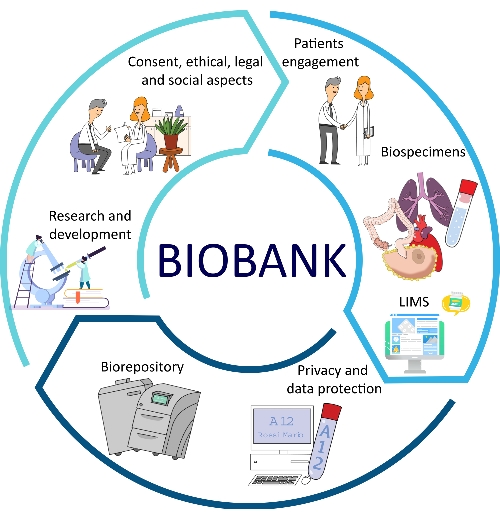
Şekil 1: Biyobankacılığın optimizasyonuna katkıda bulunan farklı faktörler. Kısaltma: LIMS = laboratuvar bilgi yönetim sistemi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu son derece spesifik ve hassas veriler, biyobankacılıkta sıkı yönetsel standart prosedürler gerektirir. Biyobanka örneklerine ve verilerine erişmesi gereken tüm araştırmacılara ayrıntılı ve doğrulanmış bir proje formu sunulmalıdır. İstekte verilen bilgiler, çalışma metodolojisini ve tasarımını, amaçlarını, hedeflerini ve bütçesini içermelidir. Araştırma projelerine yapılan başvuruların değerlendirilmesinde sermaye rolü olan bir biyobanka Teknik Bilim Kurulu kurulmalıdır. Bu organ, biyobanka biriminden, klinik bölümlerden, araştırma gruplarından, veri korumadan, hukuk bürosundan ve teknoloji transfer ofisinden üyeleri içermelidir.
Avrupa Onkoloji Enstitüsü’nün (IEO) Translasyonel ve Dijital Tıp Birimi için Biyobanka, sağlanan hizmetlerin kalitesi ve niceliğinin yanı sıra inovasyon açısından biyobankalar için dünya çapında bir referanstır. Bu tam sertifikalı tesis (UNI EN ISO 9001: 2015-Certiquality), BBMRI-ERIC İtalyan düğümünün (yani, Biyobankacılık ve BiyoMoleküler Kaynaklar Araştırma Altyapısı) ayrılmaz bir parçasıdır ve hem klinik birimler hem de araştırma altyapısı ile etkileşime girer.
Biyobankalar tarafından depolanan biyoörnek türlerinde büyük heterojenlik vardır. Bunlar arasında doku örnekleri (taze dondurulmuş veya parafin korunmuş) biyosıvılar (örneğin, plazma, serum, kan, idrar, dışkı), hücre kültürleri ve periferik kan mononükleer hücreleri (PBMC’ler) bulunur. Biyobankamız, Avrupa’nın en büyük biyobanka ağlarından biri olan ve ulusal düğümler tarafından koordine edilen biyobankalara ve biyomoleküler kaynaklara erişim için bir portal sağlayan Avrupa Biyobankacılık Araştırma Altyapısı (BBMRI-ERIC) ile sinerjik bir şekilde faaliyet göstermektedir15. BBMRI-ERIC’e ek olarak, Uluslararası Biyolojik ve Çevresel Depolar Derneği (ISBER) de biyobankacılık16 için işletme prosedürlerinin standardizasyonunda önemli bir rol oynamıştır.
Patoloji Bölümü’nün bir parçası olan Biyobanka Birimi, hastanın merkeziliğine, klinik araştırmaların geliştirilmesine destek, sürekli iyileştirme, insan kaynaklarının artırılması, uluslararası işbirliği, eğitim etkinliklerine destek, işyerinde güvenlik ve bilimsel ve teknolojik büyümeye kendini adamıştır. Ortak vizyon, hizmetlerin ve inovasyonun kalitesi ve miktarı açısından biyobankalar için ulusal ve Avrupa simgelerini oluşturmaktır. Toplanan biyolojik örnekler, yeni biyobelirteçleri ve yeni ilaçları tanımlamak (örneğin, giderek daha kişiselleştirilmiş tedaviler geliştirmek) ve araştırmada mükemmellik yoluyla hastalar için mevcut en iyi tedaviyi sağlamak için kullanılır.
Her biyolojik örnek, hasta15 tarafından ifade edilen Bilimsel Araştırma Katılım Anlaşması’nın varlığı için önceden doğrulandıktan sonra toplanır ve işlenir. Biyolojik olarak toplanan örnekler, araştırma projeleri veya klinik çalışmalar yürütmek için kullanılır ve aşırı (yani, teşhis amacıyla gerekli değildir), patolojik ve patolojik olmayan cerrahi örnekleri, sıvı biyopsileri (örneğin, kan, serum, plazma ve idrar) ve diğer biyolojik örnekleri içerir. Bu biyomateryaller özel kriyoprezervasyon protokollerine göre depolanır. Bu yazıda büyük bir kanser merkezinin biyobanka protokolleri sunulmaktadır.
Protocol
Representative Results
Discussion
Onkoloji çok büyük ilerlemeler kaydetmiş olsa da, kanser dünya çapında önde gelen bir morbidite ve mortalite nedeni olmaya devam etmektedir20. Tümör heterojenliğini, zaman içindeki zamansal evrimini ve hedefe yönelik tedavinin sonuçlarını anlamak, rutin klinik bakım bağlamında doğru veri toplanmasına kesinlikle bağlıdır21. Bu bakımdan onkolojik prediktif patolojide “multiomik” yaklaşım ivme kazanmaktadır22. Geleneksel doku bazlı biyobelirteç değerlendirmesi, kan, plazma, idrar, tükürük ve dışkı23,24,25,26 gibi çoklu yeni biyoanalitler kullanılarak entegre edilmektedir. Bu nedenle, biyobankalar artık klinik uygulamaları geliştirmek için çok önemli altyapılar olarak kabul edilmektedir. Kanser araştırmalarının tarihine baktığımızda, en etkileyici ve çığır açan keşiflerin, kanser dokusunun veya sıvı biyopsilerin doğrudan incelenmesi olmadan asla mümkün olamayacağını anlıyoruz. Zamanla, kanser dokusunun kaynağı ve incelenecek sıvı biyopsi türü, ham diseksiyonlardan, rastgele “şans eseri karşılaşmalardan” ve bazı durumlarda yasadışı kaçakçılıktan organize kanser koleksiyonlarına ve stratejik modern onkoloji bankalarına dönüşmüştür. Birçok etik konunun dikkate alınması hem pratikte hem de modern onkoloji bankalarını geçmişin onkoloji koleksiyonlarından ayıran temel faktörlerde önemli ölçüde değişmiştir.
Kanser araştırmalarındaki ilerlemeler ve günümüzde modern teknolojiler tarafından sağlanan çok miktarda moleküler bilgi nedeniyle, biyobankaların, özellikle de kanser merkezlerindekilerin, çeşitli metodolojik sorunlarla karşı karşıya kalabileceği giderek daha belirgin hale gelmektedir. Bunlar arasında teknoloji, SÇP standardizasyonunu ve uyumunu hala engelleyen evrensel bir zorluk haline gelmiştir. Temel biyobanka faaliyetlerini sürdürmenin bir diğer kritik yönü, tüm hastane kimliklerini ve hastanenin yazılımından gelen tüm kodlanmış klinik verileri alabilen ve otomatik olarak koruyabilen entegre bir LIMS yazılımına sahip olmaktır. Biyobankaları yönetmek için kullanılan diğer değerli yazılımların ve bazı ücretsiz yazılımların biyobanka yönetimi için 27,28,29,30,31 elde edilebilmesi dikkat çekicidir. Biyobankalardaki bir diğer kritik adım, tüm hastalar için katılım paktının uygulanması ve klinik verilerin ve biyoörneklerin depolanması için gerekli yasal ve etik anlaşmadır10,32.
Bu bağlamda, bu protokol, rıza olmadan biyoörneklerin toplanmasına ve depolanmasına izin vermeyen iyi tanımlanmış kılavuzlara sahiptir. Bu aynı zamanda kritik bir konudur, çünkü hastalar numuneleri saklandıktan sonra bile katılımlarını geri çekebilirler; Böylece, bu tür örnekleri biyobankacılık sisteminden hızla çıkarmak için yöntemler uygulanmıştır. Biyobankamız tarafından işe alınan hastalardan gelen biyoörnekler, toplama ve depolama için katı protokoller izler. Bu bağlamda, bu süreci izlemek için birkaç önemli husus değerlendirilmiş ve sürekli olarak geliştirilmektedir. Özellikle, ISO9001 sertifikası, dokunun kaynağına bağlı olarak 30 dakika veya 60 dakikanın altında tutulması gereken sıcak iskemik zaman gibi çeşitli performans göstergeleri gerektirir. Ek olarak, sıvı biyopsiler ve biyolojik sıvılar, sıkı zaman prosedürleri 15,33,34,35,36 uyarınca standartlaştırılmış protokoller kullanılarak toplanır.
Biyobankaların iş akışlarında belirli özellikler büyük önem taşımaktadır. Bunlar, tanısal nedenlerle dokunun örneklenmesini garanti eden sertifikalı bir patologun varlığını ve yüksek kaliteli numunelerle uyumlu bir zaman diliminde biyobankacılık için doku toplanmasını içerir (iskemik zaman, daha az sıcak iskemik zaman gerektiren RNA’ya bağımlı tahliller gibi bazı araştırma türleri için önemli bir göstergedir). Ayrıca, biyobankalarda numune depolama için gerekli alanın yönetilmesi büyük önem taşımaktadır. Toplanan sıvı biyopsilerin sayısı, çalışma tasarımı tarafından yönlendirilebilir. Sıvı biyopsiler, her çalışma tasarımında tanımlandığı gibi, hem preoperatif hem de takip döneminde sıklıkla toplanabilir.
Kanser önleme ve tümörlerin erken teşhisi için tarama kampanyaları sayesinde, yani gelişimin erken aşamalarında küçük boyutlu meme tümörleri ve minimal invaziv cerrahi tekniklerin mevcudiyeti, araştırma için mevcut doku örneklerinin sayısını azaltmıştır (çoğu doku örneği her zaman teşhis amacıyla kullanıldığından). Biyolojik örnekleri toplama ve depolama kapasitesi son birkaç yılda önemli ölçüde artmıştır. Bu, biyolojik sıvılar için gözlemlenebilir ve bu biyobankanın, bu enstitünün araştırma gruplarını hasta kaynaklı açıklamalı materyale olan artan talepte desteklemek için artan kapasitesini yansıtmaktadır. Bu gelişmelere rağmen, dünyanın farklı yerlerinden biyobankalar arasında koordinasyon gerektiren ve ancak benzer prosedürlerin uygulanmasıyla entegre edilebilen çok merkezli çalışmalar için bazı sınırlamalar yaşadık.
Tüm klinik ve demografik bilgilerin toplanması da dahil olmak üzere biyobankacılıkla ilgili etik ve teknik konuların çoğunu dışladıktan sonra, bir sonraki hedef, tanı ve araştırma amacıyla kullanılan tüm histolojik preparatların ve boyamanın dijitalleştirilmesini uygulamaktır. Bu, geleceğin standardı haline gelecek olan tamamen entegre bir dijital patoloji ve biyobankadan büyük ölçüde yararlanacak yeni nesil çalışmalar için temel öneme sahiptir. Entegre veri ve dijital görüntülere sahip çok sayıda hasta, kanser hastası bakımının iyileştirilmesi için çok merkezli, büyük yapay zeka (AI) çalışmalarını tetikleyebilir. Sonuç olarak, iyi sağlık hizmetlerinin tanı ve tedavi ile bitmediğine inanıyoruz. En iyi uygulamalar, herhangi bir hastalık için, özellikle de yaşam beklentisini veya kalitesini ciddi şekilde etkileyenler için sürekli tanı ve tedavi iyileştirme yollarını bulmayı içerir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, son on yılda araştırma programlarımıza biyoörneklerinin bağışı yoluyla aktif olarak katılan tüm hastalara teşekkür eder. Onlar olmadan, bu araştırma mümkün olmazdı. IEO’da çalışan tüm personele, hemşirelere, teknisyenlere, biyologlara, doktorlara ve tüm klinik ve araştırma birimlerinin yöneticilerine de minnettarız. Yazarlar, Prof. Pier Paolo Di Fiore ve Prof. Giancarlo Pruneri’ye rehberlikleri için minnettardır. Son olarak, bu çalışmayı IEO’nun kurucusu Prof. Umberto Veronesi’ye ve kanser araştırmalarını ve hasta bakımını entegre etme konusundaki öncü yaklaşımına ithaf ediyoruz.
Materials
| Blue Max Con Tubes 15 mL | Falcon B.D | 352096 | |
| Blue Max Con Tubes 50 mL | Euroclone Spa | FLC352070 | |
| Box with 81 position for tissue storage | Ettore Pasquali Srl. | 06.0945.00 | |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek | 63950 | Preservation and isolation of both cf-DNA and cf-RNA from a single tube and in particular preserve cf-DNA/ct-DNA for 30 days at ambient temperature and for up to 8 days at 37 °C |
| Cryomold Standard (25 X 20 X 5 mm) | Olympus Italia S.r.l. | 4557 | Disposable plastic Cryomold molds create a uniformly shaped, flat-surface specimen block when used with O.C.T |
| Dimethyl Sulfoxide Plastic Bottle – 1 L | Vwr International S.R.L. | MFCD00002089 | It acts to preserve the reconstitution of the medium for the storage of frozen cells |
| Dpbs 1x W/o Ca And Mg – 500 mL | Microtech Srl | TL1006-500ML | Washing Buffer cell |
| Dualfilter T.I.P.S 1,000 µL | Euroclone Spa | 4809 | |
| Dualfilter T.I.P.S 200 µL | Euroclone Spa | 4823 | |
| Easytrack Barcode Reader for single tube datamatrix | Twin Helix Srl | TH-ETR4400 | 2D barcode tubes reader with USB connection |
| Fetal Bovine Serum Origin Brazileu S/fil | Microtech S.R.L | RM10532-500ML | Defrost at +4 °C, usually for two days, and once melted, start decomplementation at 56 °C for 45 min Let it cool down to room temperature, and aliquot it. Refroze them to -20 °C, and remember to defrost them every time the aliquots are needed |
| Ficoll Paque Plus (ge) 6 x 500 mL | Euroclone Spa | GEH17144003 | Ficoll is a medium for density gradient, It is sterile and ready for use. It alloes to get peripheral blood mononuclear cells, bone marrow and umbilical cord blood |
| Fixing solution Killik of 100 mL (OCT) | Bio-optica Milano S.p.a. | 05-9801 | Gel inclusion medium that solidifies at cold the water-soluble tissue (e.g., biopsies, frustules) |
| FLASH-FREEZE | Milestone | n.a. | Freezing appliance |
| Forma 8600 Series Chest Freezers (Temperature Range: -50 °C to -86 °C) 85 liters | Thermo Fisher Scientific Srl | 803CV | Orizzontal freezer |
| Isopentane 500 mL | Vwr International S.R.L. | 24872260 | Liquid included in theFLASH-FREEZE camera for freezing |
| Nautilus Lims Software | Thermo Scientific™ | n.a. | The software implementation is able to track all patients’ biological samples. Receives Personal and Clinical information automatically during registration due to the integration with IEO operating systems. Nautilus is integrated with the web service through three IEO operative systems: BAC – IEO central registry with personal information, wHospital – medical record |
| Pasteur pipette 10 mL | Euroclone Spa | CC4488 | |
| Pasteur pipette 3 mL | Euroclone Spa | APT1502 | |
| PATHOX | Dedalus ItaliTesi Elettronica e Sistemi Informativi S.p.A.a S.p.A. | n.a. | PATHOX – management system for the Pathology unit where several factors are registered for the Biobank, such as the histological samples, the related diagnoses, and biomarkers |
| Petri dishes, polystyrene – size 100 mm x 20 mm, slippable | Euroclone Spa | FLC353003 | |
| Set of 4 adapters 19 x 5/7 mL vac | Thermo Fisher Scientific Srl | 75003680 | |
| Set of 4 adapters 4 x 50 conical | Thermo Fisher Scientific Srl | 75003683 | |
| Set of 4 adapters 9 x 15 mL conical | Thermo Fisher Scientific Srl | 75003682 | |
| Single-use slide for counting cell | Biosigma S.P.A. | 347143/001 | Specifically used for individual cell count |
| Stamps Freezerbondz for tissue boxes, nitrogen-liquid proof , H 9,53 mm x L 25,40 mm | Twin Helix Srl | THT-152-492-3 | |
| Thermo Scientific TSX Series Ultra-Low Freezers (-50 °C to -86 °C) 949 liters | Thermo Fisher Scientific Srl | TSX70086V | Vertical freezer |
| Thermo Scientific Refrigerated Centrifuge SL16R | Thermo Fisher Scientific Srl | 75004030 | |
| Tissue box labels in Permanent | Twin Helix Srl | THT-199-482-3 | |
| Tuerks Solution | Merck Life Science S.R.L. | 1092770100 | In light microscopy, it is specifically used as stain for leukocyte |
| TX-400 Rotor TX-400 swinging bucket hol | Thermo Fisher Scientific Srl | 75003181 | |
| White box for storage | Bio Optica | 07-7300 | |
| wHospital Software | wHealth Lutech Group | n.a. | wHospital – medical record management system with personal information, administrative cases, and the informed consent of the patients |
References
- Pagni, F., et al. Targeting immune-related biological processes in solid tumors: We do need biomarkers. International Journal of Molecular Sciences. 20 (21), 5452 (2019).
- Braun, K. L., et al. Cancer patient perceptions about biobanking and preferred timing of consent. Biopreservation and Biobanking. 12 (2), 106-112 (2014).
- Bycroft, C., et al. The UK Biobank resource with deep phenotyping and genomic data. Nature. 562 (7726), 203-209 (2018).
- Saifuddin, S. R., et al. King’s Health Partners’ Prostate Cancer Biobank (KHP PCaBB). BMC Cancer. 17 (1), 784 (2017).
- Lopez, G., et al. Molecular insights into the classification of luminal breast cancers: The genomic heterogeneity of progesterone-negative tumors. International Journal of Molecular Sciences. 20 (3), 510 (2019).
- Kinkorová, J. Biobanks in the era of personalized medicine: Objectives, challenges, and innovation: Overview. The EPMA Journal. 7 (1), 4 (2015).
- Luo, J., et al. Intravital biobank and personalized cancer therapy: The correlation with omics. International Journal of Cancer. 135 (7), 1511-1516 (2014).
- Invernizzi, M., et al. Quality of life interventions in breast cancer survivors: State of the art in targeted rehabilitation strategies. Anticancer Agents in Medicinal Chemistry. 22 (4), 801-810 (2021).
- Roux, J., Zeghidi, M., Villar, S., Kozlakidis, Z. Biosafety and biobanking: Current understanding and knowledge gaps. Biosafety and Health. 3 (5), 244-248 (2021).
- Sanchini, V., et al. A trust-based pact in research biobanks. From theory to practice. Bioethics. 30 (4), 260-271 (2016).
- Vaught, J., Kelly, A., Hewitt, R. A review of international biobanks and networks: Success factors and key benchmarks. Biopreservation and Biobanking. 7 (3), 143-150 (2009).
- Ferrin, I., et al. Isolation, culture, and expansion of mesenchymal stem cells. Methods in Molecular Biology. 1590, 177-190 (2017).
- Hermansen, J. U., et al. The Norwegian childhood cancer biobank. Cancer Reports. , 1555 (2021).
- Schmelz, M., et al. A plan for emergency shutdown and reopening for a consortium of biobanks. Biopreservation and Biobanking. 19 (5), 394-398 (2021).
- Salvaterra, E., Corfield, J. . Advances in Biobanking Practice Through Public and Private Collaborations. , (2017).
- Snapes, E., Simeon-Dubach, D. ISBER best practices for repositories, moving toward the fifth edition. Biopreservation and Biobanking. 20 (1), 107-108 (2022).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harbour Protocols. (8), 4991 (2008).
- Staining methods in frozen section: Best lab practices. Laboratory Best Practice Blog. UC Davis Health Available from: https://health.ucdavis.edu/blog/lab-best-practice/staining-methods-in-frozen-section-best-lab-practices/2020/03 (2020)
- Craciun, L., et al. Tumor banks: A quality control scheme proposal. Frontiers in Medicine. 6, 225 (2019).
- Ma, X., Yu, H. Global burden of cancer. The Yale Journal of Biology and Medicine. 79 (3-4), 85-94 (2006).
- Angerilli, V., et al. The role of the pathologist in the next-generation era of tumor molecular characterization. Diagnostics. 11 (2), 339 (2021).
- Correa-Aguila, R., Alonso-Pupo, N., Hernández-Rodríguez, E. W. Multi-omics data integration approaches for precision oncology. Molecular Omics. , (2022).
- Salati, M., et al. ctDNA analysis in the personalized clinical management of gastroesophageal adenocarcinoma: Turning hope into reality. Future Oncology. 17 (33), 4607-4618 (2021).
- Mirzayi, C., et al. Reporting guidelines for human microbiome research: The STORMS checklist. Nature Medicine. 27 (11), 1885-1892 (2021).
- Cortvrindt, C., Speeckaert, R., Delanghe, J. R., Speeckaert, M. M. Urinary epidermal growth factor: A promising "next generation" biomarker in kidney disease. American Journal of Nephrology. , (2022).
- Fusco, N., Fumagalli, C., Guerini-Rocco, E. Looking for sputum biomarkers in lung cancer secondary prevention: Where are we now. Journal of Thoracic Disease. 9 (11), 4277-4279 (2017).
- Im, K., Gui, D., Yong, W. H. An introduction to hardware, software, and other information technology needs of biomedical biobanks. Methods in Molecular Biology. 1897, 17-29 (2019).
- Paul, S., Gade, A., Mallipeddi, S. The state of cloud-based biospecimen and biobank data management tools. Biopreservation and Biobanking. 15 (2), 169-172 (2017).
- Fthenou, E., et al. implementation, and integration of heterogenous information technology infrastructures in the Qatar biobank. Biopreservation and Biobanking. 17 (6), 494-505 (2019).
- Tukacs, E., et al. Model requirements for Biobank Software Systems. Bioinformation. 8 (6), 290-292 (2012).
- Willers, C., et al. A versatile, secure, and sustainable all-in-one biobank-registry data solution: The A3BC REDCap model. Biopreservation and Biobanking. , (2021).
- D’Abramo, F., Schildmann, J., Vollmann, J. Research participants’ perceptions and views on consent for biobank research: A review of empirical data and ethical analysis. BMC Medical Ethics. 16, 60 (2015).
- Policiuc, L., et al. The foundation of personalized medicine is the establishment of biobanks and their standardization. Journal of BUON. 23 (3), 550-560 (2018).
- Lygirou, V., Makridakis, M., Vlahou, A. Biological sample collection for clinical proteomics: Existing SOPs. Methods in Molecular Biology. 1243, 3-27 (2015).
- Pisapia, P., Malapelle, U., Troncone, G. Liquid biopsy and lung cancer. Acta Cytologica. 63 (6), 489-496 (2019).
- Spruessel, A., et al. Tissue ischemia time affects gene and protein expression patterns within minutes following surgical tumor excision. Biotechniques. 36 (6), 1030-1037 (2004).

