Biobanca per la medicina traslazionale: procedure operative standard per una gestione ottimale dei campioni
Summary
Le biobanche sono risorse cruciali per la ricerca biomedica e l’unità Biobank for Translational and Digital Medicine presso l’Istituto europeo di oncologia è un modello in questo campo. Qui forniamo una descrizione dettagliata delle procedure operative standard delle biobanche per la gestione di diversi tipi di campioni biologici umani.
Abstract
Le biobanche sono infrastrutture di ricerca chiave volte alla raccolta, allo stoccaggio, all’elaborazione e alla condivisione di campioni biologici umani di alta qualità e dati associati per la ricerca, la diagnosi e la medicina personalizzata. L’unità Biobank for Translational and Digital Medicine presso l’Istituto Europeo di Oncologia (IEO) è un punto di riferimento in questo campo. Le biobanche collaborano con divisioni cliniche, gruppi di ricerca interni ed esterni e l’industria, supportando il trattamento dei pazienti e il progresso scientifico, compresa la diagnostica innovativa, la scoperta di biomarcatori e la progettazione di studi clinici. Dato il ruolo centrale delle biobanche nella ricerca moderna, le procedure operative standard (SOP) delle biobanche dovrebbero essere estremamente precise. SOP e controlli da parte di specialisti certificati garantiscono la massima qualità dei campioni per l’implementazione di strategie personalizzate basate sulla scienza, diagnostiche, prognostiche e terapeutiche. Tuttavia, nonostante i numerosi sforzi per standardizzare e armonizzare le biobanche, questi protocolli, che seguono una rigida serie di regole, controlli di qualità e linee guida basate su principi etici e legali, non sono facilmente accessibili. Questo documento presenta le procedure operative standard della biobanca di un grande centro oncologico.
Introduction
Le biobanche sono biorepository finalizzati alla raccolta, all’archiviazione, all’elaborazione e alla condivisione di campioni biologici umani e dati associati per la ricerca e la diagnosi. Il loro ruolo è cruciale non solo per la scoperta e la convalida di biomarcatori, ma anche per lo sviluppo di nuovi farmaci1. Pertanto, la stragrande maggioranza dei programmi di ricerca traslazionale e clinica si basa sull’accesso a campioni biologici di alta qualità. A questo proposito, le biobanche sono considerate un ponte tra la ricerca accademica e l’industria farmaceutica/biotecnologica 2,3,4,5. A causa delle opportunità senza precedenti offerte dalla raccolta di big data e dall’intelligenza artificiale, il ruolo delle biobanche nella ricerca sul cancro è in continua evoluzione6.
L’ampio spettro di biomateriali gestiti dalle biobanche è accoppiato con informazioni clinico-patologiche, inclusi dati demografici e ambientali, tipo di tumore, grado istologico, stadio, presenza di invasione linfovascolare e stato dei biomarcatori 7,8. Più campioni e dati di alta qualità sono disponibili, più velocemente la ricerca avanzerà e avrà un impatto sull’assistenza sanitaria9. Esiste un quadro normativo rigoroso basato su principi etici e legali che dovrebbero seguire le SOP, i controlli di qualità e le linee guida ampiamente adottati (ad esempio, il National Cancer Institute degli Stati Uniti, la Confederazione britannica delle biobanche del cancro e la Società internazionale dell’UE per i depositi biologici e ambientali)10,11.
Lo sviluppo di SOP per tutti i principali aspetti delle biobanche porta diversi vantaggi in termini di qualità, tracciabilità, coerenza, riproducibilità e tempi di consegna12,13. Un altro aspetto importante dell’attuazione delle POS è rappresentato dall’ottimizzazione della gestione della biobanca, che consente una migliore risoluzione dei problemi e procedure alternative per i dipendenti e i ricercatori della biobanca14. Tutti questi aspetti fanno parte del flusso di lavoro della biobanca (Figura 1).
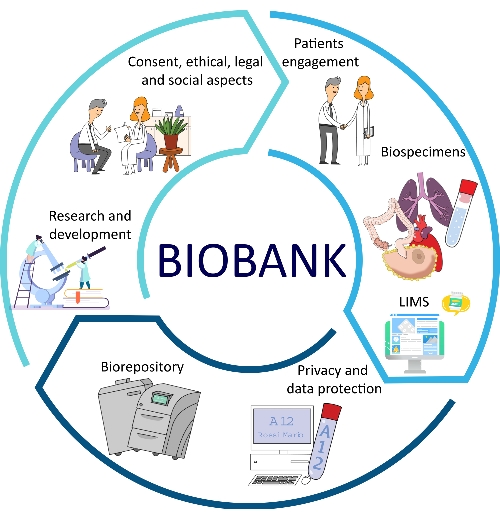
Figura 1: Diversi fattori che contribuiscono all’ottimizzazione del biobanking. Abbreviazione: LIMS = sistema di gestione delle informazioni di laboratorio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Questi dati altamente specifici e sensibili richiedono rigorose procedure manageriali standard nel biobanking. Un modulo di progetto dettagliato e convalidato dovrebbe essere messo a disposizione di tutti i ricercatori che hanno bisogno di accedere ai campioni e ai dati della biobanca. Le informazioni fornite nella richiesta dovrebbero includere la metodologia e la progettazione dello studio, gli obiettivi, gli obiettivi e il budget. Dovrebbe essere istituito un comitato tecnico scientifico della biobanca con il ruolo capitale della valutazione delle domande per progetti di ricerca. Questo organismo dovrebbe includere membri dell’unità di biobanca, divisioni cliniche, gruppi di ricerca, protezione dei dati, ufficio legale e ufficio di trasferimento tecnologico.
L’Unità Biobanca per la Medicina Traslazionale e Digitale dell’Istituto Europeo di Oncologia (IEO) è un riferimento mondiale per le biobanche in termini di qualità e quantità dei servizi forniti, nonché di innovazione. Questa struttura completamente certificata (UNI EN ISO 9001:2015-Certiquality) è parte integrante del nodo italiano BBMRI-ERIC (ovvero Biobanking and BioMolecular Resources Research Infrastructure) e interagisce sia con le unità cliniche che con le infrastrutture di ricerca.
C’è una grande eterogeneità nei tipi di campioni biologici conservati dalle biobanche. Questi includono campioni di tessuto – sia freschi congelati o conservati con paraffina – biofluidi (ad esempio, plasma, siero, sangue, urina, feci), colture cellulari e cellule mononucleate del sangue periferico (PBMC). La nostra biobanca opera in sinergia con l’infrastruttura di ricerca europea per il biobanking (BBMRI-ERIC), che è una delle più grandi reti di biobanche in Europa e fornisce un portale per l’accesso alle biobanche e alle risorse biomolecolari coordinate dai nodi nazionali15. Oltre a BBMRI-ERIC, anche l’International Society for Biological and Environmental Repositories (ISBER) ha svolto un ruolo importante nella standardizzazione delle procedure operative per il biobanking16.
L’Unità Biobanca, che fa parte della Divisione di Patologia, è impegnata nella centralità del paziente, nel sostegno allo sviluppo della ricerca clinica, nel miglioramento continuo, nella valorizzazione delle risorse umane, nella collaborazione internazionale, nel supporto agli eventi formativi, nella sicurezza nei luoghi di lavoro e nella crescita scientifica e tecnologica. La visione comune è quella di stabilire i punti di riferimento nazionali ed europei per le biobanche in termini di qualità e quantità dei servizi e innovazione. I campioni biologici raccolti vengono utilizzati per identificare nuovi biomarcatori e nuovi farmaci (ad esempio, per sviluppare terapie sempre più personalizzate) e per garantire il miglior trattamento disponibile per i pazienti attraverso l’eccellenza nella ricerca.
Ogni campione biologico viene raccolto e manipolato previa verifica della presenza del Consenso di Partecipazione alla Ricerca Scientifica espresso dal paziente15. I campioni biologici raccolti vengono utilizzati per condurre progetti di ricerca o studi clinici e includono campioni chirurgici patologici e non patologici in eccesso (cioè non necessari per scopi diagnostici), biopsie liquide (ad esempio, sangue, siero, plasma e urina) e altri campioni biologici. Questi biomateriali sono conservati secondo protocolli di crioconservazione dedicati. Questo documento fornisce i protocolli di biobanca di un grande centro oncologico.
Protocol
Representative Results
Discussion
Sebbene l’oncologia abbia fatto enormi progressi, il cancro rimane una delle principali cause di morbilità e mortalità in tutto il mondo20. La comprensione dell’eterogeneità del tumore, la sua evoluzione temporale nel tempo e i risultati di un trattamento mirato dipendono strettamente da un’accurata raccolta di dati nel contesto dell’assistenza clinica di routine21. A questo proposito, l’approccio “multi-omico” sta guadagnando slancio nella patologia predittiva oncologica22. La tradizionale valutazione dei biomarcatori basati sui tessuti viene integrata utilizzando più nuovi bioanaliti, come sangue, plasma, urine, saliva e feci23,24,25,26. Pertanto, le biobanche sono ora riconosciute come infrastrutture fondamentali per migliorare la pratica clinica. Guardando indietro alla storia della ricerca sul cancro, ci rendiamo conto che le scoperte più impressionanti e rivoluzionarie non sarebbero mai state possibili senza l’esame diretto del tessuto tumorale o delle biopsie liquide. Nel corso del tempo, la fonte del tessuto tumorale e il tipo di biopsia liquida da esaminare si sono evoluti da dissezioni grezze, “incontri casuali” e, in alcuni casi, traffico illecito a raccolte di cancro organizzate e banche oncologiche moderne strategiche. La considerazione di molte questioni etiche è cambiata considerevolmente sia nella pratica che nei principali fattori che distinguono le moderne banche oncologiche dalle collezioni oncologiche del passato.
A causa dei progressi nella ricerca sul cancro e della grande quantità di informazioni molecolari che sono ora fornite dalle moderne tecnologie, sta diventando sempre più evidente che le biobanche, in particolare quelle nei centri oncologici, possono affrontare diversi tipi di problemi metodologici. Tra queste, la tecnologia è diventata una sfida universale che impedisce ancora la standardizzazione e l’armonizzazione delle SOP. Un altro aspetto critico per il mantenimento delle attività di biobanca core è quello di avere un software LIMS integrato in grado di ricevere e mantenere automaticamente tutti gli ID ospedalieri e tutti i dati clinici codificati provenienti dal software dell’ospedale. È interessante notare che altri preziosi software utilizzati per gestire le biobanche e alcuni freeware possono essere ottenuti per la gestione delle biobanche 27,28,29,30,31. Un altro passo fondamentale nelle biobanche è l’attuazione del patto di partecipazione per tutti i pazienti e l’accordo legale ed etico necessario per la conservazione dei dati clinici e dei campioni biologici10,32.
A questo proposito, questo protocollo ha linee guida ben definite che non consentono la raccolta e la conservazione di campioni biologici in assenza di consenso. Anche questo è un problema critico poiché i pazienti possono ritirare la loro partecipazione anche dopo che i loro campioni sono stati conservati; Pertanto, sono stati implementati metodi per prelevare rapidamente tali campioni dal sistema di biobanking. I campioni biologici che arrivano da pazienti reclutati dalla nostra biobanca seguono rigidi protocolli per la raccolta e la conservazione. A questo proposito, diversi aspetti importanti sono stati valutati per monitorare questo processo e vengono continuamente migliorati. In particolare, la certificazione ISO9001 richiede diversi indicatori di prestazione, come il tempo ischemico caldo, che deve essere mantenuto per meno di 30 minuti o 60 minuti a seconda della fonte del tessuto. Inoltre, le biopsie liquide e i fluidi biologici vengono raccolti utilizzando protocolli standardizzati seguendo rigorose procedure temporali 15,33,34,35,36.
Le caratteristiche specifiche sono di grande importanza nei flussi di lavoro delle biobanche. Tra questi, la presenza di un patologo certificato, che garantisce il prelievo del tessuto per motivi diagnostici, e la raccolta di tessuto per biobanking in un arco temporale compatibile con un’alta qualità dei campioni (il tempo ischemico è un’indicazione importante per alcuni tipi di ricerca, come i saggi RNA-dipendenti, che richiedono un tempo ischemico meno caldo). Inoltre, la gestione dello spazio necessario per la conservazione dei campioni è di grande importanza nelle biobanche. Il numero di biopsie liquide raccolte potrebbe essere guidato dal disegno dello studio. Le biopsie liquide possono spesso essere raccolte sia durante il periodo preoperatorio che durante il periodo di follow-up, come definito da ciascun disegno di studio.
Grazie alle campagne di screening per la prevenzione del cancro e la diagnosi precoce dei tumori, cioè tumori al seno di piccole dimensioni nelle prime fasi di sviluppo, nonché la disponibilità di tecniche chirurgiche minimamente invasive, hanno ridotto il numero di campioni di tessuti disponibili per la ricerca (poiché la maggior parte dei campioni di tessuto sono sempre utilizzati per scopi diagnostici). La capacità di raccogliere e conservare campioni biologici è notevolmente migliorata negli ultimi anni. Questo potrebbe essere osservato per i fluidi biologici, riflettendo la maggiore capacità di questa biobanca di supportare i gruppi di ricerca di questo istituto nella crescente domanda di materiale annotato derivato dal paziente. Nonostante questi miglioramenti, abbiamo riscontrato alcune limitazioni per gli studi multicentrici che richiedono il coordinamento tra biobanche di diverse parti del mondo, che possono essere integrate solo implementando procedure simili.
Avendo escluso la maggior parte delle questioni etiche e tecniche riguardanti il biobanking, compresa la raccolta di tutte le informazioni cliniche e demografiche, il prossimo obiettivo è quello di implementare la digitalizzazione di tutti i preparati istologici e la colorazione utilizzati per scopi di diagnosi e ricerca. Questo è di fondamentale importanza per la prossima generazione di studi che trarranno grande beneficio da una patologia digitale e da una biobanca completamente integrate, che diventeranno lo standard per il futuro. Solo una grande serie di pazienti con dati integrati e immagini digitali può alimentare studi multicentrici e di intelligenza artificiale (AI) per il miglioramento della cura dei pazienti oncologici. In conclusione, crediamo che una buona assistenza sanitaria non finisca con la diagnosi e il trattamento. Le migliori pratiche comprendono la ricerca di modi per la diagnosi continua e il miglioramento del trattamento per qualsiasi malattia, in particolare quelle che influenzano gravemente l’aspettativa di vita o la qualità.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare tutti i pazienti che hanno partecipato attivamente durante l’ultimo decennio ai nostri programmi di ricerca attraverso la donazione dei loro campioni biologici. Senza di loro, questa ricerca non sarebbe possibile. Siamo inoltre grati a tutto il personale che lavora allo IEO, infermieri, tecnici, biologi, medici e ai direttori di tutte le unità cliniche e di ricerca. Gli autori sono grati al Prof. Pier Paolo Di Fiore e al Prof. Giancarlo Pruneri per la loro guida. Infine, dedichiamo questo lavoro al Prof. Umberto Veronesi, fondatore di IEO, e al suo approccio pionieristico nell’integrare la ricerca sul cancro e la cura del paziente.
Materials
| Blue Max Con Tubes 15 mL | Falcon B.D | 352096 | |
| Blue Max Con Tubes 50 mL | Euroclone Spa | FLC352070 | |
| Box with 81 position for tissue storage | Ettore Pasquali Srl. | 06.0945.00 | |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek | 63950 | Preservation and isolation of both cf-DNA and cf-RNA from a single tube and in particular preserve cf-DNA/ct-DNA for 30 days at ambient temperature and for up to 8 days at 37 °C |
| Cryomold Standard (25 X 20 X 5 mm) | Olympus Italia S.r.l. | 4557 | Disposable plastic Cryomold molds create a uniformly shaped, flat-surface specimen block when used with O.C.T |
| Dimethyl Sulfoxide Plastic Bottle – 1 L | Vwr International S.R.L. | MFCD00002089 | It acts to preserve the reconstitution of the medium for the storage of frozen cells |
| Dpbs 1x W/o Ca And Mg – 500 mL | Microtech Srl | TL1006-500ML | Washing Buffer cell |
| Dualfilter T.I.P.S 1,000 µL | Euroclone Spa | 4809 | |
| Dualfilter T.I.P.S 200 µL | Euroclone Spa | 4823 | |
| Easytrack Barcode Reader for single tube datamatrix | Twin Helix Srl | TH-ETR4400 | 2D barcode tubes reader with USB connection |
| Fetal Bovine Serum Origin Brazileu S/fil | Microtech S.R.L | RM10532-500ML | Defrost at +4 °C, usually for two days, and once melted, start decomplementation at 56 °C for 45 min Let it cool down to room temperature, and aliquot it. Refroze them to -20 °C, and remember to defrost them every time the aliquots are needed |
| Ficoll Paque Plus (ge) 6 x 500 mL | Euroclone Spa | GEH17144003 | Ficoll is a medium for density gradient, It is sterile and ready for use. It alloes to get peripheral blood mononuclear cells, bone marrow and umbilical cord blood |
| Fixing solution Killik of 100 mL (OCT) | Bio-optica Milano S.p.a. | 05-9801 | Gel inclusion medium that solidifies at cold the water-soluble tissue (e.g., biopsies, frustules) |
| FLASH-FREEZE | Milestone | n.a. | Freezing appliance |
| Forma 8600 Series Chest Freezers (Temperature Range: -50 °C to -86 °C) 85 liters | Thermo Fisher Scientific Srl | 803CV | Orizzontal freezer |
| Isopentane 500 mL | Vwr International S.R.L. | 24872260 | Liquid included in theFLASH-FREEZE camera for freezing |
| Nautilus Lims Software | Thermo Scientific™ | n.a. | The software implementation is able to track all patients’ biological samples. Receives Personal and Clinical information automatically during registration due to the integration with IEO operating systems. Nautilus is integrated with the web service through three IEO operative systems: BAC – IEO central registry with personal information, wHospital – medical record |
| Pasteur pipette 10 mL | Euroclone Spa | CC4488 | |
| Pasteur pipette 3 mL | Euroclone Spa | APT1502 | |
| PATHOX | Dedalus ItaliTesi Elettronica e Sistemi Informativi S.p.A.a S.p.A. | n.a. | PATHOX – management system for the Pathology unit where several factors are registered for the Biobank, such as the histological samples, the related diagnoses, and biomarkers |
| Petri dishes, polystyrene – size 100 mm x 20 mm, slippable | Euroclone Spa | FLC353003 | |
| Set of 4 adapters 19 x 5/7 mL vac | Thermo Fisher Scientific Srl | 75003680 | |
| Set of 4 adapters 4 x 50 conical | Thermo Fisher Scientific Srl | 75003683 | |
| Set of 4 adapters 9 x 15 mL conical | Thermo Fisher Scientific Srl | 75003682 | |
| Single-use slide for counting cell | Biosigma S.P.A. | 347143/001 | Specifically used for individual cell count |
| Stamps Freezerbondz for tissue boxes, nitrogen-liquid proof , H 9,53 mm x L 25,40 mm | Twin Helix Srl | THT-152-492-3 | |
| Thermo Scientific TSX Series Ultra-Low Freezers (-50 °C to -86 °C) 949 liters | Thermo Fisher Scientific Srl | TSX70086V | Vertical freezer |
| Thermo Scientific Refrigerated Centrifuge SL16R | Thermo Fisher Scientific Srl | 75004030 | |
| Tissue box labels in Permanent | Twin Helix Srl | THT-199-482-3 | |
| Tuerks Solution | Merck Life Science S.R.L. | 1092770100 | In light microscopy, it is specifically used as stain for leukocyte |
| TX-400 Rotor TX-400 swinging bucket hol | Thermo Fisher Scientific Srl | 75003181 | |
| White box for storage | Bio Optica | 07-7300 | |
| wHospital Software | wHealth Lutech Group | n.a. | wHospital – medical record management system with personal information, administrative cases, and the informed consent of the patients |
References
- Pagni, F., et al. Targeting immune-related biological processes in solid tumors: We do need biomarkers. International Journal of Molecular Sciences. 20 (21), 5452 (2019).
- Braun, K. L., et al. Cancer patient perceptions about biobanking and preferred timing of consent. Biopreservation and Biobanking. 12 (2), 106-112 (2014).
- Bycroft, C., et al. The UK Biobank resource with deep phenotyping and genomic data. Nature. 562 (7726), 203-209 (2018).
- Saifuddin, S. R., et al. King’s Health Partners’ Prostate Cancer Biobank (KHP PCaBB). BMC Cancer. 17 (1), 784 (2017).
- Lopez, G., et al. Molecular insights into the classification of luminal breast cancers: The genomic heterogeneity of progesterone-negative tumors. International Journal of Molecular Sciences. 20 (3), 510 (2019).
- Kinkorová, J. Biobanks in the era of personalized medicine: Objectives, challenges, and innovation: Overview. The EPMA Journal. 7 (1), 4 (2015).
- Luo, J., et al. Intravital biobank and personalized cancer therapy: The correlation with omics. International Journal of Cancer. 135 (7), 1511-1516 (2014).
- Invernizzi, M., et al. Quality of life interventions in breast cancer survivors: State of the art in targeted rehabilitation strategies. Anticancer Agents in Medicinal Chemistry. 22 (4), 801-810 (2021).
- Roux, J., Zeghidi, M., Villar, S., Kozlakidis, Z. Biosafety and biobanking: Current understanding and knowledge gaps. Biosafety and Health. 3 (5), 244-248 (2021).
- Sanchini, V., et al. A trust-based pact in research biobanks. From theory to practice. Bioethics. 30 (4), 260-271 (2016).
- Vaught, J., Kelly, A., Hewitt, R. A review of international biobanks and networks: Success factors and key benchmarks. Biopreservation and Biobanking. 7 (3), 143-150 (2009).
- Ferrin, I., et al. Isolation, culture, and expansion of mesenchymal stem cells. Methods in Molecular Biology. 1590, 177-190 (2017).
- Hermansen, J. U., et al. The Norwegian childhood cancer biobank. Cancer Reports. , 1555 (2021).
- Schmelz, M., et al. A plan for emergency shutdown and reopening for a consortium of biobanks. Biopreservation and Biobanking. 19 (5), 394-398 (2021).
- Salvaterra, E., Corfield, J. . Advances in Biobanking Practice Through Public and Private Collaborations. , (2017).
- Snapes, E., Simeon-Dubach, D. ISBER best practices for repositories, moving toward the fifth edition. Biopreservation and Biobanking. 20 (1), 107-108 (2022).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harbour Protocols. (8), 4991 (2008).
- Staining methods in frozen section: Best lab practices. Laboratory Best Practice Blog. UC Davis Health Available from: https://health.ucdavis.edu/blog/lab-best-practice/staining-methods-in-frozen-section-best-lab-practices/2020/03 (2020)
- Craciun, L., et al. Tumor banks: A quality control scheme proposal. Frontiers in Medicine. 6, 225 (2019).
- Ma, X., Yu, H. Global burden of cancer. The Yale Journal of Biology and Medicine. 79 (3-4), 85-94 (2006).
- Angerilli, V., et al. The role of the pathologist in the next-generation era of tumor molecular characterization. Diagnostics. 11 (2), 339 (2021).
- Correa-Aguila, R., Alonso-Pupo, N., Hernández-Rodríguez, E. W. Multi-omics data integration approaches for precision oncology. Molecular Omics. , (2022).
- Salati, M., et al. ctDNA analysis in the personalized clinical management of gastroesophageal adenocarcinoma: Turning hope into reality. Future Oncology. 17 (33), 4607-4618 (2021).
- Mirzayi, C., et al. Reporting guidelines for human microbiome research: The STORMS checklist. Nature Medicine. 27 (11), 1885-1892 (2021).
- Cortvrindt, C., Speeckaert, R., Delanghe, J. R., Speeckaert, M. M. Urinary epidermal growth factor: A promising "next generation" biomarker in kidney disease. American Journal of Nephrology. , (2022).
- Fusco, N., Fumagalli, C., Guerini-Rocco, E. Looking for sputum biomarkers in lung cancer secondary prevention: Where are we now. Journal of Thoracic Disease. 9 (11), 4277-4279 (2017).
- Im, K., Gui, D., Yong, W. H. An introduction to hardware, software, and other information technology needs of biomedical biobanks. Methods in Molecular Biology. 1897, 17-29 (2019).
- Paul, S., Gade, A., Mallipeddi, S. The state of cloud-based biospecimen and biobank data management tools. Biopreservation and Biobanking. 15 (2), 169-172 (2017).
- Fthenou, E., et al. implementation, and integration of heterogenous information technology infrastructures in the Qatar biobank. Biopreservation and Biobanking. 17 (6), 494-505 (2019).
- Tukacs, E., et al. Model requirements for Biobank Software Systems. Bioinformation. 8 (6), 290-292 (2012).
- Willers, C., et al. A versatile, secure, and sustainable all-in-one biobank-registry data solution: The A3BC REDCap model. Biopreservation and Biobanking. , (2021).
- D’Abramo, F., Schildmann, J., Vollmann, J. Research participants’ perceptions and views on consent for biobank research: A review of empirical data and ethical analysis. BMC Medical Ethics. 16, 60 (2015).
- Policiuc, L., et al. The foundation of personalized medicine is the establishment of biobanks and their standardization. Journal of BUON. 23 (3), 550-560 (2018).
- Lygirou, V., Makridakis, M., Vlahou, A. Biological sample collection for clinical proteomics: Existing SOPs. Methods in Molecular Biology. 1243, 3-27 (2015).
- Pisapia, P., Malapelle, U., Troncone, G. Liquid biopsy and lung cancer. Acta Cytologica. 63 (6), 489-496 (2019).
- Spruessel, A., et al. Tissue ischemia time affects gene and protein expression patterns within minutes following surgical tumor excision. Biotechniques. 36 (6), 1030-1037 (2004).

