机器人钻孔开颅术对小鼠颅窗手术热损伤的评估
Summary
颅窗已成为一种普遍实施的手术技术,允许在转基因小鼠中进行活体成像。该协议描述了手术机器人的使用,该机器人对颅窗进行半自动骨钻孔,可以帮助减少外科医生之间的变异性并部分减轻热血脑屏障损伤。
Abstract
颅窗手术允许使用多光子或其他活体成像技术对活小鼠的脑组织进行成像。然而,当用手进行任何开颅手术时,脑组织通常会受到热损伤,这本质上是手术与手术之间的变化,并且可能取决于个体外科医生的技术。实施手术机器人可以使手术标准化,并减少与手术相关的热损伤。在这项研究中,测试了三种机器人钻孔方法来评估热损伤:水平、逐点和脉冲逐点。水平钻孔使用连续钻孔原理图,而逐点钻孔围绕颅窗的几个孔。脉冲逐点增加了“2 s 开,2 s 关”钻孔方案,以允许在钻孔之间冷却。静脉注射的埃文斯蓝(EB)染料的荧光成像测量脑组织的损伤,而放置在钻孔部位下方的热电偶测量热损伤。热电偶结果表明,与水平(16.66 °C ± 2.08 °C)和逐点(18.69 °C ± 1.75 °C)组相比,脉冲逐点(6.90 °C ± 1.35 °C)组的温度变化显着降低。同样,与水平方法相比,脉冲逐点组在颅窗钻孔后也显示出显着减少的EB存在,表明对大脑血管的损害较小。因此,脉冲逐点钻孔方法似乎是减少热损伤的最佳方案。机器人钻头是一种有用的工具,可帮助最大程度地减少训练、可变性并减少热损伤。随着多光子成像在研究实验室中的使用越来越多,提高结果的严谨性和可重复性非常重要。这里讨论的方法将有助于告知其他人如何更好地使用这些手术机器人来进一步推进该领域。
Introduction
颅窗已在整个神经科学、神经工程和生物学领域得到普遍应用,以便对活体动物的皮层进行直接可视化和成像1,2,3,4,5,6,7,8,9,10,11.转基因小鼠和多光子成像的强大结合为体内大脑中的电路活动和其他生物学见解提供了极其有价值的见解12,13,14,15,16,17,18。安装在头骨上的微型显微镜进一步扩展了这些功能,使清醒的,自由移动的动物能够进行记录19。创建颅窗的过程需要电钻以薄或完全去除颅骨以产生足够大的颅骨切开术,以将一块透明玻璃固定在皮层20上。聚二甲基硅氧烷(PDMS)和其他聚合物也已作为颅窗材料9,21进行了测试。最终,理想的颅窗是不改变或干扰下方正常内源性活动的颅窗。然而,人们普遍认为,颅窗钻孔会加重下层组织,导致大脑损伤、环境破坏,并影响脑膜直至阻塞多光子成像深度22。由此产生的神经炎症具有广泛的影响,从血脑屏障(BBB)的通透性到植入部位周围神经胶质细胞的激活和募集23。因此,表征更安全、更可重复的颅窗钻孔方法对于一致的成像质量和减少混杂因素至关重要。
虽然注意尽量减少对下层组织的创伤,但钻孔骨骼的行为有可能对大脑造成热和机械扰动24,25。意外钻头插入硬脑膜造成的机械创伤可能进一步诱发不同程度的皮质损伤24。在Shoffstall等人25的一项研究中,骨钻孔产生的热量导致BBB渗透性增加,如脑实质25中存在埃文斯蓝(EB)染料所示。静脉注射的EB染料与血液中循环的白蛋白结合,因此通常不会以可观的浓度穿过健康的BBB。因此,EB染料通常用作BBB渗透性26,27的敏感标志物。虽然他们的研究没有直接测量BBB通透性对后续生物后遗症的影响,但先前的研究已将BBB通透性与对长期植入微电极的神经炎症反应增加和运动功能的改变相关联28。
根据研究目标,热损伤和机械损伤的程度可能会导致实验误差,从而对研究的严谨性和可重复性产生负面影响。有几十种引用的制作颅窗的方法,每种方法使用不同的钻孔设备,速度,技术和用户1,2,3,4,5,6,7,8,9,10,11。Shoffstall等人25报告说,观察到的加热结果变化归因于钻头施加的力,进给速率和应用角度的变化,以及手工钻孔时无法控制的其他方面25。人们认为,自动钻井系统和其他立体定位设备可以提高可重复性和结果一致性,但已发表的方法研究并未严格评估温度或BBB渗透性作为结果之一。因此,需要更可重复和一致应用的方法来产生颅窗,以及严格应用的方法来评估颅窗钻孔对下层神经组织的影响。
本研究的重点是确定和开发一致和安全的颅窗钻孔方法。用于颅窗安装的开颅术的尺寸明显大于用于脑植入微电极的标准开颅术。当使用标准设备时,这种开颅手术不能用单个毛刺孔完成,因此在手动进行时引入了更多的外科医生间技术差异20。外科钻孔机器人已引入现场,但尚未得到广泛采用1、6、29。钻井自动化提供了对变量的控制,这些变量有助于观察到试验间的变化,这表明使用该设备可以减少外科医生之间和外科医生内的影响。考虑到颅窗放置所需的较大开颅术的额外难度,这一点特别令人感兴趣。虽然人们可以假设自动化钻井所提供的控制有明显的好处,但对这些设备的实施几乎没有评估。虽然尚未观察到可见病变5,但需要使用EB进行更高的敏感性测试。
在这里,BBB渗透率是使用带有相应软件的市售外科钻孔机器人测量的,该软件允许对立体定位坐标,开颅规划/映射以及选择钻孔类型(“逐点”与“水平”)进行编程,参考钻头的布线路径。最初,钻八个“种子”点(图1A),勾勒出颅窗。从这里开始,使用“逐点”或“水平”钻孔方法切割种子之间的空间。“逐点”执行垂直导向孔切割(类似于CNC钻床),而“水平”沿轮廓孔的颅窗圆周执行水平切割(类似于CNC路由器)。这两种方法的结果都是一块头骨,可以移除以露出颅窗。为了隔离钻孔造成的损坏,不会物理移除颅窗,以避免任何额外的损坏。EB染料与荧光成像相结合的组合用于测量小鼠进行开颅后的BBB渗透性,插入的热电偶用于在钻孔过程中直接测量脑表面的温度(图1B,C)。先前的观察表明,间隔2秒的脉冲钻孔开/关足以减轻钻孔加热25,因此被纳入手术机器人的实验方法。
所介绍的工作的目的是演示评估开颅钻孔热损伤的方法。虽然这些方法是在自动钻井的背景下提出的,但这些方法也可以应用于手动钻井方案。这些方法可用于在采用作为标准程序之前验证设备和/或钻井方案的使用。
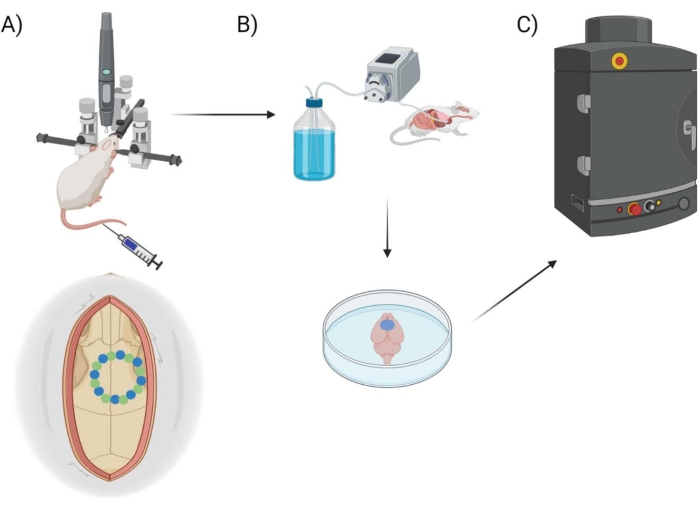
图 1:实验管道原理图。示意图显示了动物在颅窗手术后接受EB定量的过程。(A)带有立体定位框架和手术机器人钻头的鼠标的示意图设置。一个示例颅窗显示在运动皮层上,带有种子点(绿色)和边缘点(蓝色)。(B)灌注装置包括在整个动物体内注射1x磷酸盐缓冲盐水(PBS)以去除任何血液,然后提取大脑。(C)然后将大脑放入EB荧光成像系统室,对埃文斯蓝染料进行荧光成像。请点击此处查看此图的大图。
Protocol
Representative Results
Discussion
EB染料和成像的使用简单,快速且可用于评估大脑中的血管损伤,以获取新的方法和技术。无论是使用手术机器人还是确认目前在实验室中完成的方法,验证手术方法以隔离实验性治疗与手术影响的效果并改善动物福利非常重要。热电偶设置在评估钻孔方法以确保不会发生加热时也很有用。已知由于骨钻孔引起的温度升高会导致组织损伤,即使升高5°C也足以导致大脑中的大血管损伤32,<sup class="xr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项研究得到了优异评论奖GRANT12418820(Capadona)和GRANTI01RX003420(Shoffstall / Capadona)以及美国退伍军人事务部康复研究与发展服务的研究职业科学家奖#GRANT12635707(Capadona)的部分支持。此外,这项工作还得到了美国国立卫生研究院,国家神经疾病和中风研究所GRANT12635723(Capadona)和国家生物医学成像和生物工程研究所T32EB004314(Capadona/Kirsch)的部分支持。本材料基于美国国家科学基金会研究生研究奖学金支持的工作,资助号为GRANT12635723。本材料中表达的任何意见、发现、结论或建议均为作者的观点,不一定反映美国国家科学基金会的观点。
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

