Évaluation des dommages thermiques causés par la craniotomie robotisée pour la chirurgie de la fenêtre crânienne chez la souris
Summary
Les fenêtres crâniennes sont devenues une technique chirurgicale omniprésente pour permettre l’imagerie intravitale chez les souris transgéniques. Ce protocole décrit l’utilisation d’un robot chirurgical qui effectue un forage osseux semi-automatisé des fenêtres crâniennes et peut aider à réduire la variabilité d’un chirurgien à l’autre et à atténuer partiellement les dommages thermiques de la barrière hémato-encéphalique.
Abstract
La chirurgie de la fenêtre crânienne permet l’imagerie du tissu cérébral chez des souris vivantes avec l’utilisation de multiphotons ou d’autres techniques d’imagerie intravitale. Cependant, lors de la réalisation d’une craniotomie à la main, il y a souvent des dommages thermiques au tissu cérébral, ce qui est intrinsèquement variable d’une chirurgie à l’autre et peut dépendre de la technique individuelle du chirurgien. La mise en œuvre d’un robot chirurgical peut normaliser la chirurgie et entraîner une diminution des dommages thermiques associés à la chirurgie. Dans cette étude, trois méthodes de forage robotisé ont été testées pour évaluer les dommages thermiques: horizontale, point par point et pulsée point par point. Le forage horizontal utilise un schéma de forage continu, tandis que le forage point par point perce plusieurs trous englobant la fenêtre crânienne. Le point par point pulsé ajoute un schéma de forage « 2 s sur, 2 s off » pour permettre le refroidissement entre les forages. L’imagerie fluorescente du colorant Evans Blue (EB) injecté par voie intraveineuse mesure les dommages aux tissus cérébraux, tandis qu’un thermocouple placé sous le site de forage mesure les dommages thermiques. Les résultats des thermocouples indiquent une diminution significative du changement de température dans le groupe pulsé point par point (6,90 °C ± 1,35 °C) par rapport aux groupes horizontal (16,66 °C ± 2,08 °C) et point par point (18,69 °C ± 1,75 °C). De même, le groupe pulsé point par point a également montré significativement moins de présence d’EB après le perçage de fenêtres crâniennes par rapport à la méthode horizontale, indiquant moins de dommages aux vaisseaux sanguins dans le cerveau. Ainsi, une méthode de forage point par point pulsé semble être le schéma optimal pour réduire les dommages thermiques. Une perceuse robotisée est un outil utile pour aider à minimiser la formation, la variabilité et à réduire les dommages thermiques. Avec l’utilisation croissante de l’imagerie multiphotonique dans les laboratoires de recherche, il est important d’améliorer la rigueur et la reproductibilité des résultats. Les méthodes abordées ici aideront à informer les autres sur la façon de mieux utiliser ces robots chirurgicaux pour faire progresser le domaine.
Introduction
Les fenêtres crâniennes sont devenues omniprésentes dans les domaines des neurosciences, de l’ingénierie neuronale et de la biologie pour permettre la visualisation directe et l’imagerie du cortex chez les animaux vivants 1,2,3,4,5,6,7,8,9,10,11 . La puissante combinaison de souris transgéniques et d’imagerie multiphotonique a fourni des informations extrêmement précieuses sur l’activité des circuits et d’autres connaissances biologiques dans le cerveau in vivo 12,13,14,15,16,17,18. Les microscopes miniatures montés sur le crâne ont encore étendu ces capacités pour permettre des enregistrements chez des animaux éveillés et en mouvement libre19. Le processus de création d’une fenêtre crânienne nécessite un forage électrique pour amincir ou enlever complètement l’os crânien afin de produire des craniotomies suffisamment grandes pour fixer un morceau de verre transparent sur le cortex20. Le polydiméthylsiloxane (PDMS) et d’autres polymères ont également été testés comme matériaux de fenêtre crânienne 9,21. En fin de compte, la fenêtre crânienne idéale est celle qui n’altère pas ou n’interfère pas avec l’activité endogène normale en dessous. Cependant, il est communément admis que le perçage de fenêtres crâniennes aggrave les tissus sous-jacents, entraînant des dommages au cerveau, une perturbation de l’environnement et des méninges affectant au point d’obstruer la profondeur d’imagerie multiphotonique22. La neuroinflammation qui en résulte a un large éventail d’effets allant de la perméabilité de la barrière hémato-encéphalique (BHE) à l’activation et au recrutement des cellules gliales autour du site implantaire23. Par conséquent, la caractérisation de méthodes de perçage de fenêtres crâniennes plus sûres et plus reproductibles est cruciale pour une qualité d’imagerie constante et la réduction des facteurs de confusion.
Bien que l’on prenne soin de minimiser les traumatismes au tissu sous-jacent, le fait de percer l’os peut causer des perturbations thermiques et mécaniques au cerveau24,25. Un traumatisme mécanique résultant d’une pénétration accidentelle de perceuse dans la dure-mère peut en outre induire divers degrés de lésions corticales24. Dans une étude de Shoffstall et coll.25, la chaleur du forage osseux a entraîné une augmentation de la perméabilité de la BHE, comme l’indique la présence de colorant bleu Evans (EB) dans le parenchyme cérébral 25. Le colorant EB, injecté par voie intraveineuse, se lie à l’albumine circulante dans la circulation sanguine et ne traverse donc normalement pas une BHE saine à des concentrations appréciables. En conséquence, le colorant EB est couramment utilisé comme marqueur sensible de la perméabilité BBB26,27. Bien que leur étude n’ait pas mesuré directement l’impact de la perméabilité de la BHE sur les séquelles biologiques ultérieures à l’étude, des études antérieures ont corrélé la perméabilité de la BHE à une réponse neuroinflammatoire accrue aux microélectrodes implantées de façon chronique et à des altérations de la fonction motrice28.
Selon les objectifs de l’étude, l’ampleur des dommages thermiques et mécaniques peut contribuer à une source d’erreur expérimentale, affectant négativement la rigueur et la reproductibilité de l’étude. Il existe des dizaines de méthodes citées pour produire des fenêtres crâniennes, chacune utilisant un équipement de forage, des vitesses, des techniques et des utilisateursdifférents 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et coll.25 ont signalé que la variation observée dans les résultats de chauffage était attribuée à la variabilité de la force appliquée, de la vitesse d’avance et de l’angle d’application de la foreuse, entre autres aspects qui ne peuvent être contrôlés lors du forage manuel 25. On croit que les systèmes de forage automatisés et d’autres équipements stéréotaxiques peuvent améliorer la reproductibilité et la cohérence des résultats, mais les études de méthodes publiées n’ont pas rigoureusement évalué la température ou la perméabilité BBB comme l’un des résultats. Par conséquent, il est nécessaire de disposer de méthodes plus reproductibles et appliquées de manière cohérente pour produire des fenêtres crâniennes, ainsi que de méthodes rigoureusement appliquées pour évaluer l’impact du forage de fenêtres crâniennes sur le tissu neural sous-jacent.
L’objectif de cette étude est de déterminer et de développer des méthodes de forage cohérentes et sécuritaires pour les fenêtres crâniennes. La taille de la craniotomie pour l’installation de fenêtres crâniennes est significativement plus grande que les craniotomies standard pour les microélectrodes implantées dans le cerveau. De telles craniotomies ne peuvent pas être complétées avec un seul trou de bavure lors de l’utilisation d’un équipement standard, introduisant ainsi une plus grande variabilité technique inter-chirurgienne lorsqu’elles sont effectuées à la main20. Des robots de forage chirurgical ont été introduits sur le terrain, mais n’ont pas été largement adoptés 1,6,29. L’automatisation du forage offre un contrôle sur les variables contribuant à la variation observée d’un essai à l’autre, ce qui suggère que l’utilisation de l’équipement peut réduire les effets inter- et intra-chirurgiens. Ceci est particulièrement intéressant étant donné la difficulté supplémentaire de la craniotomie plus grande nécessaire pour la mise en place de la fenêtre crânienne. Bien que l’on puisse supposer que le contrôle fourni par l’automatisation du forage présente des avantages évidents, il y a eu peu d’évaluation de la mise en œuvre de ces équipements. Bien que des lésions visibles n’aient pas été observées5, le test de sensibilité plus élevé utilisant EB est souhaité.
Ici, la perméabilité BBB est mesurée à l’aide d’un robot de forage chirurgical disponible dans le commerce avec le logiciel correspondant, qui permet la programmation de coordonnées stéréotaxiques, la planification / cartographie de la craniotomie et une sélection de styles de forage (« point par point » vs « horizontal »), se référant à la trajectoire acheminée du foret. Initialement, huit points « de départ » sont forés (Figure 1A), décrivant la fenêtre crânienne. De là, l’espace entre les graines est découpé à l’aide de la méthode de forage « point par point » ou « horizontale ». « Point par point » effectue des coupes de trous pilotes verticaux (similaires à une perceuse CNC), tandis que « horizontal » effectue des coupes horizontales le long de la circonférence de la fenêtre crânienne qui délimite le trou (similaire à une routeur CNC). Le résultat pour les deux méthodes est un morceau de crâne qui peut être enlevé pour révéler la fenêtre crânienne. Pour isoler les dommages causés par le forage, la fenêtre crânienne n’est pas physiquement retirée, afin d’éviter tout dommage supplémentaire. Une combinaison de colorant EB couplée à une imagerie fluorescente est utilisée pour mesurer la perméabilité de la BHE après avoir effectué des craniotomies chez la souris, et un thermocouple inséré est utilisé pour mesurer directement la température de la surface du cerveau pendant le forage (Figure 1B, C). Des observations antérieures ont indiqué que le forage pulsé marche/arrêt avec des intervalles de 2 s était suffisant pour atténuer le chauffage du forage25, et est donc incorporé dans l’approche expérimentale pour le robot chirurgical.
L’objectif du travail présenté est de démontrer les méthodes d’évaluation des dommages thermiques causés par le forage de craniotomie. Bien que les méthodes soient présentées dans le contexte du forage automatisé, ces méthodes peuvent également être appliquées aux schémas de forage manuel. Ces méthodes peuvent être utilisées pour valider l’utilisation d’équipements et/ou de schémas de forage avant de les adopter comme procédure standard.
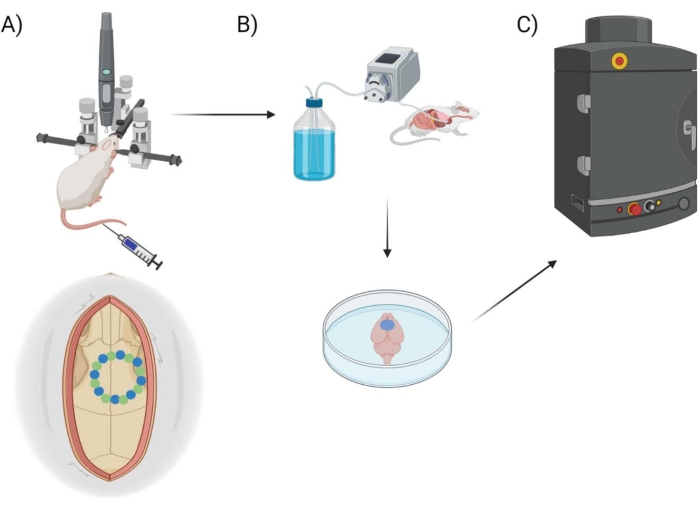
Figure 1 : Schéma du pipeline expérimental. Schéma montrant le procédé que les animaux ont subi pour la quantification EB de la procédure de fenêtre post-crânienne. (A) Configuration schématique de la souris avec le cadre stéréotaxique et la perceuse robot chirurgicale. Un exemple de fenêtre crânienne est montré au-dessus du cortex moteur avec des points de départ (vert) et des points de bord (bleu). (B) La configuration de perfusion comprend l’injection de 1x solution saline tamponnée au phosphate (PBS) dans tout l’animal pour éliminer tout sang, suivie d’une extraction du cerveau. (C) Le cerveau est ensuite placé dans la chambre du système d’imagerie fluorescente EB pour effectuer l’imagerie fluorescente sur le colorant bleu Evans. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
L’utilisation du colorant EB et de l’imagerie est simple, rapide et utile pour évaluer les dommages vasculaires dans le cerveau pour de nouvelles méthodes et techniques. Qu’il s’agisse d’utiliser un robot chirurgical ou de confirmer les méthodes actuellement utilisées en laboratoire, il est important de valider les méthodes chirurgicales pour isoler les effets des traitements expérimentaux par rapport à l’impact chirurgical et améliorer le bien-être animal. Une configuration de thermocouple est égal…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette étude a été financée en partie par les bourses d’évaluation du mérite GRANT12418820 (Capadona) et GRANTI01RX003420 (Shoffstall/Capadona), et la bourse de carrière scientifique de recherche # GRANT12635707 (Capadona) du Service de recherche et de développement en réadaptation du ministère des Anciens Combattants des États-Unis. De plus, ce travail a également été soutenu en partie par le National Institute of Health, le National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona) et le National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona/Kirsch). Ce matériel est basé sur des travaux soutenus par la National Science Foundation Graduate Research Fellowship sous le numéro de subvention GRANT12635723. Toute opinion, constatation, conclusion ou recommandation exprimée dans ce document est celle de l’auteur (s) et ne reflète pas nécessairement les points de vue de la National Science Foundation.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

