Beoordeling van thermische schade door robotgeboorde craniotomie voor craniale raamchirurgie bij muizen
Summary
Craniale vensters zijn een alomtegenwoordig geïmplementeerde chirurgische techniek geworden om intravitale beeldvorming bij transgene muizen mogelijk te maken. Dit protocol beschrijft het gebruik van een chirurgische robot die semi-geautomatiseerde botboringen van schedelvensters uitvoert en kan helpen de variabiliteit van chirurg tot chirurg te verminderen en thermische schade aan de bloed-hersenbarrière gedeeltelijk te verminderen.
Abstract
Craniale raamchirurgie maakt het mogelijk om hersenweefsel in levende muizen in beeld te brengen met behulp van multifotonen of andere intravitale beeldvormingstechnieken. Bij het uitvoeren van een craniotomie met de hand is er echter vaak thermische schade aan hersenweefsel, wat inherent variabel is van chirurgie tot operatie en afhankelijk kan zijn van de individuele chirurgtechniek. Het implementeren van een chirurgische robot kan de operatie standaardiseren en leiden tot een afname van thermische schade in verband met chirurgie. In deze studie werden drie methoden van robotboren getest om thermische schade te evalueren: horizontaal, punt voor punt en puntsgepulseerd punt voor punt. Horizontaal boren maakt gebruik van een continu boorschema, terwijl puntsgewijs verschillende gaten worden geboord die het schedelvenster omvatten. Gepulseerd puntsgewijs voegt een “2 s aan, 2 s uit” boorschema toe om koeling tussen het boren mogelijk te maken. Fluorescerende beeldvorming van Evans Blue (EB) kleurstof die intraveneus wordt geïnjecteerd, meet schade aan hersenweefsel, terwijl een thermokoppel dat onder de boorlocatie is geplaatst thermische schade meet. De resultaten van het thermokoppel wijzen op een significante afname van de temperatuurverandering in de gepulste punt-voor-punt (6,90 °C ± 1,35 °C) groep in vergelijking met de horizontale (16,66 °C ± 2,08 °C) en punt-voor-punt (18,69 °C ± 1,75 °C) groepen. Evenzo vertoonde de gepulseerde puntsgewijze groep ook significant minder EB-aanwezigheid na craniale raamboringen in vergelijking met de horizontale methode, wat wijst op minder schade aan bloedvaten in de hersenen. Een gepulseerde punt-voor-punt boormethode lijkt dus het optimale schema om thermische schade te verminderen. Een robotboor is een handig hulpmiddel om training, variabiliteit en thermische schade te minimaliseren. Met het toenemende gebruik van multifotonbeeldvorming in onderzoekslaboratoria is het belangrijk om de nauwkeurigheid en reproduceerbaarheid van resultaten te verbeteren. De methoden die hier worden behandeld, zullen anderen helpen informeren over hoe deze chirurgische robots beter kunnen worden gebruikt om het veld verder te ontwikkelen.
Introduction
Craniale vensters zijn alomtegenwoordig geworden op het gebied van neurowetenschappen, neurale engineering en biologie om directe visualisatie en beeldvorming van de cortex bij levende dieren mogelijk te maken 1,2,3,4,5,6,7,8,9,10,11 . De krachtige combinatie van transgene muizen en multifotonenbeeldvorming heeft uiterst waardevolle inzichten opgeleverd in circuitactiviteit en andere biologische inzichten in de in vivo hersenen 12,13,14,15,16,17,18. Miniatuurmicroscopen die op de schedel zijn gemonteerd, hebben deze mogelijkheden verder uitgebreid om opnames mogelijk te maken bij wakkere, vrij bewegende dieren19. Het proces van het maken van een schedelvenster vereist krachtboren om het schedelbot te verdunnen of volledig te verwijderen om voldoende grote craniotomieën te produceren om een transparant stuk glas over de cortex20 te bevestigen. Polydimethylsiloxaan (PDMS) en andere polymeren zijn ook getest als craniale raammaterialen 9,21. Uiteindelijk is het ideale schedelvenster er een die de normale endogene activiteit eronder niet verandert of verstoort. Het is echter algemeen aanvaard dat craniale raamboringen het onderliggende weefsel verergeren, wat leidt tot schade aan de hersenen, verstoring van de omgeving en het beïnvloeden van hersenvliezen tot het punt van het afsluiten van multifotonbeelddiepte22. De resulterende neuro-inflammatie heeft een breed scala aan effecten, variërend van permeabiliteit van de bloed-hersenbarrière (BBB) tot activering en rekrutering van gliacellen rond de implantaatplaats23. Daarom is het karakteriseren van veiligere en meer reproduceerbare craniale raamboormethoden cruciaal voor een consistente beeldkwaliteit en het verminderen van verstorende factoren.
Hoewel er zorg wordt besteed aan het minimaliseren van trauma aan het onderliggende weefsel, heeft de handeling van het boren van het bot het potentieel om zowel thermische als mechanische verstoringen van de hersenen te veroorzaken24,25. Mechanisch trauma door toevallige boorpenetratie in de dura kan verder verschillende gradaties van corticale schade veroorzaken24. In een studie van Shoffstall et al.25 resulteerde de hitte van botboringen in een verhoogde BBB-permeabiliteit, zoals aangegeven door de aanwezigheid van Evans Blue (EB) kleurstof in het hersenparenchym25. EB-kleurstof, intraveneus geïnjecteerd, bindt zich aan circulerend albumine in de bloedbaan en passeert daarom normaal gesproken geen gezonde BBB in merkbare concentraties. Als gevolg hiervan wordt EB-kleurstof vaak gebruikt als een gevoelige marker van BBB-permeabiliteit26,27. Hoewel hun studie niet direct de impact van de BBB-permeabiliteit op de daaropvolgende biologische sequelae in studie heeft gemeten, hebben eerdere studies BBB-permeabiliteit gecorreleerd aan een verhoogde neuro-inflammatoire respons op chronisch geïmplanteerde micro-elektroden en veranderingen in de motorische functie28.
Afhankelijk van de doelstellingen van het onderzoek kan de omvang van thermische en mechanische schade bijdragen aan een bron van experimentele fouten, die de strengheid en reproduceerbaarheid van het onderzoek negatief beïnvloeden. Er zijn tientallen aangehaalde methoden voor het produceren van schedelramen, elk met behulp van verschillende boorapparatuur, snelheden, technieken en gebruikers 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 rapporteerden dat de waargenomen variatie in de verwarmingsresultaten werd toegeschreven aan variabiliteit in de uitgeoefende kracht, toevoersnelheid en toepassingshoek van de boor, naast andere aspecten die niet kunnen worden gecontroleerd bij het boren met de hand 25. Er is een overtuiging dat geautomatiseerde boorsystemen en andere stereotaxische apparatuur de reproduceerbaarheid en uitkomstconsistentie kunnen verbeteren, maar gepubliceerde methodestudies hebben de temperatuur of BBB-permeabiliteit niet rigoureus geëvalueerd als een van de uitkomsten. Daarom is er behoefte aan meer reproduceerbare en consistent toegepaste methoden om schedelvensters te produceren, evenals methoden die rigoureus worden toegepast om de impact van craniale raamboringen op onderliggend neuraal weefsel te beoordelen.
De focus van deze studie ligt op het bepalen en ontwikkelen van consistente en veilige boormethoden voor schedelramen. De grootte van de craniotomie voor craniale raaminstallatie is aanzienlijk groter dan standaard craniotomieën voor hersengeïmplanteerde micro-elektroden. Dergelijke craniotomieën kunnen niet worden voltooid met een enkel braamgat bij gebruik van standaardapparatuur, waardoor meer inter-chirurgentechniek variabiliteit wordt geïntroduceerd wanneer ze met de hand worden uitgevoerd20. Chirurgische boorrobots zijn geïntroduceerd in het veld, maar zijn niet op grote schaal toegepast 1,6,29. Automatisering van boren biedt controle over variabelen die bijdragen aan waargenomen trial-to-trial variatie, wat suggereert dat het gebruik van de apparatuur inter- en intra-chirurgeneffecten kan verminderen. Dit is van bijzonder belang gezien de extra moeilijkheid van de grotere craniotomie die nodig is voor het plaatsen van schedelvensters. Hoewel men zou kunnen aannemen dat er duidelijke voordelen zijn voor de controle die wordt geboden door het automatiseren van het boren, is er weinig beoordeling geweest van de implementatie van deze apparatuur. Hoewel er geen zichtbare laesies zijn waargenomen5, is de hogere gevoeligheidstest met EB gewenst.
Hier wordt de BBB-permeabiliteit gemeten met behulp van een in de handel verkrijgbare chirurgische boorrobot met bijbehorende software, die het mogelijk maakt om stereotaxische coördinaten, craniotomieplanning / mapping en een selectie van boorstijlen (“puntsgewijs” versus “horizontaal”) te programmeren, verwijzend naar het gerouteerde pad van de boor. In eerste instantie worden acht “zaad” -punten geboord (figuur 1A), die het schedelvenster schetsen. Vanaf hier wordt de ruimte tussen de zaden uitgesneden met behulp van de “punt-voor-punt” of “horizontale” boormethode. “Point-by-point” voert verticale pilot hole cuts uit (vergelijkbaar met een CNC-boorpers), terwijl “horizontaal” horizontale sneden uitvoert langs de omtrek van het schedelvenster dat het gat omlijnt (vergelijkbaar met een CNC-router). Het resultaat voor beide methoden is een stuk schedel dat kan worden verwijderd om het schedelvenster te onthullen. Om schade door boren te isoleren, wordt het schedelvenster niet fysiek verwijderd, om extra schade te voorkomen. Een combinatie van EB-kleurstof in combinatie met fluorescerende beeldvorming wordt gebruikt om BBB-permeabiliteit te meten na het uitvoeren van craniotomieën bij muizen, en een ingebracht thermokoppel wordt gebruikt om de temperatuur van het hersenoppervlak tijdens het boren direct te meten (figuur 1B, C). Eerdere waarnemingen gaven aan dat gepulseerd boren aan/uit met 2 s intervallen voldoende was om boorverwarming25 te verminderen, en daarom is opgenomen in de experimentele aanpak voor de chirurgische robot.
De bedoeling van het gepresenteerde werk is om methoden te demonstreren voor het beoordelen van thermische schade door craniotomieboringen. Hoewel de methoden worden gepresenteerd in de context van geautomatiseerd boren, kunnen dergelijke methoden ook worden toegepast op handmatige boorschema’s. Deze methoden kunnen worden gebruikt om het gebruik van apparatuur en/of boorschema’s te valideren voordat ze als standaardprocedure worden aangenomen.
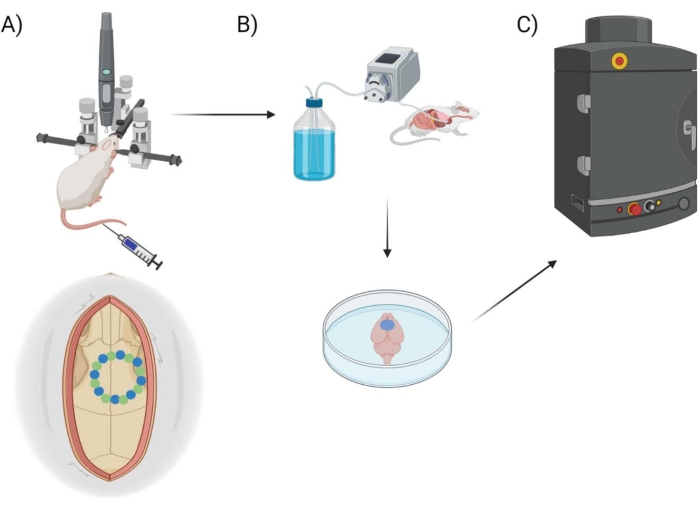
Figuur 1: Experimenteel pijplijnschema. Schematisch aantonen van het proces dat dieren ondergingen voor EB-kwantificering na de craniale vensterprocedure. (A) Schematische opstelling van de muis met het stereotaxische frame en de chirurgische robotboor. Een voorbeeld van een schedelvenster wordt getoond over de motorische cortex met zaadpunten (groen) en randpunten (blauw). (B) De perfusie-opstelling omvat het injecteren van 1x fosfaat gebufferde zoutoplossing (PBS) door het hele dier om bloed te verwijderen, gevolgd door extractie van de hersenen. (C) De hersenen worden vervolgens in de EB fluorescerende beeldvormingssysteemkamer geplaatst om fluorescerende beeldvorming op de Evans Blue-kleurstof uit te voeren. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het gebruik van EB-kleurstof en beeldvorming is eenvoudig, snel en nuttig voor het evalueren van vasculaire schade in de hersenen voor nieuwe methoden en technieken. Of het nu gaat om het gebruik van een chirurgische robot of het bevestigen van methoden die momenteel in het laboratorium worden gedaan, het is belangrijk om chirurgische methoden te valideren om de effecten van experimentele behandelingen versus chirurgische impact te isoleren en het dierenwelzijn te verbeteren. Een thermokoppelopstelling is ook nuttig bij …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Deze studie werd gedeeltelijk ondersteund door Merit Review Awards GRANT12418820 (Capadona) en GRANTI01RX003420 (Shoffstall / Capadona), en Research Career Scientist Award # GRANT12635707 (Capadona) van het United States (US) Department of Veterans Affairs Rehabilitation Research and Development Service. Daarnaast werd dit werk ook gedeeltelijk ondersteund door het National Institute of Health, het National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona) en het National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona / Kirsch). Dit materiaal is gebaseerd op werk dat wordt ondersteund door de National Science Foundation Graduate Research Fellowship onder Grant No. GRANT12635723. Alle meningen, bevindingen en conclusies of aanbevelingen in dit materiaal zijn die van de auteur(s) en weerspiegelen niet noodzakelijkerwijs de standpunten van de National Science Foundation.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

