Modelagem de Metástases Cerebrais por Injeção de Células Cancerígenas na Artéria Carótida Interna
Summary
A metástase cerebral é uma causa de morbidade e mortalidade graves em pacientes com câncer. A maioria dos modelos de camundongos com metástases cerebrais é complicada por metástases sistêmicas que confundem a análise da mortalidade e os resultados da intervenção terapêutica. Apresenta-se aqui um protocolo para injeção carotídea interna de células cancerígenas que produz tumores intracranianos consistentes com tumores sistêmicos mínimos.
Abstract
A metástase cerebral é uma causa de morbidade e mortalidade graves em pacientes com câncer. Aspectos críticos de doenças metastáticas, como o complexo microambiente neural e a interação de células estromais, não podem ser inteiramente replicados com ensaios in vitro ; assim, os modelos animais são fundamentais para investigar e compreender os efeitos da intervenção terapêutica. No entanto, a maioria dos métodos de xenoenxertia de tumores cerebrais não produz metástases cerebrais consistentemente em termos de período de tempo e carga tumoral. Modelos de metástases cerebrais gerados pela injeção intracardíaca de células cancerígenas podem resultar em carga tumoral extracraniana não intencional e levar à morbidade e mortalidade metastática não cerebral. Embora a injeção intracraniana de células cancerígenas possa limitar a formação de tumores extracranianos, ela tem várias ressalvas, como as células injetadas frequentemente formam uma massa tumoral singular no local da injeção, alto envolvimento leptomeníngeo e danos à vasculatura cerebral durante a penetração da agulha. Este protocolo descreve um modelo de rato de metástase cerebral gerada pela injeção da artéria carótida interna. Este método produz tumores intracranianos de forma consistente sem o envolvimento de outros órgãos, possibilitando a avaliação de agentes terapêuticos para metástases cerebrais.
Introduction
A metástase cerebral é uma neoplasia maligna prevalente associada a um prognóstico muito ruim 1,2. O padrão de atendimento para pacientes com metástases cerebrais é multimodal, consistindo em neurocirurgia, radioterapia de todo o cérebro e/ou radiocirurgia estereotáxica, dependendo do estado geral de saúde dos pacientes, da carga de doença extracraniana e do número e localização de tumores no cérebro 3,4. Pacientes com até três lesões intracranianas são elegíveis para ressecção cirúrgica ou radiocirurgia estereotáxica, enquanto a radioterapia de todo o cérebro é recomendada para pacientes com lesões múltiplas para evitar o risco de infecção e edema relacionados à cirurgia5. No entanto, a radioterapia de todo o cérebro pode infligir danos às estruturas cerebrais radiossensíveis, contribuindo para a má qualidade de vida6.
A terapia sistêmica é uma alternativa não invasiva e uma abordagem lógica para o tratamento de pacientes com lesões múltiplas7. No entanto, é menos considerado devido à noção de longa data de que as terapias sistêmicas têm baixa eficácia, pois a entrega passiva de drogas citotóxicas através da corrente sanguínea não pode atingir níveis terapêuticos no cérebro sem o risco de toxicidade insegura8. Esse paradigma está começando a mudar com a terapia sistêmica recentemente aprovada pela Food and Drug Administration (FDA) dos EUA (tucatinibe com trastuzumabe e capecitabina, indicada para metástase cerebral metastática com câncer de mama HER2+)9,10,11,12 e a atualização nas diretrizes de tratamento para incluir a consideração de opções de terapia sistêmica para pacientes com metástase cerebral 13,14.
Nesse contexto, os desenvolvimentos no campo da terapia molecular direcionada, imunoterapia e sistemas alternativos de liberação de medicamentos, como um portador de nanofármacos direcionado, podem potencialmente superar os desafios do tratamento de metástases cerebrais15,16,17,18. Além disso, abordagens químicas e mecânicas para melhorar a administração de fármacos via permeabilização da barreira crânio-tumoral também estão sendo investigadas19,20. Para estudar e otimizar tais abordagens para serem adequadas ao propósito, é crucial usar modelos pré-clínicos que não apenas espelhem a complexa fisiologia da metástase cerebral, mas também permitam a análise objetiva da resposta intracraniana a medicamentos.
Em termos gerais, as abordagens atuais para modelar metástases cerebrais in vivo envolvem injeção intracardíaca (ventrículo esquerdo), intravenosa (geralmente veia da cauda), intracraniana ou intracarótida (artéria carótida comum) de células cancerígenas em camundongos 21,22,23,24,25,26,27 . Além das estratégias de enxerto tumoral, modelos de camundongos geneticamente modificados em que a formação de tumores é desencadeada pela remoção de genes supressores de tumor ou ativação de oncogenes são úteis para a modelagem tumoral. No entanto, apenas alguns modelos de camundongos geneticamente modificados são relatados para produzir tumores secundários e ainda menos que produzem de forma confiável metástases cerebrais28,29,30.
Métodos de enxerto como injeção intracardíaca (ventrículo esquerdo) e intravenosa (geralmente veia da cauda) imitam a disseminação sistêmica do câncer. Esses modelos normalmente produzem lesões em múltiplos órgãos (por exemplo, cérebro, pulmões, fígado, rins, baço), dependendo do leito capilar que retém a maioria das células tumorais durante sua “primeira passagem” circulatória31. No entanto, taxas inconsistentes de enxerto cerebral exigirão mais animais para atingir o tamanho da amostra para o poder estatístico desejado. O número de células tumorais que eventualmente se estabelecem no cérebro através desses métodos de injeção intracardíaca e intravenosa é variável. Assim, a carga tumoral de metástase cerebral pode variar entre os animais e a diferença na progressão pode tornar a padronização da linha do tempo experimental e a interpretação dos resultados um desafio. A carga tumoral extracraniana pode levar à mortalidade por metástases não cerebrais, tornando esses modelos inadequados para avaliar a eficácia intracraniana. Linhagens celulares cérebro-trópicas têm sido estabelecidas usando processos de seleção clonal artificial para reduzir o estabelecimento extracraniano, mas as taxas de tomada têm sido inconsistentes, e o processo de seleção clonal pode reduzir a heterogeneidade normalmente encontrada em tumores humanos32.
Métodos de enxerto específicos do cérebro, como a injeção intracraniana e intracarótida, permitem uma modelagem de metástases cerebrais mais consistente e eficiente. No método intracraniano33, as células cancerosas são tipicamente injetadas no córtex cerebral frontal, o que gera crescimento tumoral rápido e reprodutível com baixo envolvimento sistêmico. Embora o procedimento seja bem tolerado com baixa mortalidade33, as ressalvas são de que é uma abordagem relativamente grosseira que introduz rapidamente um bolo (localizado) de células no cérebro e não modela a patogênese precoce da metástase cerebral. A agulha danifica a vasculatura do tecido cerebral, o que causa inflamação localizada 5,34. Por experiência, há uma tendência de células tumorais injetadas para refluxo durante a remoção da agulha, levando ao envolvimento leptomeníngeo. Alternativamente, o método intracarotídeo entrega células na artéria carótida comum com microvasculatura cerebral como o primeiro leito capilar a ser encontrado, modelando a sobrevivência na circulação, extravasamento e colonização24. Concordando com outros25, nossa experiência com esse método constatou que ele pode resultar em tumores faciais devido à entrega não intencional de células cancerígenas através da artéria carótida externa para leitos capilares nesses tecidos (dados não publicados). É possível prevenir tumores faciais ligando primeiro a artéria carótida externa antes da injeção da artéria carótida comum (Figura 1). No resto do artigo, este método é referido como a “injeção interna da artéria carótida”. A partir da experiência, o método de injeção da artéria carótida interna gera consistentemente metástases cerebrais com muito poucos eventos sistêmicos e tem sido bem-sucedido na geração de modelos de metástases cerebrais de diferentes cânceres primários (por exemplo, melanoma, mama e câncer de pulmão) (Figura 1). As desvantagens são que é tecnicamente desafiador, demorado, invasivo e requer otimização cuidadosa do número de células e um cronograma de monitoramento. Em resumo, os métodos de injeção intracraniana e interna da artéria carótida produzem modelos de camundongos adequados para avaliar o impacto terapêutico no benefício de sobrevida relacionado ao tumor cerebral.
Este protocolo descreve o método de injeção da artéria carótida interna para produzir um modelo de metástase cerebral em camundongo com quase nenhum envolvimento sistêmico e, portanto, adequado para avaliação pré-clínica da distribuição de medicamentos e eficácia da terapêutica experimental.
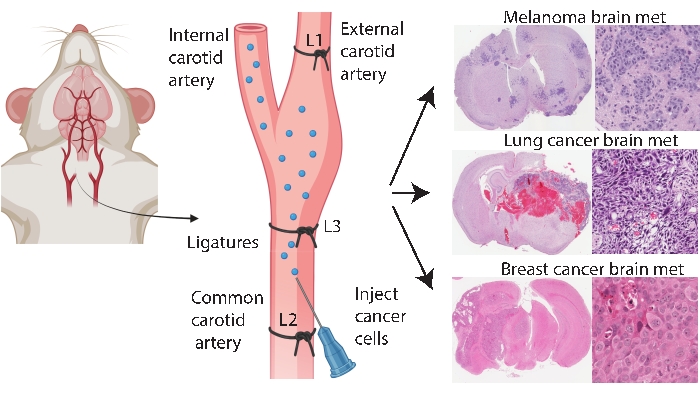
Figura 1: Representação esquemática do protocolo de injeção da artéria carótida interna para metástase cerebral. A injeção interna da artéria carótida com ligadura externa da artéria carótida pode produzir de forma confiável um modelo de metástase cerebral de vários cânceres primários. Neste protocolo, três ligaduras são colocadas na artéria carótida (anotadas como L1-L3 na figura). Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A metástase cerebral é um processo complexo de células cancerosas que se espalham de seu local primário para o cérebro. Diferentes modelos animais estão disponíveis que espelham certos estágios desse processo de várias etapas e há considerações fisiológicas e práticas para o desenho de estudos pré-clínicos de metástases41,42. A maioria dos estudos publicados que investigam o uso da nanomedicina para o tratamento de metástases cerebrais utilizou …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi financiada pelo Conselho Nacional Australiano de Saúde e Pesquisa Médica (NHMRC), número de concessão APP1162560. O ML foi financiado por uma bolsa de pesquisa de pós-graduação da UQ. Gostaríamos de agradecer a todos que ajudaram com a criação de animais e imagens in vivo dos animais. Agradecemos ao Royal Brisbane and Women’s Hospital por doar alíquotas de zircônio para este estudo.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

