Моделирование метастазирования в мозг путем инъекции раковых клеток во внутреннюю сонную артерию
Summary
Метастазы в мозг являются причиной тяжелой заболеваемости и смертности у онкологических больных. Большинство моделей метастазирования в мозг у мышей осложняются системными метастазами, смешивающими анализ смертности и результатов терапевтического вмешательства. Здесь представлен протокол внутренней каротидной инъекции раковых клеток, который продуцирует последовательные внутричерепные опухоли с минимальными системными опухолями.
Abstract
Метастазы в мозг являются причиной тяжелой заболеваемости и смертности у онкологических больных. Критические аспекты метастатических заболеваний, такие как сложное нервное микроокружение и взаимодействие стромальных клеток, не могут быть полностью воспроизведены с помощью анализов in vitro ; таким образом, животные модели имеют решающее значение для исследования и понимания эффектов терапевтического вмешательства. Тем не менее, большинство методов ксенотрансплантации опухолей головного мозга не производят метастазы в мозг последовательно с точки зрения временных рамок и опухолевой нагрузки. Модели метастазирования в мозг, генерируемые внутрисердечной инъекцией раковых клеток, могут привести к непреднамеренной экстракраниальной опухолевой нагрузке и привести к метастатической заболеваемости и смертности вне мозга. Хотя внутричерепная инъекция раковых клеток может ограничить образование экстракраниальной опухоли, она имеет несколько предостережений, таких как введенные клетки часто образуют единичную опухолевую массу в месте инъекции, высокое поражение лептоменингеала и повреждение сосудистой системы мозга во время проникновения иглы. Этот протокол описывает мышиную модель метастазирования в мозг, генерируемого инъекцией внутренней сонной артерии. Этот метод последовательно продуцирует внутричерепные опухоли без участия других органов, что позволяет оценить терапевтические агенты для метастазирования в мозг.
Introduction
Метастазирование в мозг является распространенным злокачественным новообразованием, связанным с очень плохим прогнозом 1,2. Стандартом лечения пациентов с метастазами в мозг является мультимодальный подход, состоящий из нейрохирургии, лучевой терапии всего мозга и / или стереотаксической радиохирургии в зависимости от общего состояния здоровья пациентов, бремени экстракраниальных заболеваний, а также количества и расположения опухолей в головном мозге 3,4. Пациенты с тремя внутричерепными поражениями имеют право на хирургическую резекцию или стереотаксическую радиохирургию, в то время как лучевая терапия всего мозга рекомендуется для пациентов с множественными поражениями, чтобы избежать риска инфекции, связанной с хирургическим вмешательством, и отека5. Однако лучевая терапия всего мозга может нанести ущерб радиочувствительным структурам мозга, способствуя низкому качеству жизни6.
Системная терапия является неинвазивным альтернативным и логическим подходом к лечению пациентов с множественными поражениями7. Тем не менее, это менее рассматривается из-за давнего представления о том, что системная терапия имеет низкую эффективность, потому что пассивная доставка цитотоксических препаратов через кровоток не может достичь терапевтических уровней в мозге без риска небезопасной токсичности8. Эта парадигма начинает меняться с недавно одобренной Управлением по контролю за продуктами и лекарствами США (FDA) системной терапией (тукатиниб с трастузумабом и капецитабином, показанным для метастатического метастазирования рака молочной железы HER2 + в мозг)9,10,11,12 и обновлением руководящих принципов лечения, чтобы включить рассмотрение вариантов системной терапии для пациентов с метастазами в мозг13,14.
В этом контексте разработки в области молекулярной таргетной терапии, иммунотерапии и альтернативных систем доставки лекарств, таких как целевой нанопрепарат, могут потенциально преодолеть проблемы лечения метастазов в мозг 15,16,17,18. Кроме того, химические и механические подходы к улучшению доставки лекарств путем пермеабилизации барьера опухоли головного мозга также исследуются19,20. Чтобы изучить и оптимизировать такие подходы, чтобы они соответствовали цели, крайне важно использовать доклинические модели, которые не только отражают сложную физиологию метастазирования в мозг, но и позволяют объективно анализировать внутричерепную реакцию на лекарства.
В целом, современные подходы к моделированию метастазирования в мозг in vivo включают внутрисердечную (левый желудочек), внутривенную (обычно хвостовую вену), внутричерепную или внутрикаротидную (общая сонная артерия) инъекцию раковых клеток у мышей 21,22,23,24,25,26,27 . Помимо стратегий приживления опухоли, генетически модифицированные мышиные модели, где образование опухоли запускается удалением генов-супрессоров опухолей или активацией онкогенов, полезны для моделирования опухолей. Тем не менее, только несколько генетически модифицированных моделей мышей, как сообщается, производят вторичные опухоли и еще меньше, которые надежно производят метастазы в мозг 28,29,30.
Методы приживления, такие как внутрисердечная (левый желудочек) и внутривенная (обычно хвостовая вена) инъекции, имитируют системную диссеминацию рака. Эти модели обычно вызывают поражения в нескольких органах (например, мозге, легких, печени, почках, селезенке) в зависимости от капиллярного русла, которое захватывает большинство опухолевых клеток во время их циркуляторного «первого прохода»31. Однако непоследовательные темпы приживления мозга потребуют большего количества животных для достижения размера выборки для желаемой статистической мощности. Количество опухолевых клеток, которые в конечном итоге устанавливаются в мозге с помощью этих внутрисердечных и внутривенных методов инъекций, варьируется. Следовательно, метастазна в мозг опухолевая нагрузка может варьироваться между животными, и разница в прогрессировании может сделать стандартизацию экспериментальной временной шкалы и интерпретацию результатов проблемой. Экстракраниальная опухолевая нагрузка может привести к смертности от метастазов вне мозга, что делает эти модели непригодными для оценки внутричерепной эффективности. Линии клеток мозг-тропики были установлены с использованием искусственных процессов клонального отбора для уменьшения экстракраниального учреждения, но показатели приема были непоследовательными, и процесс клонального отбора может уменьшить гетерогенность, обычно встречающуюся в опухолях человека32.
Специфические для мозга методы приживления, такие как внутричерепная и внутрикаротидная инъекция, позволяют более последовательно и эффективно моделировать метастазы в мозг. В внутричерепном методе33 раковые клетки обычно вводят в лобную кору головного мозга, которая генерирует быстрый и воспроизводимый рост опухоли с низким системным участием. Хотя процедура хорошо переносится с низкой смертностью33, предостережения заключаются в том, что это относительно грубый подход, который быстро вводит (локализованный) болюс клеток в мозг и не моделирует патогенез ранних метастазов в мозг. Игла повреждает сосудистую ткань мозга, что затем вызывает локализованное воспаление 5,34. По опыту, существует тенденция к инъекции опухолевых клеток к рефлюксу во время удаления иглы, что приводит к лептоменингеальному вовлечению. Альтернативно, внутрикаротидный метод доставляет клетки в общую сонную артерию с микроциркуляторным руслом мозга в качестве первого капиллярного русла, с которым можно столкнуться, моделируя выживание в циркуляции, экстравазацию и колонизацию24. В соответствии с другими25, наш опыт работы с этим методом показал, что он может привести к опухолям лица из-за непреднамеренной доставки раковых клеток через наружную сонную артерию в капиллярные ложа в этих тканях (неопубликованные данные). Предотвратить опухоли лица можно, предварительно перевязав наружную сонную артерию перед инъекцией общей сонной артерии (рисунок 1). В остальной части статьи этот метод упоминается как «инъекция внутренней сонной артерии». Исходя из опыта, метод инъекции внутренней сонной артерии последовательно генерирует метастазы в мозг с очень небольшим количеством системных событий и был успешным в создании моделей метастазирования в мозг различных первичных видов рака (например, меланомы, рака молочной железы и легких) (рисунок 1). Недостатки заключаются в том, что это технически сложно, трудоемко, инвазивно и требует тщательной оптимизации количества клеток и графика мониторинга. Таким образом, как внутричерепные, так и внутренние методы инъекций сонной артерии создают мышиные модели, подходящие для оценки терапевтического воздействия на выживаемость, связанную с опухолью головного мозга.
Этот протокол описывает метод инъекции внутренней сонной артерии для получения мышиной модели метастазирования в мозг почти без системного участия и, следовательно, подходит для доклинической оценки распределения лекарств и эффективности экспериментальных терапевтических средств.
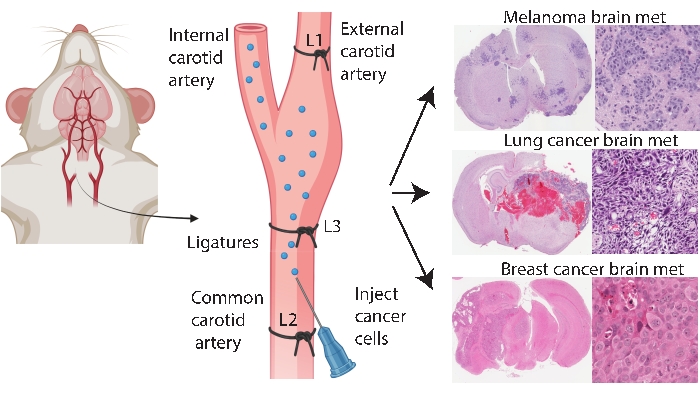
Рисунок 1: Схематическое изображение протокола инъекции внутренней сонной артерии для метастазирования в мозг. Инъекция внутренней сонной артерии с перевязкой наружной сонной артерии может надежно производить модель метастазирования в мозг от различных первичных видов рака. В этом протоколе три лигатуры помещаются на сонную артерию (на рисунке аннотируется как L1-L3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Метастазирование в мозг представляет собой сложный процесс распространения раковых клеток от их первичного участка к мозгу. Доступны различные модели на животных, которые отражают определенные этапы этого многоступенчатого процесса, и существуют физиологические и практические сооб…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование финансировалось Австралийским национальным советом по здравоохранению и медицинским исследованиям (NHMRC), номер гранта APP1162560. ML финансировался исследовательской стипендией UQ для аспирантов. Мы хотели бы поблагодарить всех, кто помогал с животноводством и визуализацией животных in vivo . Мы благодарим Королевскую брисбенскую и женскую больницу за пожертвование аликвот циркония для этого исследования.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

