Kanser Hücrelerinin İç Karotis Arter Enjeksiyonu ile Beyin Metastazının Modellenmesi
Summary
Beyin metastazı kanser hastalarında ciddi morbidite ve mortalite nedenidir. Çoğu beyin metastazı fare modeli, mortalite ve terapötik müdahale sonuçlarının kafa karıştırıcı analizini karıştıran sistemik metastazlar ile karmaşıktır. Burada, minimal sistemik tümörlerle tutarlı intrakraniyal tümörler üreten kanser hücrelerinin internal karotis enjeksiyonu için bir protokol sunulmaktadır.
Abstract
Beyin metastazı kanser hastalarında ciddi morbidite ve mortalite nedenidir. Karmaşık nöral mikroçevre ve stromal hücre etkileşimi gibi metastatik hastalıkların kritik yönleri, in vitro tahlillerle tamamen çoğaltılamaz; Bu nedenle, hayvan modelleri, terapötik müdahalenin etkilerini araştırmak ve anlamak için kritik öneme sahiptir. Bununla birlikte, çoğu beyin tümörü ksenografting yöntemi, zaman dilimi ve tümör yükü açısından tutarlı bir şekilde beyin metastazı üretmez. Kanser hücrelerinin intrakardiyak enjeksiyonu ile oluşturulan beyin metastazı modelleri, istenmeyen ekstrakraniyal tümör yüküne neden olabilir ve beyin dışı metastatik morbidite ve mortaliteye yol açabilir. Kanser hücrelerinin intrakraniyal enjeksiyonu ekstrakraniyal tümör oluşumunu sınırlayabilse de, enjekte edilen hücrelerin enjeksiyon bölgesinde sıklıkla tekil bir tümör kütlesi oluşturması, yüksek leptomeningeal tutulum ve iğne penetrasyonu sırasında beyin vaskülatüründe hasar görmesi gibi çeşitli uyarıları vardır. Bu protokol, internal karotis arter enjeksiyonu ile üretilen beyin metastazının bir fare modelini tanımlar. Bu yöntem, diğer organların tutulumu olmadan sürekli olarak intrakraniyal tümörler üreterek beyin metastazı için terapötik ajanların değerlendirilmesini sağlar.
Introduction
Beyin metastazı çok kötü prognozile ilişkili yaygın bir malignitedir 1,2. Beyin metastazı hastalarında bakım standardı, hastaların genel sağlık durumuna, ekstrakraniyal hastalık yüküne, beyindeki tümörlerin sayısı ve konumuna bağlı olarak beyin cerrahisi, tüm beyin radyoterapisi ve/veya stereotaktik radyocerrahiden oluşan multimodaldir 3,4. Üç intrakraniyal lezyonu olan hastalar cerrahi rezeksiyon veya stereotaktik radyocerrahi için uygundur, oysa cerrahiye bağlı enfeksiyon ve ödem riskinden kaçınmak için çoklu lezyonları olan hastalar için tüm beyin radyasyon tedavisi önerilmektedir5. Bununla birlikte, tüm beyin radyoterapisi radyosensitif beyin yapılarına zarar verebilir ve düşük yaşam kalitesine katkıdabulunabilir 6.
Sistemik tedavi, multipl lezyonlu hastaların tedavisinde non-invaziv alternatif ve mantıklı bir yaklaşımdır7. Bununla birlikte, sistemik tedavilerin zayıf etkinliğe sahip olduğu uzun süredir devam eden fikir nedeniyle daha az düşünülmektedir, çünkü sitotoksik ilaçların kan dolaşımı yoluyla pasif olarak verilmesi, güvenli olmayan toksisite riski olmadan beyinde terapötik seviyelere ulaşamaz8. Bu paradigma, yakın zamanda ABD Gıda ve İlaç İdaresi (FDA) onaylı sistemik tedavi (metastatik HER2 + meme kanseri beyin metastazı için endike trastuzumab ve kapesitabin içeren tucatinib) 9,10,11,12 ve beyin metastazı hastaları için sistemik tedavi seçeneklerinin dikkate alınmasını içerecek şekilde tedavi kılavuzlarındaki güncelleme 13,14 ile değişmeye başlamaktadır.
Bu bağlamda, moleküler hedefli tedavi, immünoterapi ve hedefli nano ilaç taşıyıcısı gibi alternatif ilaç dağıtım sistemleri alanındaki gelişmeler, beyin metastazı tedavisinin zorluklarının potansiyel olarak üstesinden gelebilir15,16,17,18. Ek olarak, beyin-tümör bariyerinin geçirgenleştirilmesi yoluyla ilaç dağıtımını iyileştirmeye yönelik kimyasal ve mekanik yaklaşımlar da araştırılmaktadır19,20. Bu tür yaklaşımları amaca uygun olacak şekilde incelemek ve optimize etmek için, sadece beyin metastazının karmaşık fizyolojisini yansıtmakla kalmayıp aynı zamanda intrakraniyal ilaç yanıtının objektif analizine de izin veren preklinik modellerin kullanılması çok önemlidir.
Genel olarak, in vivo beyin metastazını modellemeye yönelik mevcut yaklaşımlar, farelerde kanser hücrelerinin intrakardiyak (sol ventrikül), intravenöz (genellikle kuyruk damarı), intrakraniyal veya intrakarotis (ortak karotis arter) enjeksiyonunu içerir 21,22,23,24,25,26,27 . Tümör engraftman stratejilerinin yanı sıra, tümör baskılayıcı genlerin çıkarılması veya onkogenlerin aktivasyonu ile tümör oluşumunun tetiklendiği genetik olarak tasarlanmış fare modelleri, tümör modellemesi için yararlıdır. Bununla birlikte, sadece birkaç genetiği değiştirilmiş fare modelinin ikincil tümörler ürettiği ve hatta daha azının güvenilir bir şekilde beyin metastazı ürettiği bildirilmiştir28,29,30.
İntrakardiyak (sol ventrikül) ve intravenöz (genellikle kuyruk veni) enjeksiyon gibi engraftman yöntemleri kanserin sistemik yayılımını taklit eder. Bu modeller tipik olarak, dolaşımdaki “ilk geçişleri” sırasında çoğu tümör hücresini yakalayan kılcal yatağa bağlı olarak birden fazla organda (örneğin, beyin, akciğerler, karaciğer, böbrekler, dalak) lezyonlar üretir31. Bununla birlikte, tutarsız beyin aşılama oranları, istenen istatistiksel güç için örneklem büyüklüğüne ulaşmak için daha fazla hayvan gerektirecektir. Bu intrakardiyak ve intravenöz enjeksiyon yöntemleriyle sonunda beyinde yerleşen tümör hücrelerinin sayısı değişkendir. Bu nedenle, beyin metastazı tümör yükü hayvanlar arasında değişebilir ve ilerlemedeki fark, deneysel zaman çizelgesini standartlaştırmayı ve sonuçların yorumlanmasını zorlaştırabilir. Ekstrakraniyal tümör yükü, beyin dışı metastaz mortalitesine yol açabilir ve bu da bu modelleri intrakraniyal etkinliği değerlendirmek için uygun hale getirmez. Ekstrakraniyal oluşumu azaltmak için yapay klonal seleksiyon süreçleri kullanılarak beyin-tropik hücre hatları oluşturulmuştur, ancak alım oranları tutarsızdır ve klonal seçim süreci normalde insan tümörlerinde bulunan heterojenliği azaltabilir32.
İntrakraniyal ve intrakarotis enjeksiyonu gibi beyne özgü engraftasyon yöntemleri, daha tutarlı ve verimli beyin metastazı modellemesine izin verir. İntrakraniyal yöntem33’te, kanser hücreleri tipik olarak frontal serebral kortekse enjekte edilir, bu da düşük sistemik tutulum ile hızlı ve tekrarlanabilir tümör büyümesi üretir. Prosedür düşük mortalite33 ile iyi tolere edilirken, uyarılar, beyindeki hücrelerin (lokalize) bir bolusunu hızla tanıtan ve erken beyin metastazı patogenezini modellemeyen nispeten kaba bir yaklaşım olmasıdır. İğne beyin dokusu vaskülatürüne zarar verir ve bu da lokalize inflamasyona neden olur 5,34. Deneyimlere göre, iğnenin çıkarılması sırasında tümör hücresi enjekte edilmesinin reflüye eğilimi vardır ve bu da leptomeningeal tutuluma yol açmaktadır. Alternatif olarak, intrakarotis yöntemi, hücreleri karşılaşılacak ilk kılcal yatak olarak beyin mikrovaskülatürü ile ortak karotis artere teslim eder, dolaşımda sağkalımı modeller, ekstravazasyon ve kolonizasyon24. Diğerleri25 ile aynı fikirde, bu yöntemle ilgili deneyimlerimiz, kanser hücrelerinin dış karotis arter yoluyla bu dokulardaki kılcal yataklara kasıtsız olarak verilmesine bağlı olarak yüz tümörlerine neden olabileceğini bulmuştur (yayınlanmamış veriler). Fasiyal tümörleri, yaygın karotis arter enjeksiyonundan önce eksternal karotis arteri bağlayarak önlemek mümkündür (Şekil 1). Makalenin geri kalanında, bu yöntem ‘internal karotis arter enjeksiyonu’ olarak adlandırılmaktadır. Deneyimlere göre, internal karotis arter enjeksiyon yöntemi sürekli olarak çok az sistemik olayla beyin metastazı üretir ve farklı primer kanserlerin (örneğin, melanom, meme ve akciğer kanserleri) beyin metastaz modellerinin üretilmesinde başarılı olmuştur (Şekil 1). Dezavantajları, teknik olarak zorlu, zaman alıcı, invaziv olması ve hücre sayılarının dikkatli bir şekilde optimize edilmesini ve bir izleme zaman çizelgesini gerektirmesidir. Özetle, hem intrakraniyal hem de internal karotis arter enjeksiyon yöntemleri, beyin tümörü ile ilişkili sağkalım yararı üzerindeki terapötik etkiyi değerlendirmek için uygun fare modelleri üretmektedir.
Bu protokol, neredeyse hiç sistemik tutulumu olmayan ve bu nedenle ilaç dağılımının klinik öncesi değerlendirmesi ve deneysel terapötiklerin etkinliği için uygun olan beyin metastazının bir fare modelini üretmek için internal karotis arter enjeksiyon yöntemini tanımlamaktadır.
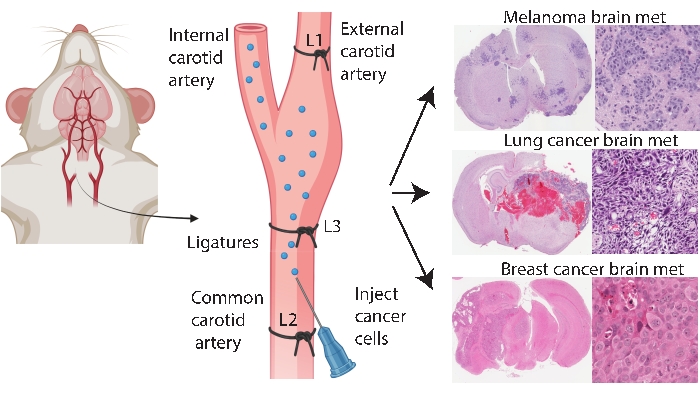
Şekil 1: Beyin metastazı için internal karotis arter enjeksiyon protokolünün şematik gösterimi. Eksternal karotis arter ligasyonu ile internal karotis arter enjeksiyonu, çeşitli primer kanserlerden güvenilir bir şekilde beyin metastazı modeli üretebilir. Bu protokolde, karotis arter üzerine üç ligatür yerleştirilir (şekilde L1-L3 olarak belirtilmiştir). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Beyin metastazı, kanser hücrelerinin birincil bölgelerinden beyne yayılmasının karmaşık bir sürecidir. Bu çok adımlı sürecin belirli aşamalarını yansıtan farklı hayvan modelleri mevcuttur ve klinik öncesi metastaz çalışmalarının tasarlanmasında fizyolojik ve pratik hususlar vardır41,42. Beyin metastazı tedavisinde nanotıp kullanımını araştıran yayınlanmış çalışmaların çoğunda intrakardiyak 43,44 ve intrakraniyal 45,46,47,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu araştırma, Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC), hibe numarası APP1162560 tarafından finanse edilmiştir. ML, bir UQ lisansüstü araştırma bursu ile finanse edildi. Hayvancılığa ve hayvanların in vivo görüntülenmesine yardımcı olan herkese teşekkür ederiz. Royal Brisbane ve Kadın Hastanesi’ne bu çalışma için zirkonyum alikotları bağışladıkları için teşekkür ederiz.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

