Modellering av hjärnmetastaser genom inre halspulsåderinjektion av cancerceller
Summary
Hjärnmetastaser är en orsak till svår sjuklighet och dödlighet hos cancerpatienter. De flesta hjärnmetastaseringsmusmodeller kompliceras av systemiska metastaser som förvirrar analys av dödlighet och terapeutiska interventionsresultat. Här presenteras ett protokoll för intern karotisinjektion av cancerceller som producerar konsekventa intrakraniella tumörer med minimala systemiska tumörer.
Abstract
Hjärnmetastaser är en orsak till svår sjuklighet och dödlighet hos cancerpatienter. Kritiska aspekter av metastatiska sjukdomar, såsom den komplexa neurala mikromiljön och stromacellinteraktionen, kan inte helt replikeras med in vitro-analyser ; Således är djurmodeller avgörande för att undersöka och förstå effekterna av terapeutisk intervention. De flesta hjärntumörxenografteringsmetoder producerar dock inte hjärnmetastaser konsekvent när det gäller tidsramen och tumörbördan. Hjärnmetastaseringsmodeller som genereras av intrakardiell injektion av cancerceller kan resultera i oavsiktlig extrakraniell tumörbörda och leda till icke-hjärnmetastatisk sjuklighet och dödlighet. Även om intrakraniell injektion av cancerceller kan begränsa extrakraniell tumörbildning, har den flera försiktighetsåtgärder, såsom de injicerade cellerna bildar ofta en singulär tumörmassa vid injektionsstället, hög leptomeningeal involvering och skador på hjärnvaskulatur under nålpenetration. Detta protokoll beskriver en musmodell av hjärnmetastaser som genereras av intern halspulsåderinjektion. Denna metod producerar intrakraniella tumörer konsekvent utan inblandning av andra organ, vilket möjliggör utvärdering av terapeutiska medel för hjärnmetastaser.
Introduction
Hjärnmetastaser är en utbredd malignitet i samband med en mycket dålig prognos 1,2. Vårdstandarden för hjärnmetastaseringspatienter är multimodal och består av neurokirurgi, strålbehandling i hela hjärnan och/eller stereotaktisk radiokirurgi beroende på patienternas allmänna hälsotillstånd, extrakraniell sjukdomsbörda och antalet och placeringen av tumörer i hjärnan 3,4. Patienter med upp till tre intrakraniella lesioner är berättigade till kirurgisk resektion eller stereotaktisk radiokirurgi, medan strålbehandling i hela hjärnan rekommenderas för patienter med flera lesioner för att undvika risken för kirurgirelaterad infektion och ödem5. Strålbehandling av hela hjärnan kan dock orsaka skador på radiokänsliga hjärnstrukturer, vilket bidrar till dålig livskvalitet6.
Systemisk terapi är ett icke-invasivt alternativt och logiskt tillvägagångssätt för att behandla patienter med flera lesioner7. Det är dock mindre övervägt på grund av den långvariga uppfattningen att systemiska terapier har dålig effekt eftersom passiv leverans av cytotoxiska läkemedel via blodomloppet inte kan uppnå terapeutiska nivåer i hjärnan utan risk för osäker toxicitet8. Detta paradigm börjar förändras med den nyligen godkända systemiska behandlingen av U.S. Food and Drug Administration (FDA) (tucatinib med trastuzumab och capecitabin indicerat för metastaserande HER2+ bröstcancerhjärnmetastaser)9,10,11,12 och uppdateringen av behandlingsriktlinjerna för att inkludera övervägande av systemiska terapialternativ för hjärnmetastaseringspatienter13,14.
I detta sammanhang kan utvecklingen inom molekylär riktad terapi, immunterapi och alternativa läkemedelsleveranssystem, såsom en riktad nano-läkemedelsbärare, potentiellt övervinna utmaningarna med hjärnmetastasbehandling15,16,17,18. Dessutom undersöks kemiska och mekaniska metoder för att förbättra läkemedelsleverans via permeabilisering av hjärntumörbarriären19,20. För att studera och optimera sådana tillvägagångssätt för att vara lämpliga för ändamålet är det viktigt att använda prekliniska modeller som inte bara speglar den komplexa fysiologin för hjärnmetastaser utan också möjliggör objektiv analys av intrakraniellt läkemedelssvar.
I stort sett involverar de nuvarande metoderna för modellhjärnmetastaser in vivo intrakardiell (vänster ventrikel), intravenös (vanligtvis svansven), intrakraniell eller intrakarotis (vanlig halspulsåder) injektion av cancerceller hos möss 21,22,23,24,25,26,27 . Förutom tumörengraftmentstrategier är genetiskt modifierade musmodeller där tumörbildning utlöses genom avlägsnande av tumörsuppressorgener eller aktivering av onkogener användbara för tumörmodellering. Men endast ett fåtal genetiskt modifierade musmodeller rapporteras producera sekundära tumörer och ännu färre som på ett tillförlitligt sätt producerar hjärnmetastaser28,29,30.
Engraftmentmetoder som intrakardiell (vänster ventrikel) och intravenös (vanligtvis svansven) injektion efterliknar den systemiska spridningen av cancer. Dessa modeller producerar vanligtvis lesioner i flera organ (t.ex. hjärna, lungor, lever, njurar, mjälte) beroende på kapillärbädden som fångar de flesta tumörceller under deras cirkulationspass “första pass”31. Inkonsekventa nivåer av hjärningraftment kommer dock att kräva fler djur för att uppnå provstorleken för önskad statistisk kraft. Antalet tumörceller som så småningom etablerar sig i hjärnan via dessa intrakardiella och intravenösa injektionsmetoder varierar. Därför kan hjärnmetastaseringstumörbördan variera mellan djur och skillnaden i progression kan göra standardisering av den experimentella tidslinjen och tolkningen av resultat till en utmaning. Den extrakraniella tumörbördan kan leda till dödlighet utan hjärnmetastaser, vilket gör dessa modeller olämpliga för utvärdering av intrakraniell effekt. Hjärn-tropiska cellinjer har etablerats med hjälp av artificiella klonala selektionsprocesser för att minska extrakraniell etablering, men upptagningshastigheterna har varit inkonsekventa och den klonala urvalsprocessen kan minska heterogeniteten som normalt finns i mänskliga tumörer32.
Hjärnspecifika engraftmentmetoder som intrakraniell och intrakarotisinjektion möjliggör mer konsekvent och effektiv hjärnmetastaseringsmodellering. I den intrakraniella metoden33 injiceras cancerceller vanligtvis i den främre hjärnbarken, vilket genererar snabb och reproducerbar tumörutväxt med lågt systemiskt engagemang. Även om proceduren tolereras väl med låg dödlighet33, är försiktighetsåtgärderna att det är ett relativt grovt tillvägagångssätt som snabbt introducerar en (lokaliserad) bolus av celler i hjärnan och inte modellerar tidig hjärnmetastaseringspatogenes. Nålen skadar hjärnvävnadskärlen, som då orsakar lokaliserad inflammation 5,34. Av erfarenhet finns det en tendens att tumörcellinjektat återflöde under avlägsnande av nålen, vilket leder till leptomeningeal involvering. Alternativt levererar intracarotidmetoden celler till den gemensamma halspulsådern med hjärnmikrovaskulatur som den första kapillärbädden som påträffas, modelleringsöverlevnad i cirkulation, extravasation och kolonisering24. I överensstämmelse med andra25 fann vår erfarenhet av denna metod att den kan resultera i ansiktstumörer på grund av oavsiktlig leverans av cancerceller via den yttre halspulsådern till kapillärbäddar i dessa vävnader (opublicerade data). Det är möjligt att förhindra ansiktstumörer genom att först ligera den yttre halspulsådern före vanlig halspulsåderinjektion (figur 1). I resten av artikeln kallas denna metod för “inre halspulsåderinjektion”. Av erfarenhet genererar den inre halspulsåderinjektionsmetoden konsekvent hjärnmetastaser med mycket få systemiska händelser och har lyckats generera hjärnmetastaseringsmodeller av olika primära cancerformer (t.ex. melanom, bröst- och lungcancer) (Figur 1). Nackdelarna är att det är tekniskt utmanande, tidskrävande, invasivt och kräver noggrann optimering av cellnummer och en övervakningstidslinje. Sammanfattningsvis producerar både intrakraniella och interna halspulsåderinjektionsmetoder musmodeller som är lämpliga för att utvärdera terapeutisk inverkan på hjärntumörrelaterad överlevnadsfördel.
Detta protokoll beskriver den interna halspulsåderinjektionsmetoden för att producera en musmodell av hjärnmetastaser med nästan ingen systemisk inblandning och därför lämplig för preklinisk utvärdering av läkemedelsdistribution och effekt av experimentella terapier.
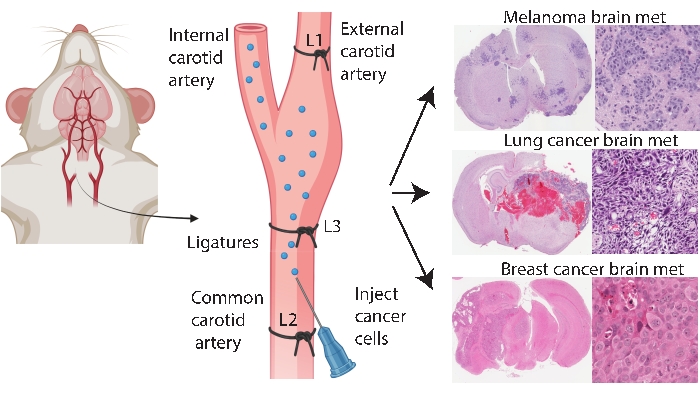
Figur 1: Schematisk representation av internt halspulsåderinjektionsprotokoll för hjärnmetastaser. Intern halspulsåderinjektion med extern halspulsåderligering kan på ett tillförlitligt sätt producera en hjärnmetastaseringsmodell från olika primära cancerformer. I detta protokoll placeras tre ligaturer på halspulsådern (kommenterad som L1-L3 i figuren). Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Hjärnmetastaser är en komplex process av cancerceller som sprider sig från deras primära plats till hjärnan. Olika djurmodeller finns tillgängliga som speglar vissa stadier i denna flerstegsprocess och det finns fysiologiska och praktiska överväganden för att utforma prekliniska metastaseringsstudier41,42. De flesta publicerade studier som undersöker användningen av nanomedicin för behandling av hjärnmetastaser har använt intrakardiella<sup class="x…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna forskning finansierades av The Australian National Health and Medical Research Council (NHMRC), bidragsnummer APP1162560. ML finansierades av ett UQ-forskarutbildningsstipendium. Vi vill tacka alla som hjälpt till med djurhållning och in vivo-avbildning av djuren. Vi tackar Royal Brisbane and Women’s Hospital för att ha donerat alikvoter av zirkonium för denna studie.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Cancer Research. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Cancer Research. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Cancer Research. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

