Levende avbildning av tidlige hjerteprogenitorer i museembryoet
Summary
Vi presenterer en detaljert protokoll for museembryokultur og avbildning som muliggjør 3D + tidsavbildning av hjerteprogenitorceller. Dette videoverktøysettet tar for seg de viktigste ferdighetene som kreves for vellykket live bildebehandling, ellers vanskelig å skaffe seg fra tekstpublikasjoner.
Abstract
De første trinnene i hjerteutvikling innebærer drastiske endringer i celleadferd og differensiering. Mens analyse av faste embryoer gjør det mulig å studere i detalj spesifikke utviklingsstadier i et stillbilde, fanger levende bildebehandling dynamiske morfogenetiske hendelser, for eksempel cellemigrasjon, formendringer og differensiering, ved å avbilde embryoet når det utvikler seg. Dette utfyller fast analyse og utvider forståelsen av hvordan organer utvikler seg under embryogenese. Til tross for fordelene brukes levende bildebehandling sjelden i musemodeller på grunn av tekniske utfordringer. Tidlige museembryoer er følsomme når de dyrkes ex vivo og krever effektiv håndtering. For å legge til rette for en bredere bruk av levende bildebehandling i museutviklingsforskning, presenterer dette papiret en detaljert protokoll for to-foton levende mikroskopi som muliggjør langsiktig oppkjøp i museembryoer. I tillegg til protokollen gis tips om embryohåndtering og kulturoptimalisering. Dette vil bidra til å forstå viktige hendelser i tidlig museorganogenese, og øke forståelsen av kardiovaskulær stamcellebiologi.
Introduction
Hjertet dannes tidlig under embryogenesen for å begynne å pumpe næringsstoffer til hele embryoet, mens det fortsetter å utvikleseg 1. I museembryoer, en og en halv dag etter initiering av gastrulasjon, samles et rudimentært hjerteorgan ved den fremre polen 2,3. Ved tidlig strekstadium (ES) kommer hjerteprogenitorer i epiblastingressen gjennom den primitive streken til det gryende mesodermale laget 4,5,6 og begynner å migrere til den fremre polen, hvor de differensierer for å danne det primitive hjerterøret. Gjennom denne prosessen gjennomgår tidlige hjerteprogenitorer celleomorganiseringer, formtransformasjoner og differensiering, i tillegg til migrasjon7 (figur 1).
Tidlige hjerteprogenitorer har tiltrukket forskere i nesten et århundre på grunn av deres bemerkelsesverdige evne til å differensiere og bygge et funksjonelt organ samtidig. I løpet av de siste to tiårene har klonal analyse og betingede knockout-modeller vist at tidlig hjerteutvikling impliserer forskjellige cellekilder i en svært dynamisk prosess 8,9,10. 3D-strukturen til det primitive hjerterøret og den dynamiske naturen til dets morfogenese gjør det imidlertid utfordrende å studere (figur 1), og vi er langt fra å forstå dets fulle kompleksitet11.
For å studere disse dynamiske cellulære prosessene, tilbyr levende bildebehandlingsmetoder nå en enestående detalj 7,12,13,14. I musemodellen har levende tilnærminger vært nøkkelen til å undersøke utviklingstemaer som er vanskelige å ta opp ved statisk analyse 7,13,15. Mens langsiktig ex vivo-kultur og robuste mikroskopoppsett utvikler seg raskt16,17, har få forskere ekspertisen til å lykkes med å avbilde levende embryoer. Selv om papirbaserte publikasjoner gir nok tekniske detaljer til å reprodusere live bildebehandlingseksperimenter, er noen ferdigheter og triks vanskelig å forstå uten visuelle eksempler eller peer-to-peer assistanse. For å akselerere denne læringsprosessen og spre bruken av levende bildebehandling blant laboratorier, samlet vi en videoprotokoll (figur 2) som samler de nødvendige ferdighetene til å utføre levende bildebehandling på gastrulating museembryoer.
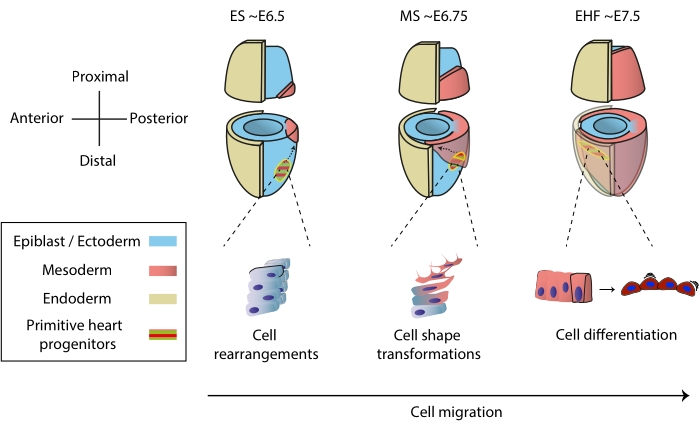
Figur 1 Tidlig differensiering av hjerteprogenitorceller i museembryoet fra debut av gastrulering til stadium forut for primitiv hjerterørsdannelse. Hjerteprogenitorceller kommer inn i mesodermen kort tid etter starten av gastruleringen, og migrerer til motsatt side av embryoet. Morfologisk og embryonal dag (E) stadium er skrevet på toppen av diagrammene. Stiplede piler skildrer migrasjonsbanen til primitive hjerterørprogenitorer under gastrulasjon. Dette tallet ble tilpasset fra11. Forkortelser: ES = tidlig strek; MS = Midt strek; EHF = tidlig hodefold. Klikk her for å se en større versjon av denne figuren.
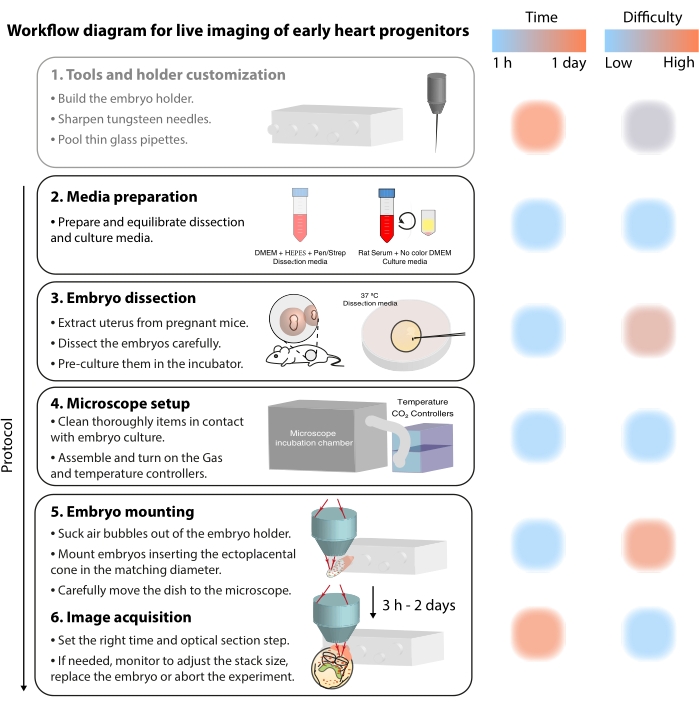
Figur 2: Arbeidsflytdiagram for levende avbildning av tidlige hjerteprogenitorer. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Tidlige hjerteprogenitorer organiserer seg i et primitivt hjerterør som begynner å slå mens det fortsatt dannes. Å forstå hvordan denne prosessen foregår er nøkkelen til å finne det brede spekteret av medfødte hjertefeil til spesifikke morfogenetiske hendelser. For det gir levende bildebehandling en mulighet til å studere normal og defekt embryonal utvikling med økt tidsmessig oppløsning. Dette er spesielt nyttig for å studere tidlige hjerteprogenitorceller da de overgår raskt gjennom flere differensierings…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne anerkjenner Dr. Kenzo Ivanovitch for tidligere arbeid med denne metoden og gruppen av Dr. Shigenori Nonaka (National Institutes of Natural Sciences, Japan) for å gi den første ekspertisen på embryomontering. Denne studien ble støttet av Grant PGC2018-096486-B-I00 fra den spanske Ministerio de Ciencia e Innovación og Grant H2020-MSCA-ITN-2016-722427 fra EU Horizon 2020-programmet til MT og Grant 1380918 fra FEDER Andalucía 2014-2020 Operating Program til JND. MS ble støttet av et La Caixa Foundation PhD-stipendiat (LCF / BQ / DE18 / 11670014) og The Company of Bioologists traveling fellowship (DEVTF181145). CNIC støttes av det spanske vitenskapsdepartementet og ProCNIC Foundation.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
References
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

