항체 기반 치료 분자의 질량 계산을 위한 오픈 소스 프레임워크
Summary
이 기사에서는 단클론 항체 기반 단백질 치료제의 질량 계산을 위한 소프트웨어 애플리케이션인 mAbScale의 사용에 대해 설명합니다.
Abstract
바이오 치료제 덩어리는 정체성과 구조적 무결성을 확인하는 수단입니다. 원형 단백질 또는 단백질 소단위체의 질량분석법(MS)은 바이오 의약품 개발의 여러 단계를 위한 간편한 분석 도구를 제공합니다. 단백질의 정체는 MS의 실험 질량이 이론적 질량의 사전 정의된 질량 오차 범위 내에 있을 때 확인됩니다. 단백질 및 펩타이드 분자량 계산을 위한 여러 계산 도구가 존재하지만, 바이오 치료제 개체에 직접 적용하도록 설계되지 않았거나, 유료 라이선스로 인해 액세스 제한이 있거나, 호스트 서버에 단백질 염기서열을 업로드해야 합니다.
당사는 단클론 항체(mAb), 이중특이성 항체(bsAb) 및 항체-약물 접합체(ADC)를 포함한 치료용 당단백질의 평균 또는 단일 동위원소 질량 및 원소 조성을 쉽게 측정할 수 있는 모듈식 질량 계산 루틴을 개발했습니다. 이 Python 기반 계산 프레임워크의 모듈식 특성으로 인해 이 플랫폼은 향후 백신, 융합 단백질 및 올리고뉴클레오티드와 같은 다른 양식으로 확장될 수 있으며 이 프레임워크는 하향식 질량 분석 데이터 조사에도 유용할 수 있습니다. 그래픽 사용자 인터페이스(GUI)를 갖춘 오픈 소스 독립 실행형 데스크톱 애플리케이션을 만들어 독점 정보를 웹 기반 도구에 업로드할 수 없는 환경에서의 사용 제한을 극복하고자 합니다. 이 글에서는 이 도구인 mAbScale을 다양한 항체 기반 치료 양식에 적용하는 알고리즘과 응용 분야에 대해 설명합니다.
Introduction
지난 20년 동안 바이오 치료제는 현대 제약 산업의 중심이 되도록 발전했습니다. SARS-CoV2 팬데믹 및 기타 생명을 위협하는 조건으로 인해 바이오 제약 분자 1,2,3의 더 빠르고 광범위한 개발에 대한 필요성이 더욱 높아졌습니다.
바이오치료제 분자량은 다른 분석 분석법과 함께 분자를 식별하는 데 매우 중요합니다. 온전한 소단위 질량과 감소된 소단위 질량은 QTPP(Quality Target Product Profile)4에 설명된 대로 품질 유지를 목표로 하는 제어 전략의 일환으로 발견 및 개발 수명 주기 전반에 걸쳐 사용됩니다.
바이오 제약 산업의 분석 개발은 펩타이드 맵핑 또는 다중 속성 분석법(MAM) 모니터링을 사용한 원형(intact) 질량 분석 및 심층 특성 분석을 위한 질량 측정에 크게 의존합니다. 최신 질량분석법(MS) 플랫폼을 활용하는 이러한 기술의 핵심은 고분해능 정밀 질량(HR/AM) 측정을 제공하는 기능입니다. 대부분의 HR/AM 기기는 0.5-5ppm 범위의 질량 정확도를 제공하며, 이는 질량 범위에 따라 확장됩니다. 온전한 거대 분자에 대한 질량을 정확하게 측정할 수 있는 능력은 거대 분자 치료제를 빠르고 확실하게 식별할 수 있게 합니다. 큰 분자 (>10 kDa)에 대한 일반적인 실험 조건을 사용하여 동위원소 분해능을 얻을 수 없기 때문에 비교 및 식별을 위해 평균 질량을 계산해야합니다 5,6.
일반적인 원형(intact) 또는 소단위(subunit) 단백질 질량 스펙트럼은 전사 후 변형(post-translational modification, PTM) 및 클립 또는 염기서열 변이체(sequence variant)와 같은 1차 구조 차이로 인한 다양한 분자 형태에 대한 복합 정보를 포함하는 전체 단백질형 프로파일을 나타냅니다. 이러한 측정은 상대적으로 쉽고 처리량이 많기 때문에 특성화 및 공정 중 모니터링 제어에 적합합니다 7,8. 이러한 실험에 대한 데이터 분석은 일반적으로 사용자가 분자 형태(PTM 범위 또는 기타 분자 형태)에 대한 검색 공간을 정의해야 합니다. 당화 단백질의 경우, 이 검색 공간은 주로 당형(glycoform) 이질성에 의해 주도됩니다. 여러 PTM, 이황화물 결합 구성 및 기본 구조에 따른 기타 변형의 조합으로 인해 가능한 모든 분자 형태를 계산하는 것은 지루한 작업입니다. 따라서 가능한 분자 형태의 수동 계산은 인적 오류가 발생할 가능성이 높은 시간과 자원 소모적인 프로세스입니다.
여기에서는 mAb, bsAbs, ADC 등과 같은 바이오 치료제 분자의 가장 중요한 특징을 고려하여 개발된 질량 계산 도구를 소개합니다. 이 도구를 사용하면 질량 및 원소 조성의 일관된 계산을 위해 검색 공간 변수를 쉽게 통합할 수 있습니다. 이 도구의 모듈식 특성으로 인해 추가 개발이 가능하여 다른 양식에 대한 질량 계산 및 질량 매칭에 적용할 수 있습니다.
GUI 모듈을 통해 사용자는 그림 1과 같이 질량 계산을 위한 입력을 지정할 수 있습니다. 특히, 사용자는 가벼운 항체 사슬과 무거운 항체 사슬에 대한 단일 문자 아미노산 서열을 입력합니다. 중쇄 N-말단 고리화 및 C-말단 라이신 클리핑에 대한 일반적인 수정이 확인란으로 포함되어 있습니다. 또한, 화학식/원소 조성은 각각의 Chem Mod 텍스트 상자를 통해 이러한 단백질 사슬에서 추가/뺄 수 있습니다. 이를 통해 사용자는 여러 번역 후 변형 또는 ADC의 경우 저분자 페이로드를 포함하는 원소 조성을 유연하게 추가할 수 있습니다. 대부분의 치료용 mAb는 경쇄의 당화 부위를 제거하도록 설계되었기 때문에 경쇄의 당화는 선택 사항이며 GUI의 확인란을 사용하여 지정할 수 있습니다.
항체에 대한 원형 질량 분석의 일반적인 변형은 사슬 간 이황화 결합을 감소시켜 경쇄가 중쇄에서 분리되는 감소된 소단위 질량 분석입니다. 사용된 환원제의 강도에 따라 사슬 내 이황화물 결합이 절단되거나 절단되지 않을 수 있습니다. 사용자는 IgG 아형에 따라 또는 시스테인 복합 ADC9의 경우 이황화 결합의 총 수를 입력할 수 있는 유연성을 갖습니다.
이 응용 프로그램은 상향식 방식으로 질량을 계산하며, 여기서 원소 조성은 개별 중쇄 및 경쇄에 대해 먼저 계산됩니다. 다음으로, 중쇄(HC) N-말단 고리화 Lys-클리핑은 계산된 원소 조성을 조정하여 설명됩니다. 그런 다음 지정된 화학적 변형이 중쇄 및/또는 경쇄에 적용됩니다. 분석 유형 및 사용자가 지정한 이황화 결합 패턴에 따라 수소 수는 두 개의 폴리펩티드 사슬에 대해 조정됩니다. 당화 HC 및 경쇄(LC)(선택 사항) 질량은 사용자의 입력에 따라 계산됩니다. 마지막으로, 여러 HC 및 LC 질량이 결합되고 온전한 질량 계산을 위해 이황화물 결합 번호가 자동으로 업데이트됩니다.
원형(intact) 단백질과 같은 더 큰 분자의 경우, 일반적인 분해능을 가진 질량 분석기를 사용할 때 첨가 질량 결함으로 인해 단일 동위원소 질량을 측정할 수 없습니다. 대신, 공칭 또는 평균 질량이 측정되거나 보고됩니다 5,10,11,12,13. 평균 원소 질량은 선별된 질량14,15에 사용된 소스에 따라 달라질 수 있습니다. 원소 질량의 차이는 작을 수 있지만 대분자 분자량 계산에서 중요한 값을 합산할 수 있습니다. 소프트웨어 응용 프로그램에서 기본적으로 사용되는 평균 원소 질량은 보충 표 1에 나와 있습니다. 바이오 제약 연구 및 개발(R&D) 분야와 같은 규제 환경의 경우, 질량의 변화는 규제 서류 제출 중에 분자 실체의 변화를 의미할 수 있기 때문에 일관된 분자 질량을 유지하는 것이 중요합니다. 원소 질량 사용의 일관성을 유지하기 위해 원소 질량 사전이 소프트웨어 도구에 쉼표로 구분된 값(csv) 텍스트 파일인 Element_Mass.csv(보충 코딩 파일 1)로 포함되어 있습니다. 유사하게, mAb에서 일반적으로 볼 수 있는 글라이칸 조성물의 선별된 목록이 포함되어 있습니다: Glycan.csv(보충 코딩 파일 2). 두 파일 모두 실행 가능한 응용 프로그램과 동일한 폴더 위치에 저장되며 사용자가 특정 원소 질량 목록 또는 글라이칸 라이브러리를 사용하도록 수정할 수 있습니다.
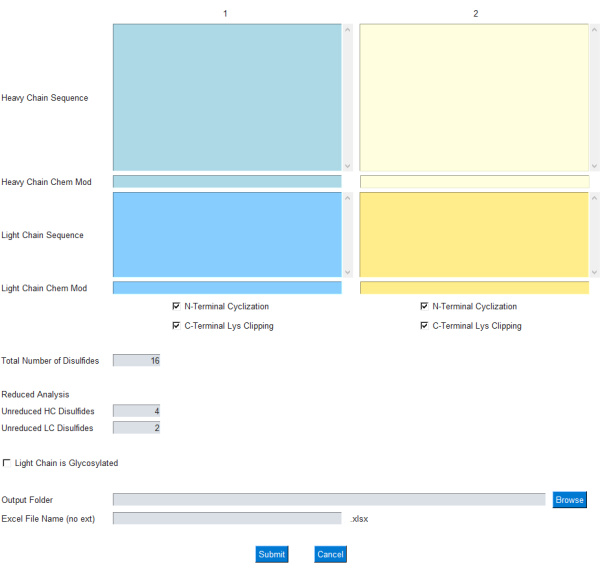
그림 1: mAbScale 응용 제품을 위한 GUI 인터페이스. GUI 모듈을 통해 사용자는 질량 계산을 위한 입력을 지정할 수 있습니다. 사용자는 가벼운 항체 사슬과 무거운 항체 사슬에 대한 단일 문자 아미노산 서열을 입력합니다. 중쇄 N-말단 순환화 및 C-말단 라이신 클리핑에 대한 일반적인 수정이 확인란으로 포함되어 있습니다. 화학식/원소 조성은 해당 Chem Mod 텍스트 상자를 통해 더하거나 뺄 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
mAbScale은 질량 및 원소 계산을 위해 빌딩 블록을 변경할 수 있는 유연성과 함께 직관적인 사용자 인터페이스를 제공합니다. 사용자는 응용 프로그램을 사용하고 정확한 질량을 도출하며 결과를 해석하기 위해 표적 분자에 대한 기본적인 이해가 있어야 합니다. 예를 들어, 디폴트 글라이칸 데이터베이스는 치료용 항체의 Fc 부분에서 일반적으로 발견되는 88개의 N-결합 글라이칸을 포함하기 때문에,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는 데이터 검증에 도움을 준 Robert Schuster에게 감사를 표합니다.
Materials
| Acquity UPLC system | Waters Corp., Milford, MA | N/A | Modular system |
| Antibody-drug conjugate (ADC) | GlaxoSmithKline | N/A | Proprietory molecule |
| BEH 200 SEC column | Waters Corp., Milford, MA | 176003904 | |
| Bispecific mAb | GlaxoSmithKline | N/A | Proprietory molecule |
| Byos | Protein Metrics, Cupertino, CA | https://proteinmetrics.com/byos/ Version 4.5 |
|
| GPMAW | GPMAW | http://www.gpmaw.com/ | |
| LC-MS grade water | Thermo Fisher Scientific, Waltham, MA | W6-1 | |
| mAb standard | Waters Corp., Milford, MA | 186009125 | Waters Humanized mAb Mass Check Standard |
| mAbScale | GlaxoSmithKline | Apache License, Version 2.0 | |
| Xevo G2 Q-TOF mass spectrometer | Waters Corp., Milford, MA | N/A | Modular system |
References
- Reichert, J. M., Valge-Archer, V. E. Development trends for monoclonal antibody cancer therapeutics. Nature Reviews Drug Discovery. 6 (5), 349-356 (2007).
- Kintzing, J. R., Filsinger Interrante, M. V., Cochran, J. R. Emerging strategies for developing next-generation protein therapeutics for cancer treatment. Trends in Pharmacological Sciences. 37 (12), 993-1008 (2016).
- Wang, M. -. Y., et al. SARS-CoV-2: Structure, biology, and structure-based therapeutics development. Frontiers in Cellular and Infection Microbiology. 10, 587269 (2020).
- ICH Q8 (R2) Pharmaceutical Development – Scientific Guideline. European Medicines Agency Available from: https://www.ema.europa.eu/en/ch-q8-r2-pharmaceutical-development-scientific-guideline (2018)
- Donnelly, D. P., et al. Best practices and benchmarks for intact protein analysis for top-down mass spectrometry. Nature Methods. 16 (7), 587-594 (2019).
- Gadgil, H. S., Pipes, G. D., Dillon, T. M., Treuheit, M. J., Bondarenko, P. V. Improving mass accuracy of high performance liquid chromatography/electrospray ionization time-of-flight mass spectrometry of intact antibodies. Journal of the American Society for Mass Spectrometry. 17 (6), 867-872 (2006).
- Beck, A., Sanglier-Cianférani, S., Van Dorsselaer, A. Biosimilar, biobetter, and next generation antibody characterization by mass spectrometry. Analytical Chemistry. 84 (11), 4637-4646 (2012).
- Camperi, J., Goyon, A., Guillarme, D., Zhang, K., Stella, C. Multi-dimensional LC-MS: the next generation characterization of antibody-based therapeutics by unified online bottom-up, middle-up and intact approaches. Analyst. 146 (3), 747-769 (2021).
- Liu, H., May, K. Disulfide bond structures of IgG molecules. mAbs. 4 (1), 17-23 (2012).
- Jakes, C., Füssl, F., Zaborowska, I., Bones, J. Rapid analysis of biotherapeutics using protein a chromatography coupled to orbitrap mass spectrometry. Analytical Chemistry. 93 (40), 13505-13512 (2021).
- Robotham, A. C., Kelly, J. F., Matte, A. Chapter 1 – LC-MS characterization of antibody-based therapeutics: Recent highlights and future prospects. Approaches to the Purification, Analysis and Characterization of Antibody-Based Therapeutics. , 1-33 (2020).
- Valeja, S. G., et al. Unit mass baseline resolution for an intact 148 kDa therapeutic monoclonal antibody by fourier transform ion cyclotron resonance mass spectrometry. Analytical Chemistry. 83 (22), 8391-8395 (2011).
- Fornelli, L., Ayoub, D., Aizikov, K., Beck, A., Tsybin, Y. O. Middle-down analysis of monoclonal antibodies with electron transfer dissociation orbitrap fourier transform mass spectrometry. Analytical Chemistry. 86 (6), 3005-3012 (2014).
- Berglund, M., Wieser, M. E. Isotopic compositions of the elements 2009 (IUPAC Technical Report). Pure and Applied Chemistry. 83 (2), 397-410 (2011).
- Wang, M., et al. The Ame2012 atomic mass evaluation. Chinese Physics C. 36 (12), 1603-2014 (2012).
- Peri, S., Steen, H., Pandey, A. GPMAW–A software tool for analyzing proteins and peptides. Trends in Biochemical Sciences. 26 (11), 687-689 (2001).
- Tipton, J. D., et al. Analysis of intact protein isoforms by mass spectrometry. The Journal of Biological Chemistry. 286 (29), 25451-25458 (2011).
- De Leoz, M. L. A., et al. interlaboratory study on glycosylation analysis of monoclonal antibodies: Comparison of results from diverse analytical methods. Molecular & Cellular Proteomics. 19 (1), 11-30 (2020).
- Cymer, F., Beck, H., Rohde, A., Reusch, D. Therapeutic monoclonal antibody N-glycosylation – Structure, function and therapeutic potential. Biologicals. 52, 1-11 (2018).
- Baker, P. R., Trinidad, J. C., Chalkley, R. J. Modification site localization scoring integrated into a search engine. Molecular & Cellular Proteomics. 10 (7), (2011).
- Chalkley, R. J., Clauser, K. R. Modification site localization scoring: Strategies and performance. Molecular & Cellular Proteomics. 11 (5), 3-14 (2012).

