قياس السمية الخلوية المعتمدة على الأجسام المضادة في نموذج كروي للورم: تطبيق لاكتشاف الأدوية
Summary
هنا ، نقدم طريقة لتحديد المركبات التي تعدل آلية ADCC ، وهي آلية مهمة لقتل الخلايا السرطانية للأجسام المضادة للأورام. يتم قياس التأثير السام للخلايا القاتلة الطبيعية في كرويات خلايا سرطان الثدي في وجود تراستوزوماب. يحدد تحليل الصور الخلايا القاتلة والمستهدفة الحية والميتة في الأجسام الكروية.
Abstract
يعد العلاج المناعي القائم على الأجسام المضادة وحيدة النسيلة الذي يستهدف مستضدات الورم الآن الدعامة الأساسية لعلاج السرطان. إحدى آليات عمل الأجسام المضادة ذات الصلة سريريا هي السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) ، حيث يرتبط الجسم المضاد بالخلايا السرطانية ويشرك المكون الخلوي للجهاز المناعي ، على سبيل المثال ، الخلايا القاتلة الطبيعية (NK) ، لقتل الخلايا السرطانية. يمكن تحسين فعالية هذه العلاجات من خلال تحديد المركبات المساعدة التي تزيد من حساسية الخلايا السرطانية أو قوة الخلايا المناعية. بالإضافة إلى ذلك ، قد تحدد التفاعلات الدوائية غير المكتشفة في مرضى السرطان الذين تم علاجهم بشكل مشترك لحالات سابقة أو الأعراض المرتبطة بالسرطان نجاح العلاج بالأجسام المضادة. لذلك ، يجب القضاء على هذه التفاعلات الدوائية غير المرغوب فيها. مع وضع هذه الأهداف في الاعتبار ، أنشأنا نموذج ADCC للسرطان ووصفنا هنا بروتوكولا بسيطا للعثور على الأدوية المعدلة ل ADCC. نظرا لأن النماذج ثلاثية الأبعاد مثل كرويات الخلايا السرطانية تتفوق على الثقافات ثنائية الأبعاد في التنبؤ بالاستجابات في الجسم الحي للأورام للعلاجات المضادة للسرطان ، فإن الثقافات المشتركة الكروية لخلايا سرطان الثدي HER2 + JIMT-1 التي تعبر عن EGFP و NK92. تم إنشاء خطوط خلايا CD16 وتحفيزها باستخدام Trastuzumab ، وهو جسم مضاد وحيد النسيلة معتمد سريريا ضد سرطان الثدي الإيجابي HER2. سمح للكرويات JIMT-1 بالتشكل في ألواح 96 بئرا طاردة للخلايا. في اليوم 3 ، تمت إضافة الخلايا القاتلة الطبيعية وتراستوزوماب. ثم تم تلطيخ الكرات ب Annexin V-Alexa 647 لقياس موت الخلايا المبرمج ، والذي تم قياسه كميا في المنطقة المحيطية للكرويات باستخدام مجهر آلي. يتم إثبات قابلية تطبيق مقايستنا لتحديد الجزيئات المعدلة ل ADCC من خلال إظهار أن Sunitinib ، وهو مثبط مستقبلات التيروزين كيناز المعتمد من قبل إدارة الغذاء والدواء ضد السرطان النقيلي ، يلغي ADCC بالكامل تقريبا. يتوافق توليد خطوط أنابيب التقاط الصور وتحليلها مع الفحص عالي الإنتاجية للمركبات المعدلة ل ADCC في كرويات الخلايا السرطانية.
Introduction
تستخدم كرويات الورم متعددة الخلايا (MCTS) على نطاق واسع نماذج ثلاثية الأبعاد (3D) تتشكل بسبب ميل الخلايا الملتصقة إلى التجميع وتمثل أداة مهمة لاكتساب نظرة ميكانيكية في بيولوجيا الخلايا السرطانية. يمكن توليدها من مجموعة واسعة من أنواع الخلايا بواسطة العديد من التقنيات ، مثل الثقافات ثلاثية الأبعاد القائمة على السائلوالسقالات 1. ميزتها الرئيسية على نماذج 2D أحادية الطبقة هي أنها تلخص السمات الرئيسية للأورام في الجسم الحي ، وهي التنظيم الهيكلي ونقص الأكسجة ، من خلال محاكاة السلوك البيولوجي للخلايا السرطانية ، وخاصة الآليات التي تؤدي إلى الهروب العلاجي ومقاومة الأدوية2. وبالتالي ، نظرا لأن MCTS يمكن أن يحسن القدرة على التنبؤ بالسمية وحساسية الأدوية ، فإنها تستخدم على نطاق واسع لدراسة السرطانات في 3D ويمكن أن تعزز تطوير أدوية فعالة لأنواع مختلفة من السرطان3.
لدراسة أي مرض ، هناك حاجة ماسة لنماذج ذات صلة ومريحة. يعد إعداد نماذج لدراسات المناعة السرطانية أمرا صعبا لأن الجهاز المناعي يتكون من أنواع متعددة من الخلايا. يحتوي كل نوع خلية على عدة أنواع فرعية ومجموعة واسعة من حالات التنشيط. تتفاعل هذه الأنواع المختلفة من الخلايا المناعية مع الخلايا السرطانية ومكونات الورم الأخرى ، مما يؤثر في النهاية على نتيجة المرض. تفشل طرق زراعة الخلايا 2D في المختبر في تلخيص هذه التفاعلات الخلوية المعقدة ، لأنها تفتقر إلى قابلية الترجمة وغير قادرة على التنبؤ بعمل الدواء على مستوى النظام (على سبيل المثال ، في الأنسجة)4,5. علاوة على ذلك ، فإن نماذج الفئران لها أيضا قيود شديدة بسبب الاختلافات الأساسية بين جهاز المناعة البشري والفئران. وبالتالي ، يمكن لأنظمة الثقافة ثلاثية الأبعاد سد الفجوات الحالية في النماذج المتاحة ، وتوفير طريقة بديلة وتحسين فهمنا لمناعة السرطان6. على وجه التحديد ، يمكن استخدام النماذج الكروية لاختبار العلاجات المناعية ، وذلك أساسا لتقييم كفاءة فحص الأدوية والأجسام المضادة العلاجية لتعزيز تسلل الخلايا المناعية والتأثيرات المضادة للورم ضد الأهداف الكروية7. علاوة على ذلك ، فإن إمكانات MCTS المكونة من خلايا في حالات أيضية وتكاثرية مختلفة لدراسة التفاعلات بين خلايا السدى (على سبيل المثال ، الخلايا الليمفاوية ، الضامة ، الخلايا الليفية) والخلايا السرطانية ولتطوير استراتيجيات جديدة مضادة للسرطان قد تم إثباتها بشكل كبير8. وبالتالي ، هناك حاجة حيوية لتأكيد المنصات التنبؤية والدقيقة من أجل تعزيز عملية اختبار الأدوية ، مع مراعاة الفيزيولوجيا المرضية للبيئة المكروية للورم.
سرطان الثدي (BC) هو السرطان الأكثر شيوعا الذي يتم تشخيصه في جميع أنحاء العالم لدى النساء. يعتمد التصنيف السريري لهذا المرض غير المتجانس على وجود مستقبلات عبر الغشاء ، على سبيل المثال ، مستقبلات هرمون الاستروجين (ER) والبروجسترون (PR) (تسمى مجتمعة مستقبلات الهرمونات ، HR) جنبا إلى جنب مع الإفراط في التعبير أو تضخيم مستقبل عامل نمو البشرة البشري 2 (HER2) البروتين / الجين الورمي. بناء على التعبير المناعي الكيميائي لهذه المستقبلات ، يتم التعرف على أربعة أنواع فرعية بشكل شائع: اللمعية A (HR + / HER2-) ، اللمعية B (HR + / HER2 +) ، HER2 الإيجابية (HR- / HER2 +) وسرطان الثدي الثلاثي السلبي (HR- / HER2-). تشكل مجموعة HER2 + 10-15٪ من حالات BC وتتميز بتعبير HER2 مرتفع مع غياب ER و PR ، ولديها تشخيص أسوأ مقارنة بالأورام اللمعية ، وتتطلب أدوية محددة موجهة ضد بروتين HER2 / neu9.
تطوير BC هو عملية متعددة الخطوات ، والتشخيص المبكر ضروري لعلاج ناجح للمرض10. ومع ذلك ، على الرغم من خيارات علاج BC الشخصية التي ظهرت مؤخرا (على سبيل المثال ، علاجات الغدد الصماء والأجسام المضادة ل HER2) ، تواصل BC تحدي أطباء الأورام. تماما مثل الجراحة والعلاج الكيميائي والعلاج الإشعاعي ، يمكن أن يكون لهذه العلاجات الشخصية أيضا آثار ضارة شديدة ويمكن للمرضى تطوير مقاومة لهذه العوامل ، مما يجعل تحديد أفضل استراتيجية11,12 تحديا طويل الأجل. وبالتالي ، فإن تحسين فهم التفاعل بين الورم وبيئته المكروية أمر ضروري ومن المتوقع أن يوفر اتجاهات جديدة لتطوير علاجات جديدة تأخذ في الاعتبار خصوصيات الأنواع الفرعية المختلفة من BC13. تتم دراسة موجة جديدة من العلاجات المناعية ، مثل اتحادات أدوية الأجسام المضادة ، وعلاجات الخلايا التائية بالتبني ، واللقاحات والأجسام المضادة أحادية النسيلة الجديدة الموجهة HER2 (mAbs) في مجموعة واسعة من المرضى الذين يعانون من الأورام المعبرة عن HER214.
على سبيل المثال ، يمثل Trastuzumab طريقة علاج فعالة ل HER2 + BC. كجزء من طريقة عمله ، يتوسط Trastuzumab الأنشطة المعتمدة على مستقبلات جاما القابلة للبلور (FcγR). تتميز FcγRs بتقاربها مع جزء Fc والاستجابة المناعية التي تبدأها. يعد تنشيط FcγRIIIa (CD16A) على الخلايا القاتلة الطبيعية (NK) أمرا بالغ الأهمية للتوسط في السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) ، في حين أن تحفيز FcγRIIa (CD32A) و FcγRIIIa على البلاعم يحفز البلعمة الخلوية المعتمدة على الأجسام المضادة (ADCP) 15. أظهرت الدراسات التي أجريت على النماذج الحيوانية أن الفئران التي تفتقر إلى مستقبلات FcγRI (CD64) و FcγRIII (CD16) لم تكن قادرة على بدء استجابات مناعية وقائية ضد المستضدات الخاصة بالورم ، مما يكشف أن ADCC من المحتمل أن يكون آلية عمل رئيسية ل mAb Trastuzumab16.
نظرا لأن الخلايا القاتلة الطبيعية تلجأ إلى القيمة المطلقة المرتبطة بالخلايا السرطانية لقتل الخلايا السرطانية بواسطة ADCC ، فإن التعبير عن مستقبلات Fc أمر بالغ الأهمية لعلاج فعال باستخدام Trastuzumab17 (الشكل 1). علاوة على ذلك ، يتم موازنة عملها بكفاءة من خلال تحفيز المستقبلات المنشطة والمثبطة ، على سبيل المثال ، مستقبلات تشبه الغلوبولين المناعي للخلايا القاتلة (KIR)18.
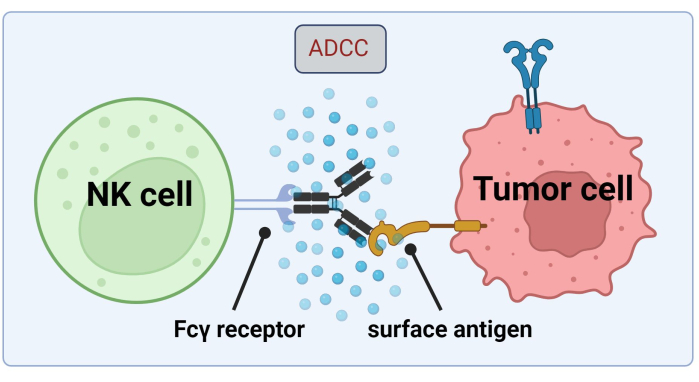
الشكل 1. آلية ADCC في سياق الاستجابة المضادة للأورام. يتعرف مستقبل Fcγ لخلية قاتلة طبيعية (NK) على منطقة Fc للجسم المضاد ، والتي كانت مرتبطة سابقا بمستضد سطحي على خلية سرطانية. يؤدي هذا المشبك المناعي إلى تحلل الخلية القاتلة الطبيعية التي تطلق وسطاء سامة للخلايا مثل الجرانزيمات والبيرفورين. تساهم هذه الجزيئات في تكوين المسام في غشاء الخلية وتنشط مسارات موت الخلايا المبرمج مما يتسبب في موت الخلية المبرمج للخلية المستهدفة (الصورة التي تم إنشاؤها باستخدام Biorender.com). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمثل تطوير العلاج المناعي ل HER2 + BC مجالا متطورا. في هذه الحالة ، ينبغي للمرء أن ينظر في التفاعلات بين المكونات المختلفة للجهاز المناعي. علاوة على ذلك ، اختبرت المنشورات السابقة على نطاق واسع العلاجات المركبة التي تشمل جميع أنواع العلاجات التقليدية أو المناعية أو الخلوية لتحديد مجموعات التآزر19.
تم استخدام العديد من النماذج ثلاثية الأبعاد من HER2 + BC سابقا لاكتشاف الأدوية. على سبيل المثال ، استخدم Balalaeva et al. كرويات SKBR-3 التي تفرط في التعبير عن HER2 لتقييم السمية الخلوية للسم المناعي المستهدف HER2 4D5scFv-PE4020. في دراسة أخرى ، تم إنشاء نظام زراعة HER2 + BC قائم على 3D Matrigel لقياس نمو الخلايا استجابة لعوامل Trastuzumab والغدد الصماء21. تسلط هذه الدراسات الضوء على أهمية النماذج الكروية للورم للخلايا السرطانية HER2 المفرطة في التعبير في تمثيل استراتيجية فعالة لتحسين الاستجابات العلاجية سريريا22.
حددت مجموعتنا سابقا Sunitinib ، وهو مثبط متعدد الأهداف لكيناز التيروزين ، كمثبط ل ADCC المعتمد على Trastuzumab في خلايا JIMT-1 HER2 + BC في مقايسة ثقافة ثنائية الأبعاد. كشفت الدراسة أن Sunitinib يحفز الالتهام الذاتي ويضعف وظيفة قتل الخلايا القاتلة الطبيعية ، ويقلل من تنظيم تعبير HER2 ويعزز الارتباط السطحي لخلايا JIMT-117.
هنا أنشأنا نموذجا جديدا ثلاثي الأبعاد ، كروي ADCC (NK.92.CD16 + Trastuzumab + JIMT-1-EGFP خلايا سرطانية) لاستخدامه في تطبيقات الفحص عالية الإنتاجية ، ومن أجل التحقق من صحة النتائج المذكورة أعلاه ، تم استخدام Sunitinib كمركب نموذجي. أولا ، أنشأنا EGFP الذي يعبر عن خلايا JIMT-117 ونمت كرويات من هذه الخلايا. تم تحفيز ADCC بواسطة الخلايا القاتلة الطبيعية مع Trastuzumab ، وتم الاحتفاظ بالكرويات في الثقافة في وجود أو عدم وجود مركبات اختبار لمدة 24 ساعة (الشكل 2). يعتمد القياس الكمي ل ADCC على الكشف عن موت الخلايا السرطانية المبرمج (تلطيخ الملحق الخامس) باستخدام نظام تحليل المحتوى العالي.
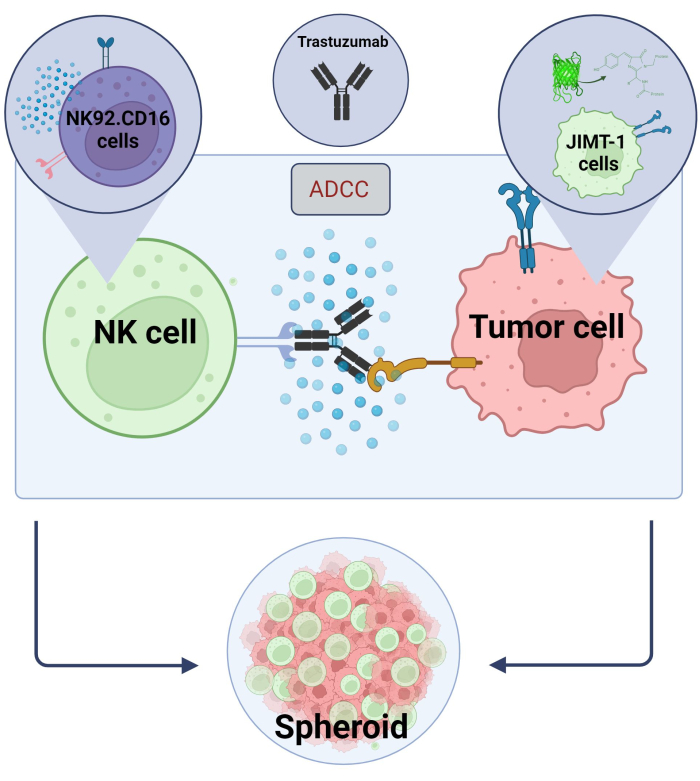
الشكل 2. ADCC في نظام الثقافة المشتركة كروية 3D. تعتمد إعداداتنا التجريبية على نظام كروي 3D يمكنه نمذجة البيئة المكروية في الجسم الحي بدقة أكبر مقارنة بنماذج 2D. تم زرع خلايا سرطان الثدي JIMT-1 EGFP على قاع طارد للخلايا مقعرة لتشكيل مجموعة خلوية مستديرة الشكل تسمى كروية. ثم بدأ ADCC بإضافة NK92. خلايا قاتلة طبيعية CD16 (نسبة E: T = 20: 1) وجسم مضاد أحادي النسيلة مضاد ل HER2 ، Trastuzumab. أثبت النموذج التجريبي كفاءته وسهولة تطبيقه لتحديد مركبات الاختبار المعدلة ل ADCC (الصورة التي تم إنشاؤها باستخدام Biorender.com). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لقد أثبتنا أن الحصول على البيانات بهذه الطريقة يمكن أن يتم في الوقت الفعلي وهو قوي إحصائيا للاستخدام في الفحص عالي المحتوى في اكتشاف أدوية السرطان. الأهم من ذلك ، أن هذا النموذج يسمح بالتحقق الموسع من مجموعة أكبر من المركبات ، ويمكن تطبيقه على العديد من المقايسات ذات الأهمية.
Protocol
Representative Results
Discussion
على الرغم من التحسينات الكبيرة في علاج BC على مدى العقود العديدة الماضية ، لا يزال المرضى يطورون بانتظام مقاومة الأدوية أو يعانون من آثار جانبية سلبية24. تتطلب معدلات المراضة والوفيات المرتفعة المرتبطة ب BC إجراء تحقيق مستمر في الآليات الجزيئية الأساسية ، تماما مثل منصات الفحص …
Disclosures
The authors have nothing to disclose.
Acknowledgements
تلقت LV تمويلا من منح المكتب الوطني للبحث والتطوير والابتكار GINOP-2.3.2-15-2016-00010 TUMORDNS “، GINOP-2.3.2-15-2016-00048-STAYALIVE، OTKA K132193 و K147482. وقد تلقى هذا المشروع تمويلا من شبكة البحوث الهنغارية HUN-REN. تم الحصول على خلايا CD16.176V.NK-92 من الدكتور كيري س. كامبل (مركز فوكس تشيس ، فيلادلفيا ، بنسلفانيا ، نيابة عن Brink Biologics، lnc. San Diego، CA) ، محمية ببراءات اختراع في جميع أنحاء العالم ، وتم ترخيصها من قبل Nantkwest، lnc. (www.nantkwest.com). يعرب المؤلفون عن امتنانهم لجيورجي فيرب وأرباد زوور لمساعدتهم في استخدام خط الخلية NK-92 و TR-F (ab’) 2 ، وعلى المشورة الفنية.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
References
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

