量化肿瘤球状体模型中抗体依赖性细胞毒性:药物发现应用
Summary
在这里,我们提出了一种鉴定调节ADCC机制的化合物的方法,ADCC机制是抗肿瘤抗体的重要癌细胞杀伤机制。在曲妥珠单抗存在下,在乳腺癌细胞球状体中测量NK细胞的细胞毒性作用。图像分析可识别球状体中的活细胞和死细胞、杀伤细胞和靶细胞。
Abstract
基于单克隆抗体的针对肿瘤抗原的免疫疗法现在是癌症治疗的支柱。抗体的临床相关作用机制之一是抗体依赖性细胞毒性 (ADCC),其中抗体与癌细胞结合并与免疫系统的细胞成分(例如自然杀伤 (NK) 细胞)结合以杀死肿瘤细胞。通过识别增加癌细胞敏感性或免疫细胞效力的辅助化合物,可以提高这些疗法的有效性。此外,在因既往疾病或癌症相关症状而联合用药的癌症患者中未发现的药物相互作用可能决定抗体治疗的成功;因此,需要消除这种不需要的药物相互作用。考虑到这些目标,我们创建了一个癌症ADCC模型,并在此描述了一种寻找ADCC调节药物的简单方案。由于癌细胞球体等 3D 模型在预测肿瘤对抗癌治疗 的体内 反应方面优于 2D 培养物,因此表达 EGFP 的 HER2+ JIMT-1 乳腺癌细胞和 NK92 的球状体共培养物。CD16 细胞系的建立和诱导曲妥珠单抗是一种临床批准的针对 HER2 阳性乳腺癌的单克隆抗体。允许JIMT-1球状体在细胞排斥U底96孔板中形成。第3天,加入NK细胞和曲妥珠单抗。然后用膜联蛋白 V-Alexa 647 对球状体进行染色以测量凋亡细胞死亡,并用自动显微镜在球状体的外围区域进行定量。我们的检测方法在鉴定ADCC调节分子方面的适用性得到了证明,表明舒尼替尼(一种经FDA批准的针对转移性癌症的受体酪氨酸激酶抑制剂)几乎完全消除了ADCC。球状体的生成以及图像采集和分析管道与癌细胞球体中ADCC调节化合物的高通量筛选兼容。
Introduction
多细胞肿瘤球状体 (MCTS) 是广泛使用的三维 (3D) 模型,由于贴壁细胞聚集的趋势而形成,是获得癌细胞生物学机制洞察的重要工具。它们可以通过多种技术从多种细胞类型中生成,例如基于液体和基于支架的 3D 培养物 1。与单层 2D 模型相比,它们的主要优势在于它们通过模拟肿瘤细胞的生物学行为,特别是导致治疗逃逸和耐药性的机制,概括了 体内 肿瘤的主要特征,即结构组织和缺氧2。因此,由于MCTS可以提高毒性和药物敏感性的可预测性,因此它们被广泛用于3D癌症研究,并可以促进针对不同类型癌症的有效药物的开发3。
为了研究任何疾病,迫切需要相关且方便的模型。建立癌症免疫学研究模型具有挑战性,因为免疫系统由多种细胞类型组成。每种细胞类型都有几种亚型和广泛的激活状态。这些不同的免疫细胞类型与癌细胞和其他肿瘤成分相互作用,最终影响疾病的结果。2D 体外细胞培养方法无法概括这些复杂的细胞相互作用,因为它们缺乏可翻译性,并且无法在系统水平(例如,在组织中)预测药物的作用4,5。此外,由于人类和小鼠免疫系统之间的根本差异,小鼠模型也具有严重的局限性。因此,3D 培养系统可以填补当前可用模型的空白,提供一种替代方法并提高我们对癌症免疫学的理解6。具体而言,球状体模型可用于测试免疫疗法,主要用于评估药物筛选和治疗性抗体的效率,以增强免疫细胞浸润和对球状体靶标的抗肿瘤作用7。此外,由处于不同代谢和增殖状态的细胞组成的 MCTS 在研究基质细胞(例如淋巴细胞、巨噬细胞、成纤维细胞)和癌细胞之间的相互作用以及开发新的抗癌策略方面的潜力已得到充分证明8。因此,考虑到肿瘤微环境的病理生理学,迫切需要证实预测性和准确的平台,以促进药物测试过程。
乳腺癌 (BC) 是全球女性中最常见的癌症。这种异质性疾病的临床分类基于跨膜受体的存在,例如雌激素 (ER) 和孕激素 (PR) 受体(统称为激素受体 HR)以及人表皮生长因子受体 2 (HER2) 蛋白/癌基因的过表达或扩增。根据这些受体的免疫组织化学表达,通常可识别四种亚型:管腔 A (HR+/HER2-)、管腔 B (HR+/HER2+)、HER2 阳性 (HR-/HER2+) 和三阴性乳腺癌 (HR-/HER2-)。HER2+ 组占 BC 病例的 10-15%,其特征是 HER2 高表达,无 ER 和 PR,与管腔肿瘤相比预后更差,需要针对 HER2/neu 蛋白的特异性药物9。
BC的发展是一个多步骤的过程,早期诊断对于成功治疗该疾病至关重要10。然而,尽管最近出现了个性化的 BC 治疗方案(例如内分泌和抗 HER2 抗体疗法),但 BC 继续挑战肿瘤学家。就像手术、化疗和放疗一样,这些个性化治疗也可能产生严重的不良反应,患者可能会对这些药物产生耐药性,这使得确定最佳策略成为一项长期挑战11,12。因此,提高对肿瘤与其微环境之间相互作用的理解至关重要,并有望为新疗法的开发提供新的方向,这些治疗方法考虑到不同 BC 亚型13 的特异性。新一波免疫疗法,如抗体药物偶联物、过继性 T 细胞疗法、疫苗和新型 HER2 定向单克隆抗体 (mAb),正在广泛的 HER2 表达肿瘤患者群体中进行研究14。
例如,曲妥珠单抗代表了 HER2+ BC 的有效治疗方式。作为其作用方式的一部分,曲妥珠单抗介导片段可结晶γ受体(FcγR)依赖性活性。FcγR的特点是它们对Fc片段的亲和力以及它们引发的免疫反应。激活自然杀伤 (NK) 细胞上的 FcγRIIIa (CD16A) 对于介导抗体依赖性细胞毒性 (ADCC) 至关重要,而在巨噬细胞上触发 FcγRIIa (CD32A) 和 FcγRIIIa 可诱导抗体依赖性细胞吞噬作用 (ADCP)15。对动物模型的研究表明,缺乏 FcγRI (CD64) 和 FcγRIII (CD16) 受体的小鼠无法启动针对肿瘤特异性抗原的保护性免疫反应,这表明 ADCC 可能是 mAb Trastuzumab16 的主要作用机制。
由于NK细胞诉诸肿瘤细胞结合的抗体通过ADCC杀死癌细胞,因此Fc受体的表达对于曲妥珠单抗17 的有效治疗至关重要(图1)。此外,它们的作用通过刺激激活和抑制受体(例如杀伤细胞免疫球蛋白样(KIR)受体18)而有效平衡。
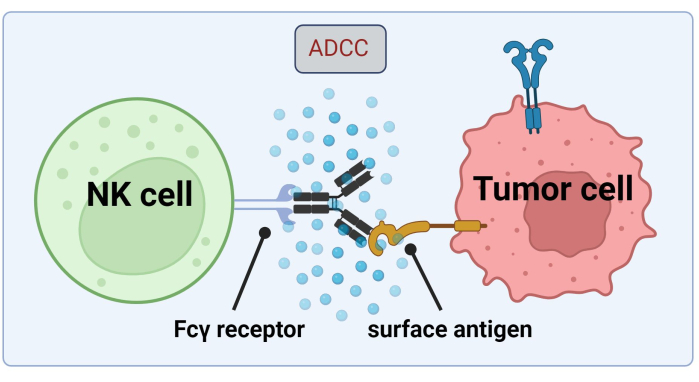
图 1.ADCC在抗肿瘤反应背景下的机制。 自然杀伤 (NK) 细胞的 Fcγ 受体可识别抗体的 Fc 区域,该抗体先前已与癌细胞上的表面抗原结合。这种免疫突触导致NK细胞脱颗粒,释放细胞毒性介质,如颗粒酶和穿孔素。这些分子有助于细胞膜中的孔形成并激活凋亡途径,导致靶细胞的程序性细胞死亡(用 Biorender.com 创建的图像)。 请点击这里查看此图的较大版本.
HER2+ BC的免疫疗法开发是一个不断发展的领域。在这种情况下,应该考虑免疫系统各个组成部分之间的相互作用。此外,先前的出版物已经广泛测试了涉及所有类型的传统、免疫或细胞疗法的联合疗法,以确定协同组合19。
HER2+ BC的几个3D模型以前已被用于药物发现。例如,Balalaeva 等人使用过表达 HER2 的 SKBR-3 球体来评估 HER2 靶向免疫毒素 4D5scFv-PE4020 的细胞毒性。在另一项研究中,建立了基于 3D 基质的 HER2+ BC 培养系统来测量响应曲妥珠单抗和内分泌药物的细胞生长21。这些研究强调了 HER2 过表达癌细胞的肿瘤球状体模型在代表临床改善治疗反应的有效策略方面的重要性22。
我们小组先前在 2D 培养试验中鉴定了 Sunitinib(一种多靶点酪氨酸激酶抑制剂)作为 JIMT-1 HER2+ BC 细胞中曲妥珠单抗依赖性 ADCC 的抑制剂。研究表明,舒尼替尼诱导自噬并损害NK细胞杀伤功能,下调HER2表达并增强JIMT-1细胞的表面附着17。
在这里,我们建立了一个新型的3D球状ADCC模型(NK.92.CD16+曲妥珠单抗+JIMT-1-EGFP癌细胞),用于高通量筛选应用,为了验证上述发现,使用舒尼替尼作为模型化合物。首先,我们生成了表达 JIMT-1 细胞的 EGFP17 ,并从这些细胞中生长出球状体。ADCC由NK细胞与曲妥珠单抗一起诱导,球状体在存在或不存在测试化合物的情况下在培养物中保存24小时(图2)。ADCC的定量基于使用高内涵分析系统检测凋亡癌细胞死亡(膜联蛋白V染色)。
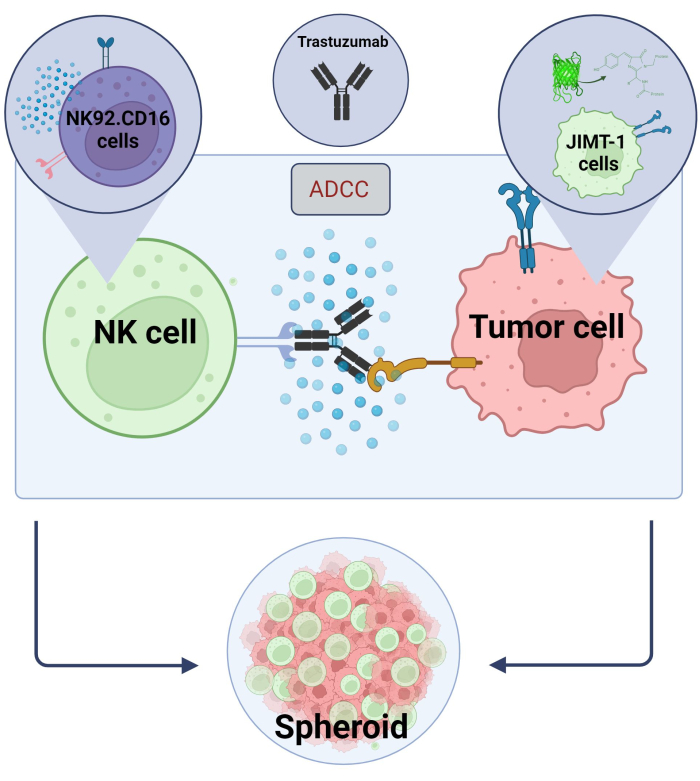
图2.3D 球状体共培养系统中的 ADCC。 我们的实验设置基于3D球体系统,与2D模型相比,该系统可以更准确地模拟 体内 微环境。将JIMT-1 EGFP乳腺癌细胞接种在凹形细胞驱避剂底部,形成圆形细胞簇,称为球状体。然后通过添加NK92启动ADCC。CD16 自然杀伤细胞 (E:T 比 = 20:1) 和抗 HER2 单克隆抗体曲妥珠单抗。该实验模型已被证明是有效的,并且易于用于鉴定ADCC修饰测试化合物(使用 Biorender.com 创建的图像)。 请点击这里查看此图的较大版本.
我们证明,以这种方式获取数据可以实时完成,并且在统计学上适用于癌症药物发现中的高内涵筛选。重要的是,该模型允许对更多的化合物进行扩展验证,并且可以应用于多种感兴趣的测定。
Protocol
Representative Results
Discussion
尽管在过去几十年中,BC的治疗有了显着改善,但患者仍然经常出现耐药性或出现负面副作用24。与 BC 相关的高发病率和死亡率要求继续研究潜在的分子机制,就像强大的筛选平台以确定可用于治疗开发的新分子一样 25.这些策略需要基于细胞培养的转化检测。3D肿瘤培养系统,如球状体和肿瘤类器官,最近已成为低成本、易于实施的模型,与传统的单层培养相?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
LV获得了国家研究、开发和创新办公室的资助,资助GINOP-2.3.2-15-2016-00010 TUMORDNS“,GINOP-2.3.2-15-2016-00048-STAYALIVE,OTKA K132193和K147482。该项目已获得匈牙利-匈牙利任研究网络的资助。CD16.176V.NK-92 细胞从 Kerry S. Campbell 博士(宾夕法尼亚州费城福克斯蔡斯中心,代表 Brink Biologics, lnc.San Diego, CA)受全球专利保护,并由 Nantkwest, lnc 授权。(www.nantkwest.com)。作者感谢 György Vereb 和 Árpád Szöőr 在使用 NK-92 细胞系和 TR-F(ab’)2 方面的帮助,以及技术建议。
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
References
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

