Количественная оценка антителозависимой клеточной цитотоксичности в модели сфероида опухоли: заявка на разработку лекарственного препарата
Summary
В этой статье мы представляем метод идентификации соединений, которые модулируют механизм ADCC, важный механизм уничтожения раковых клеток противоопухолевыми антителами. Цитотоксический эффект NK-клеток измеряется в сфероидах клеток рака молочной железы в присутствии трастузумаба. Анализ изображений позволяет идентифицировать живые и мертвые клетки-убийцы и клетки-мишени в сфероидах.
Abstract
Иммунотерапия на основе моноклональных антител, нацеленная на опухолевые антигены, в настоящее время является основой лечения рака. Одним из клинически значимых механизмов действия антител является антителозависимая клеточная цитотоксичность (ADCC), при которой антитело связывается с раковыми клетками и вовлекает клеточный компонент иммунной системы, например, естественные клетки-киллеры (NK), для уничтожения опухолевых клеток. Эффективность этих методов лечения может быть повышена путем выявления адъювантных соединений, которые повышают чувствительность раковых клеток или эффективность иммунных клеток. Кроме того, необнаруженные лекарственные взаимодействия у онкологических больных, получающих сопутствующие препараты в связи с предыдущими заболеваниями или симптомами, связанными с раком, могут определять успех терапии антителами; Поэтому такие нежелательные лекарственные взаимодействия необходимо устранить. С этими целями мы создали модель ADCC рака и описали здесь простой протокол для поиска ADCC-модулирующих препаратов. Поскольку 3D-модели, такие как сфероиды раковых клеток, превосходят 2D-культуры в прогнозировании in vivo ответов опухолей на противоопухолевую терапию, сфероидные кокультуры EGFP-экспрессирующих HER2+ JIMT-1 клеток рака молочной железы и NK92. Клеточные линии CD16 были созданы и индуцированы трастузумабом, моноклональным антителом, клинически одобренным против HER2-положительного рака молочной железы. Сфероидам JIMT-1 было позволено формироваться в клеточных репеллентных 96-луночных планшетах с U-образным дном. На 3-е сутки добавляли NK-клетки и трастузумаб. Затем сфероиды окрашивали аннексином V-Alexa 647 для измерения апоптотической гибели клеток, которую количественно определяли в периферической зоне сфероидов с помощью автоматизированного микроскопа. Применимость нашего анализа для идентификации ADCC-модулирующих молекул демонстрируется на примере того, что сунитиниб, рецепторный ингибитор тирозинкиназы, одобренный FDA против метастатического рака, почти полностью отменяет ADCC. Генерация сфероидов, а также конвейеры получения и анализа изображений совместимы с высокопроизводительным скринингом ADCC-модулирующих соединений в сфероидах раковых клеток.
Introduction
Многоклеточные опухолевые сфероиды (MCTS) представляют собой широко используемые трехмерные (3D) модели, которые формируются из-за тенденции адгезивных клеток к агрегации и представляют собой важный инструмент для получения механистического понимания биологии раковых клеток. Они могут быть получены из широкого спектра типов клеток с помощью многочисленных методов, таких как 3D-культуры на основе жидкости и каркаса1. Их основное преимущество перед монослойными 2D-моделями заключается в том, что они повторяют основные особенности опухолей in vivo, а именно структурную организацию и гипоксию, имитируя биологическое поведение опухолевых клеток, особенно механизмы, приводящие к терапевтическому бегствуи лекарственной устойчивости. Таким образом, поскольку MCTS могут улучшить предсказуемость токсичности и чувствительности к лекарственным препаратам, они широко используются для изучения рака в 3D и могут способствовать разработке эффективных лекарств для различныхтипов рака.
Для изучения любого заболевания существует острая потребность в актуальных и удобных моделях. Создание моделей для иммунологических исследований рака является сложной задачей, поскольку иммунная система состоит из нескольких типов клеток. Каждый тип клеток имеет несколько подтипов и широкий спектр состояний активации. Эти различные типы иммунных клеток взаимодействуют с раковыми клетками и другими опухолевыми компонентами, в конечном итоге влияя на исход заболевания. Двухмерные методы культивирования клеток in vitro не позволяют повторить эти сложные клеточные взаимодействия, поскольку им не хватает транслятивности, и они не могут предсказать действие лекарственного препарата на системном уровне (например, в тканях)4,5. Более того, мышиные модели также имеют серьезные ограничения из-за фундаментальных различий между иммунной системой человека и мыши. Таким образом, системы 3D-культивирования могут заполнить существующие пробелы в имеющихся моделях, предоставляя альтернативный метод и улучшая наше понимание иммунологии рака. В частности, сфероидные модели могут быть использованы для тестирования иммунотерапии, главным образом для оценки эффективности скрининга лекарственных средств и терапевтических антител для усиления инфильтрации иммунных клеток и противоопухолевых эффектов в отношении сфероидных мишеней7. Кроме того, потенциал MCTS, состоящего из клеток, находящихся в различных метаболических и пролиферативных состояниях, для изучения взаимодействий между клетками стромы (например, лимфоцитами, макрофагами, фибробластами) и раковыми клетками, а также для разработки новых противоопухолевых стратегий8. Следовательно, существует насущная необходимость в подтверждении прогностических и точных платформ для ускорения процесса тестирования лекарственных средств с учетом патофизиологии микроокружения опухоли.
Рак молочной железы (РМЖ) является наиболее частым онкологическим заболеванием, диагностируемым у женщин во всем мире. Клиническая классификация этого гетерогенного заболевания основана на наличии трансмембранных рецепторов, например, рецепторов эстрогена (ER) и прогестерона (PR) (в совокупности называемых рецепторами гормонов, HR), а также на гиперэкспрессии или амплификации белка/онкогена рецептора эпидермального фактора роста человека 2 (HER2). На основании иммуногистохимической экспрессии этих рецепторов обычно выделяют четыре подтипа: люминальный А (HR+/HER2-), люминальный B (HR+/HER2+), HER2-положительный (HR-/HER2+) и трижды негативный рак молочной железы (HR-/HER2-). Группа HER2+ составляет 10-15% случаев РМЖ и характеризуется высокой экспрессией HER2 при отсутствии ЭР и ПР, имеет худший прогноз по сравнению с люминальными опухолями и требует специфических препаратов, направленных против белка HER2/neu9.
Развитие РМЖ является многоступенчатым процессом, и ранняя диагностика имеет важное значение для успешного лечения заболевания10. Однако, несмотря на недавно появившиеся персонализированные варианты лечения РМЖ (например, эндокринная терапия и терапия антителами к HER2), РМЖ продолжает бросать вызов онкологам. Так же, как хирургия, химиотерапия и лучевая терапия, эти персонализированные методы лечения также могут иметь серьезные побочные эффекты, и у пациентов может развиться резистентность к этим препаратам, что делает определение наилучшейстратегии в долгосрочной перспективе сложной задачей. Следовательно, улучшение понимания взаимодействия между опухолью и ее микроокружением имеет важное значение и, как ожидается, обеспечит новые направления для разработки новых методов лечения, учитывающих специфику различных подтипов РМЖ13. Новая волна иммунотерапии, такая как конъюгаты антител, адоптивная Т-клеточная терапия, вакцины и новые моноклональные антитела (мАТ), направленные на HER2, изучается в широкой популяции пациентов с опухолями, экспрессирующими HER214.
Трастузумаб, например, представляет собой эффективный метод лечения HER2+ РМЖ. В рамках механизма действия трастузумаб опосредует фрагментарную кристаллизующийся гамма-рецептор (FcγR)-зависимую активность. FcγR отличаются своим сродством к Fc-фрагменту и иммунным ответом, который они инициируют. Активация FcγRIIIa (CD16A) на естественных клетках-киллерах (NK) имеет решающее значение для опосредования антителозависимой клеточной цитотоксичности (ADCC), в то время как активация FcγRIIa (CD32A) и FcγRIIIa на макрофагах индуцирует антителозависимый клеточный фагоцитоз (ADCP)15. Исследования на животных моделях показали, что мыши, у которых отсутствовали рецепторы FcγRI (CD64) и FcγRIII (CD16), не могли инициировать защитный иммунный ответ против опухолеспецифических антигенов, что показало, что ADCC, вероятно, является основным механизмом действия mAb трастузумаба16.
Поскольку NK-клетки прибегают к связанным с опухолевыми клетками Abs для уничтожения раковых клеток с помощью ADCC, экспрессия Fc-рецепторов имеет решающее значение для эффективного лечения трастузумабом17 (рис. 1). Кроме того, их действие эффективно уравновешивается стимуляцией активирующих и тормозящих рецепторов, например, иммуноглобулиноподобных рецепторов клеток-киллеров (KIR)18.
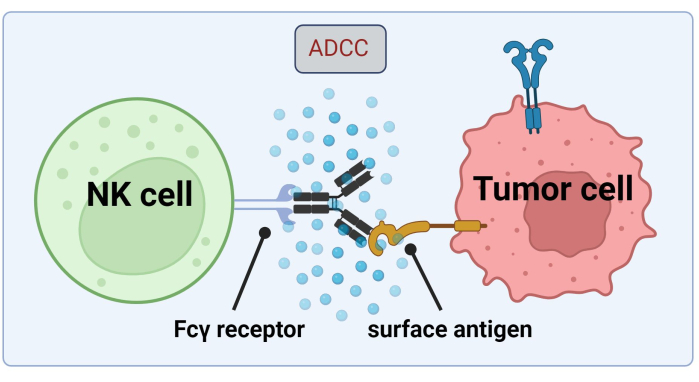
Рисунок 1. Механизм ADCC в контексте противоопухолевого ответа. Рецептор Fcγ естественной клетки-киллера (NK) распознает Fc-участок антитела, который ранее связывался с поверхностным антигеном на раковой клетке. Этот иммунологический синапс приводит к дегрануляции NK-клетки, которая высвобождает цитотоксические медиаторы, такие как гранзимы и перфорин. Эти молекулы способствуют образованию пор в клеточной мембране и активируют апоптотические пути, вызывая запрограммированную гибель клетки-мишени (изображение, созданное с помощью Biorender.com). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Разработка иммунотерапии HER2+ BC представляет собой развивающуюся область. При этом следует учитывать взаимодействия между различными компонентами иммунной системы. Кроме того, в предыдущих публикациях проводилось всестороннее тестирование комбинированной терапии, включающей все виды традиционной, иммунной или клеточной терапии, для выявления синергетических комбинаций19.
Несколько 3D-моделей HER2+ BC ранее использовались для разработки новых лекарственных препаратов. Например, Балалаева и др. использовали сфероиды SKBR-3, гиперэкспрессирующие HER2, для оценки цитотоксичности HER2-таргетного иммунотоксина 4D5scFv-PE4020. В другом исследовании была создана 3D-система культивирования HER2+ BC на основе Matrigel для измерения роста клеток в ответ на трастузумаб и эндокринные агенты21. Эти исследования подчеркивают важность опухолевой сфероидной модели гиперэкспрессии раковых клеток HER2 в представлении эффективной стратегии клинического улучшения терапевтических ответов22.
Наша группа ранее идентифицировала сунитиниб, многоцелевой ингибитор тирозинкиназы, в качестве ингибитора трастузумаб-зависимого ADCC в клетках JIMT-1 HER2+ BC в 2D-культуральном анализе. Исследование показало, что сунитиниб индуцирует аутофагию и нарушает функцию уничтожения NK-клеток, подавляя экспрессию HER2 и усиливая поверхностное прикрепление клеток JIMT-117.
Здесь мы создали новую 3D-модель сфероида ADCC (раковые клетки NK.92.CD16+Трастузумаб+JIMT-1-EGFP), которая будет использоваться для высокопроизводительного скрининга, а для подтверждения вышеупомянутых результатов в качестве модельного соединения был использован сунитиниб. Во-первых, мы сгенерировали EGFP, экспрессирующий клетки JIMT-117 , и вырастили сфероиды из этих клеток. ADCC индуцировали NK-клетками вместе с трастузумабом, а сфероиды хранили в культуре в присутствии или отсутствии исследуемых соединений в течение 24 ч (рис. 2). Количественная оценка ADCC основана на выявлении апоптотической гибели раковых клеток (окрашивание Annexin V) с помощью системы High-Content Analysis.
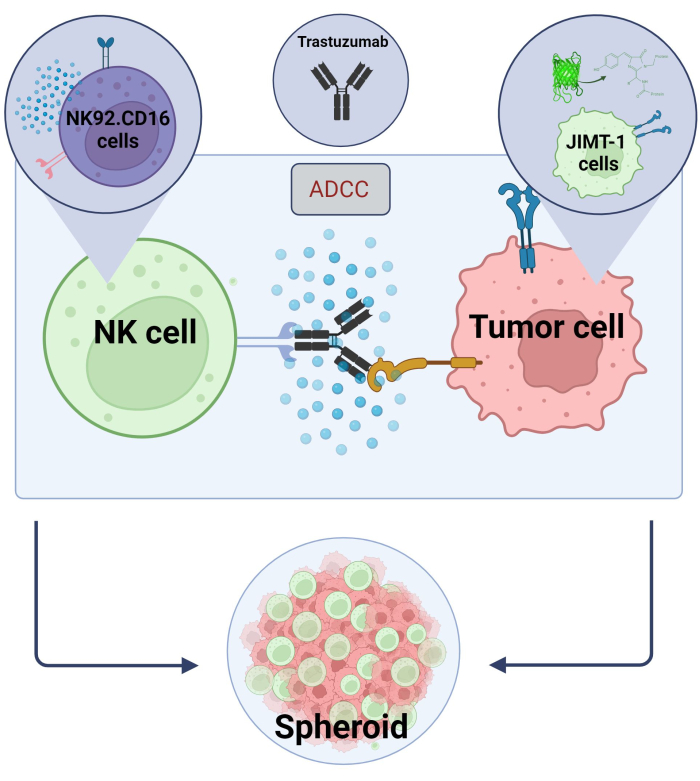
Рисунок 2. ADCC в системе кокультивирования 3D сфероидов. Наши экспериментальные установки основаны на 3D-сфероидной системе, которая может более точно моделировать микроокружение in vivo по сравнению с 2D-моделями. Клетки рака молочной железы JIMT-1 EGFP были высеяны на вогнутое клеточное репеллентное дно, чтобы сформировать клеточный кластер круглой формы, называемый сфероидом. Затем был инициирован ADCC путем добавления NK92. CD16 естественные клетки-киллеры (соотношение E:T = 20:1) и моноклональное антитело против HER2, трастузумаб. Экспериментальная модель оказалась эффективной и легко применимой для идентификации ADCC-модифицирующих испытуемых соединений (изображение, полученное с помощью Biorender.com). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Мы продемонстрировали, что получение данных таким образом может быть выполнено в режиме реального времени и является статистически надежным для использования в скрининге с высоким содержанием при разработке лекарств от рака. Важно отметить, что эта модель позволяет проводить расширенную валидацию большего набора соединений и может быть применена к нескольким анализам, представляющим интерес.
Protocol
Representative Results
Discussion
Несмотря на значительные улучшения в лечении РМЖ за последние несколько десятилетий, у пациентов по-прежнему регулярно развивается лекарственная устойчивость или возникают негативныепобочные эффекты. Высокая заболеваемость и смертность, связанные с РМЖ, требуют продол?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
LV получил финансирование по грантам Национального управления исследований, разработок и инноваций GINOP-2.3.2-15-2016-00010 TUMORDNS», GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 и K147482. Этот проект получил финансирование от Венгерской исследовательской сети HUN-REN. Клетки CD16.176V.NK-92 были получены у д-ра Керри С. Кэмпбелла (Fox Chase Center, Филадельфия, Пенсильвания, по заказу компании Brink Biologics, lnc. Сан-Диего, Калифорния), защищены патентами по всему миру и были лицензированы Nantkwest, lnc. (www.nantkwest.com). Авторы выражают благодарность Дьёрдю Веребу (György Vereb) и Арпаду Шёору (Árpád Szöőr) за помощь в использовании клеточной линии NK-92 и TR-F(ab’)2, а также за технические консультации.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
References
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

