Overview
ソース: 博士ニール エイブラムスの研究室-環境科学および林業のニューヨーク州立大学
すべての化学反応は、反応しようとして製品の進行状況の定義特定率を持っています。この率は、温度、濃度、反応の物理プロパティによって影響があります。料金は、中間体や遷移状態が形成されるが、反応も製品にも含まれます。率法は反応の各反応の役割を定義し、続行する反応に必要な時間を数学的にモデル化するために使用できます。レート方程式の一般的な形は以下のとおりです。
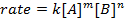
AとBが異なる分子種、 mとnの濃度を反応注文、 kは速度定数。ほぼすべての反応の速度は反応物質が枯渇している、有効な衝突が発生する可能性が低くを作るよう経年変化します。ただし、速度定数は、特定の温度における単一の反作用のため固定されています。反応次数は、反応に関与する分子種の数を示しています。率法、実験的に決定することができますのみ速度定数と反応順序などを知ることが非常に重要です。この実験では、探索率の法律を決定する 1 つの方法、化学反応の進行状況を理解するために使用します。
Principles
反応速度論と熱力学
すべての化学反応は、熱力学、速度論 2 つの要因によって支配されます。熱力学的要因は、化学反応時に放出される自由エネルギーの違いです。自発性と呼ばれる、この自由エネルギー、エンタルピー (熱) と化学反応のエントロピー (障害) から生じる複雑な値です。反応は化学反応のシステムが平衡に達するとどのように高速レートを指します。反応では、反応の速度を説明できる、熱力学にそのエネルギーに関する情報が得られます。簡単に言えば、安定性に関連している熱力学と反応性に関連する速度。
速度を決定します。
率は時間ベースの計測、反応が進むにつれて、それは常に変化を意味します。これは、時間の変化に対する濃度の変化を表現する微分率法を使用して表現できます。実験的に、微分法は微積分を使用でき、微分法を統合することにより、統合法として率法を表すので、使用することは困難。統合率法は、反応の濃度、反応の開始時に、指定した時間間隔でを表します。注文、レート法、および統合法の表を次に示します。

各注文では、反応物濃度と反応速度の依存性について説明します。Zeroth 順序法、レート = k速度は速度定数に反応物質の濃度ではなく、依存だけことを示します。これは、触媒は、固体表面のエリアは反応中に変更されません触媒反応で共通です。1st注文率法は、他の反応があるかもしれないが、率が 1 つの反応物の濃度に依存して示しています。2ndオーダー率法は、レートが反応の 2 つの反応の濃度に依存していることを示します。これらの反応は同じ、すなわち速度をすることができます = k[A]2、または別、料金 = k[] [B]。以来、2 つの濃度は常に変化して、第 2 順序率の定数が実験室で測定することは困難することができます。データを可能にする、データ分析を容易統合率の法律を使用して、順序に関係なくプロットとデータに合わせて線形方程式を適用します。以来、1 つだけ統合法データが収まるが、反応の速度定数と反応順序をすぐに識別できます。
反応速度論の実験
率の法律を決定する化学反応の反応速度論の実験の設定から始まります。反応速度論の実験は、測定は時間をかけて種の濃度の変化を決定するために一定の間隔で行われるように、慎重に制御されます。種もある (時間による濃度の減少) 反応物 (時間と濃度を増加させる) 製品。複数の反応が関与している場合も 1 つだけ反応物の濃度が時間とともに変化することが非常に重要です。研究されている反応体よりはるかに高い他の反応物の濃度を増加させると、実験中に 1 つだけ反応物の濃度が変更されたように見えてしまいます。
この実験では、プラチナ触媒を用いる過酸化水素の触媒分解が検討されます。プラチナ触媒である、ので 1 つだけ種は以下の反応によると 2 つの製品に分解した関与しています。
2 H2O2(aq) → O2(g) + 2 H2O(l)
製品、O2の一つは、ガスは、時間の経過とともにシステムの圧力の増加を測定できると理想気体の法則 (PV = nRT) モグラに圧力を関連付けるために使用します。反応液の濃度の異なるいくつかの完了は、反作用の順序および率の法則を解決できます。
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. 準備 H2O2希釈
- 株式 3% 過酸化水素 0.176 M (表 1) 0.882 M に至る 0.882 M. 準備 5 希釈の濃度があります。これらのソリューションを用いて、準備が、溶質は非常に希薄であり大量の水が相加的準備添加物。
- 恒温水槽にソリューションを配置または室温で平衡にベンチの上に置いておく。温度範囲は 20-25 ° C (293-298 K) はこの反応に適しています。

表 1。H2O2ソリューションを使用します。
2. 反応容器の準備
- 反応容器の体積を特定、上部に大型試験管を水で満たし、テスト チューブまでしっかりと水に 1 穴ゴム栓を挿入するには、側面を上部をプッシュします。
- ストッパーを外し、水の正確な量を決定するためのメスシリンダーに水を注ぐ。これは反作用の容器 (試験管) の合計量です。
3. 酸素の放出の測定
- 最初過酸化水素溶液 50 mL に水を取り替えるし、風呂の水に戻します。平衡、一度プラチナ コーティング反応ディスクを追加し、ガス圧センサーに接続されているストッパー付きシステムをシールします。これらのディスクは、コンタクト レンズの洗浄システムで通常使用されます。
- 圧力センサーがセットアップ 2 点/秒でデータを集録すると、120 の実験の実行 s。この実験にはバーニア ガス圧力センサー、GPS BTA をお勧めします。
- 過酸化水素は酸素と水に分解されますので、泡を観察すべき。圧力を解放、ソリューション、リンス、処分および次の過酸化水素のソリューションを置き換えます。ガス圧力測定を繰り返して、すべてのソリューションをテストします。
4. データ解析
- スプレッドシート プログラムに対時間圧力のすべてのデータ ファイルを転送します。
- 初期料金を決定する-過酸化水素の濃度が実験の短い期間の間に多くを変更していないことを前提としています。データは、反応速度論の実験の初期の線形領域を表します。
- 圧力対時間をプロットし、斜面を利用して勾配を決定する数式または線形回帰。任意の共通の単位の圧力をプロットします。
- 斜面は、O2/s の圧力の単位での初期速度です。
- 反応次数を決定します。
- 進化した O2の圧力が直接分解 H2O2のモルに比例して、ので、0 ln [H2O2] 対 ln (初期速度) をプロット反応順序と同じ斜面を生成します。過酸化水素、[H2O2]0での最初の集中は、各試験に使われていたものです。
- 率法の方程式は、
 。線形方程式を生成する式の自然対数 (ln) を取って
。線形方程式を生成する式の自然対数 (ln) を取って 、 m斜面は反作用の順序。
、 m斜面は反作用の順序。
- 率法の方程式は、
- 進化した O2の圧力が直接分解 H2O2のモルに比例して、ので、0 ln [H2O2] 対 ln (初期速度) をプロット反応順序と同じ斜面を生成します。過酸化水素、[H2O2]0での最初の集中は、各試験に使われていたものです。
- 速度定数、 kを決定します。
- 各試行の率、PO2/s 単位に変換 atm/s の場合は率はトル/s など別の単位で。
- 泡は、水溶液中で進化した、各システムの圧力からの水の蒸気圧を差し引きます。新しい率は、酸素の放出のための圧力のみを反映しています。
- 各試行におけるモル/s atm/s から速度に変換する理想気体法律を適用します。
- 太陽光発電を再配置成田 → n の = = PV/RT。S-1単位は変更されません。ボリュームは解決の容積 (50 mL) マイナス試験管ボリュームと同等です。
- 各試行における分解の過酸化水素のモグラに発生する酸素のモルから変換するには、バランスの取れた化学反応を使用します。
- H2O2のモルを除算 0.050 L、H2O2秒、[H2O2] 分解のモル濃度をもたらすソリューションのボリューム/s。
- この実験は最初順序の動力学、ために分割率、[H2O2]/s、各トライアル [H2O2]0、速度定数、 kを生成する元の溶液濃度。速度定数のこのソリューションは、以前決定した反応順序多少異なります。
- 温度は一定なので、各試験のための速度定数を一緒に平均します。
すべての化学反応は、製品への反応の早変わりを定義する特定の率を持っています。
化学反応は、2 つの要因によって支配される: 速度論と熱力学。熱力学的要因アカウントかどうか反応が発生し、それを吸収するまたは処理中にエネルギーを放ちます。
反応は化学反応のシステムが平衡に達するとどのように高速レートを指します。反応の速度は、反応速度定数、成分、濃度および反作用の順序に基づいてレートを定義するキネティック レート法によって記述されます。
このビデオは、レート法方程式を用いた反応速度論を紹介し、実験室である特定の反作用の率の法律を決定する方法を示します。
一般的な反応の反応速度に等しい濃度、反応時間、速度定数、反応次数にそれぞれ引き上げ。速度定数、k は固定特定の温度で反応。
反応の注文は、化学量論的な係数の独立しています。代わりに彼らは反応機構に依存している、反応体の集中率がどのように関連しているかを示します。たとえば、反応速度が変更されて場合とき」、「ダブルスでは、反応の濃度は濃度に依存しないし、順序はゼロ。
反応"A"の濃度が倍増するとき速度が 2 倍になる場合、反応は最初順序 A同じ動作反応"B"です。反応の全体の順序は、各反応の個々 の反応の注文の合計です。
、反作用の間に反応物の濃度は時間とともに変化します。注意: 方程式を基本に評価変数としての時間は含まれません、率および特定の時点で濃度だけ関連付けることができます。ただし、レートの変更反応が進むし、反応が枯渇しています。差分率法を用いた時間濃度の変化を関連付けることができます。
反応速度法を実験的に決定する必要があります化学反応が一定に慎重に制御されている反応や製品の濃度と温度、測定した特定の時間間隔で。離散時間で濃度測定を行うので、微分法は実験データと関連付けるにくいです。
単純な方程式の差分率法結果を統合すると、統合率法と呼ばれます。統合率法は、反応の開始と指定された時の反応物濃度を比較します。
統合率法方程式は、反応の順序によって異なります。これらの方程式は線形形式 y を取ることができる = mx+b と。したがって、濃度対時間のプロット利回りゼロの順序の方程式の線形プロット、濃度対時間の自然対数のプロット 1 次方程式の線形プロットが得られます。これらの方程式の実験データを当てはめによる反応の順序を容易に決定できます。速度定数、k、決定されると、直線の傾きを使用しています。最後に、k の単位は反作用の順序によって異なります。ゼロの順序の反作用のため単位がモル リットル毎秒、最初順序反作用のため単位逆秒、第 2 順序の反作用の単位モル毎秒リットル。
今運動率の法律の基礎が説明されていることができます実験的過酸化水素水と酸素への分解の率の法律を決定する方法を見てみましょう。
この実験では、プラチナ触媒を用いる過酸化水素の触媒分解が検討されます。
表に示すように、まず、過酸化水素の 5 希釈液を準備します。この場合、0.882-0.176 M の濃度範囲は、3% または 0.882 M 原液を使用します。部屋の温度平衡にソリューションを許可します。
次に、試験管を使用して反作用の容器を準備します。まず上部に大型試験管を充填水によるボリュームを決定します。タイトだし、上部に穴から水が押し出されるまで、1 穴ゴム栓を挿入します。
ストッパーを削除し、正確な量を測定するメスシリンダーに水を注ぐ。これは、反応容器の量です。
次に、テスト チューブに最初過酸化水素溶液 50 mL を入れて、25 ° C の水浴中チューブを置きます。平衡、一度プラチナ コーティング反応ディスクを追加し、ガス圧センサーに接続されているストッパー付きシステムをシールします。
製品の 1 つは酸素ガスなので、システムの圧力の増加、酸素の増加を測定する使用されます。S、あたり 2 ポイントでデータを集録する圧力センサーの設定、過酸化水素を酸素と水に分解、120 s. 泡の実験を表示するかを実行します。
反応期間が終わったら、圧力を解放および過酸化水素の溶液の廃棄します。チューブをリンスし、次の過酸化水素で管を埋めます。すべてのソリューションに対してガス圧力測定を繰り返します。
各ソリューションの時データ対圧力をプロットします。進化した酸素の圧力は理想気体法律に従って形成される酸素のモルに直接比例します。次の化学反応形成酸素のモルは分解の過酸化水素のモルの計算に使用できます。まず、過酸化水素の濃度が、実験の短い期間中に大幅変更だったことと仮定します。したがって、プロットされたデータは、反応速度論の実験の初期領域だけを表します。
線形回帰を使用して各データ セットの傾きを決定します。勾配は、1 秒あたりの酸素の圧力の単位で初期の反応速度と同じです。
次に、最初の反応速度対の自然対数の初期の過酸化水素濃度の自然対数をプロットします。斜面が反応次数と等しい m、約 1 つに相当します。したがって、反応は最初の注文であります。
各試験の速度は、1 秒あたり Torr の圧力の単位です。速度定数を決定するには、まず速度を 1 秒あたりの気圧の単位に変換します。泡は、水溶液中で進化して、各システムの圧力からの水の蒸気圧を差し引きます。新しい率は、酸素の放出のための圧力をのみ反映します。
各試行の s あたりのモルに自体雰囲気からレートを変換する理想気体法律を適用します。2 回発生する酸素のモルは化学反応の化学量論によると、分解の過酸化水素のほくろと同じです。その後、速度の単位をモル毎秒に変換するのに反応ボリュームを使用します。
初期濃度モル s あたりの率で割って各試験のための速度定数を決定します。この実験で、平均速度定数、k は約 1.48 秒あたり 10-4 x。反応が自然対数 - から知られている最初の注文前に示した自然対数プロット。したがって、レート法は示すように記述できます。
今では、化学反応の率の法律を決定する方法を見ては、この概念が適用されるいくつかのエリアを見てみましょう。
化学反応、化合物および科学的アプリケーションの広い範囲で使用される材料の合成に使用されます。反応の進行状況を制御するためにこれらの合成のステップで反応速度を理解することが重要です。
たとえば、カドミウムのセレン化物ナノ結晶とナノロッドの合成は、一連の化学反応を処理します。独自の離散反応であり、したがって合成手順は注意深くコントロールされて、反応の知識の速度に基づいて各反応いくつかゆっくりといくつかの非常に速い。
反応率法は、放射性崩壊を記述するためにも使用でき、放射性物質の半減期を決定します。半減期は、初期濃度の半分に該当する物質の濃度に必要な時間の量を指します。
放射能は、における反応次数は最初、意味、安全な崩壊への放射性物質の時間レベル特徴付けることができる非常によく、放射性物質及び放射性廃棄物の適切な輸送・保管を有効にするに従います。
放射性物質と同様に、薬も半減期があるし、体が低下します。たとえば、いくつかの薬には、高速度定数、彼らがすぐに低下して、頻繁に取得する必要がありますを意味があります。この低下率の知識は、適切な投与量、使用法および配信法の定量を可能.
反応速度のゼウスの概要を見てきただけ。今化学反応の順序が異なって、化学反応速度にどのように関係し、研究室では、特定の化学反応の率の法律を決定する方法を理解する必要があります。
見てくれてありがとう!
Subscription Required. Please recommend JoVE to your librarian.
Results
酸素進化データと初期料金

図 1。一定した温度で各試験の時データ対圧力します。斜面は、瞬時の反応率と同じです。
反応次数
- 5 つの試練と斜面を使用してグラフのデータを (表 2、図 2) 以下に集計です。0.9353 ≈ 1 の斜面は、反応次数は整数値です。

表 2。5 H2O2試験からの結果。

図 2。レート対濃度の自然対数プロット。斜面は反作用の順序と同じです。
速度定数k
- Mol O2/s 18.7 torr 294 K (反応速度論の実験の温度)、水の蒸気圧を引いたによって理想気体の法則を使用して速度を計算します。
- 速度定数を計算する [H2O2]0の初期濃度によって率、[H2O2]/s を割る。

表 3。速度定数、 kの計算。
- 平均速度定数 10-4の-1 x 2.25 は、反応が単位に基づき、最初の順序を示します。として速度法を書き換えることができます: 率 = 10-4の-1[H2O2]0x2.25
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
率法の変数を決定する数学的に関与することができます、メソッドが実際に非常に簡単です。反応物の消失や製品の外観を測定することができます、限り率プロットを速度定数の計算に使用できます。このメソッドの拡張率を測定し、いろいろな温度で速度定数を計算することで Eの反応の活性化エネルギーを判断するされます。このメソッドでは、アレニウスの式、 kを使用 Ae =(-Ea/RT)。反応次数を含む率法を組み合わせて活性化反応のエネルギーは、どのように高速 (または遅く) 反応の完全運動プロファイル進行し、温度のような要因がどのように現実世界について説明しますを提供し、濃度はその反応に影響を与えます。
化学反応速度論は、産業や医薬品、原子力安全、環境修復、日焼け止めなど様々 な分野のアプリケーションを見つけます。たとえば、特定の薬剤は、非常に大きな速度定数, それは非常に迅速に体内崩壊を意味があります。これは、使用量、投与、および配信方法に影響します。原子力科学に関して放射能核物質安全なレベルに減衰するために必要な時間が非常によく特徴付けられることを意味の一次反応に従います。測定は非常にここで紹介した方法のようになるし、また多くの環境汚染物質の腐食に適用する可能性があります。同様に、日焼け止めも崩壊を知られているキネティック プロファイル メーカーは消費者に通知することができますどのようにすぐに日焼け止めを安全なレベルを維持するために適用する必要があります。
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).



 。線形方程式を生成する式の自然対数 (ln) を取って
。線形方程式を生成する式の自然対数 (ln) を取って 、 m斜面は反作用の順序。
、 m斜面は反作用の順序。