Création d'une colonne de Winogradsky : une méthode pour enrichir les espèces microbiennes dans un échantillon de sédiments.
English
Share
Overview
Source: Elizabeth Suter1, Christopher Corbo1, Jonathan Blaize1
1 Département des sciences biologiques, Wagner College, 1 Campus Road, Staten Island NY, 10301
La colonne Winogradsky est un écosystème miniature et clos utilisé pour enrichir les communautés microbiennes des sédiments, en particulier celles qui participent au cycle du soufre. La colonne a été utilisée pour la première fois par Sergueï Winogradsky dans les années 1880 et a depuis été appliquée dans l’étude de nombreux micro-organismes divers impliqués dans la biogéochimie, tels que les photosynthétiseurs, les oxydants de soufre, les réducteurs de sulfate, les méthanogènes, les oxydants de fer, l’azote cyclistes, et plus (1,2).
La majorité des micro-organismes sur Terre sont considérés comme inexplicables,ce qui signifie qu’ils ne peuvent pas être isolés dans un tube à essai ou sur un plat de Pétri (3). Cela est dû à de nombreux facteurs, y compris que les micro-organismes dépendent d’autres pour certains produits métaboliques. Les conditions d’une colonne Winogradsky imitent étroitement l’habitat naturel d’un micro-organisme, y compris leurs interactions avec d’autres organismes, et permettent de les cultiver en laboratoire. Par la présente, cette technique permet aux scientifiques d’étudier ces organismes et de comprendre à quel point ils sont importants pour les cycles biogéochimiques de la Terre sans avoir à les cultiver isolément.
Les environnements de la Terre sont pleins de micro-organismes qui prospèrent dans tous les types d’habitats,tels que les sols, l’eau de mer, les nuages et les sédiments des eaux profondes. Dans tous les habitats, les micro-organismes dépendent les uns des autres. Comme un micro-organisme se développe, il consomme des substratsparticuliers , y compris les combustibles riches en carbone comme les sucres ainsi que les nutriments, vitamines et gaz respiratoires comme l’oxygène. Lorsque ces ressources importantes s’épuisent, différents micro-organismes ayant des besoins métaboliques différents peuvent alors fleurir et prospérer. Par exemple, dans la colonne Winogradsky, les microbes consomment d’abord la matière organique ajoutée tout en appauvrissant l’oxygène dans les couches inférieures de la colonne. Une fois que l’oxygène est utilisé, les organismes anaérobies peuvent alors prendre le relais et consommer différentes matières organiques. Ce développement consécutif de différentes communautés microbiennes au fil du temps s’appelle la succession (4). La succession microbienne est importante dans une colonne Winogradsky, où l’activité microbienne modifie la chimie des sédiments, ce qui affecte ensuite l’activité d’autres microbes et ainsi de suite. De nombreux micro-organismes dans les sols et les sédiments vivent également le long des gradients,qui sont des zones transitoires entre deux types différents d’habitats en fonction des concentrations de substrats (5). Au bon endroit dans le gradient, un microbe peut recevoir des quantités optimales de différents substrats. Au fur et à mesure qu’une colonne Winogradsky se développe, elle commence à imiter ces gradients naturels, en particulier dans l’oxygène et le sulfure (fig. 1).
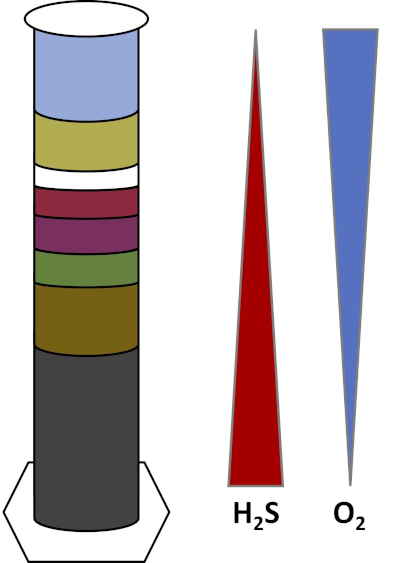
Figure 1 : Représentation des gradients d’oxygène (O2) et de sulfure (H2S) qui se développent dans une colonne Winogradsky.
Dans une colonne Winogradsky, la boue et l’eau d’un étang ou d’une zone humide sont mélangées dans une colonne transparente et autorisées à incuber, généralement dans la lumière. Des substrats supplémentaires sont ajoutés à la colonne pour donner à la communauté des sources de carbone, généralement sous forme de cellulose, et de soufre. Les photosynthétiseurs commencent généralement à pousser dans les couches supérieures des sédiments. Ces micro-organismes photosynthétiques sont en grande partie composés de cyanobactéries,qui produisent de l’oxygène et apparaissent sous forme de couche verte ou rouge-brun (fig. 2, tableau 1). Bien que la photosynthèse produise de l’oxygène, l’oxygène n’est pas très soluble dans l’eau et diminue en dessous de cette couche (fig. 1). Cela crée un gradient d’oxygène, allant de fortes concentrations d’oxygène dans les couches supérieures à zéro oxygène dans les couches inférieures. La couche oxygénée est appelée la couche aérobie et la couche sans oxygène est appelée la couche anaérobie.
Dans la couche anaérobie, de nombreuses communautés microbiennes différentes peuvent proliférer selon le type et la quantité de substrats disponibles, la source des microbes initiaux et la porosité des sédiments. Au bas de la colonne, les organismes qui décomposent anaérobiement la matière organique peuvent prospérer. La fermentation microbienne produit des acides organiques à partir de la dégradation de la cellulose. Ces acides organiques peuvent ensuite être utilisés par les réducteurs de sulfate,qui oxydent ces matières organiques à l’aide de sulfate, et produisent du sulfure comme sous-produit. L’activité des réducteurs de sulfate est indiquée si les sédiments deviennent noirs, car le fer et le sulfure réagissent pour former des minéraux noirs sulfureux de fer (fig. 2, tableau 1). Le sulfure se diffuse également vers le haut, créant un autre gradient dans lequel les concentrations de sulfure sont élevées dans le bas de la colonne et basses dans le haut de la colonne (fig. 1).
Près du milieu de la colonne, les oxydants de soufre profitent de l’approvisionnement en oxygène d’en haut et de sulfure d’en bas. Avec la bonne quantité de lumière, des oxydants de soufre photosynthétiques peuvent se développer dans ces couches. Ces organismes sont connus sous le nom de bactéries de soufre vert et violet,et apparaissent souvent sous forme de filaments et de taches vert, violet ou rouge pourpre (fig. 2, tableau 1). Les bactéries de soufre vert ont une plus grande tolérance pour le sulfure et se développent habituellement dans la couche directement au-dessous des bactéries de soufre pourpre. Au-dessus des bactéries de soufre pourpre, les bactéries nonsulfures pourpres peuvent également se développer. Ces organismes photosynthétisent à l’aide d’acides organiques comme donneurs d’électrons au lieu de sulfure et apparaissent souvent comme une couche rouge, pourpre, orange ou brune. Les oxydants de soufre non photosynthétiques peuvent se développer au-dessus des bactéries non sulfureuses violettes, et ceux-ci apparaissent habituellement sous forme de filaments blancs (Fig. 2, tableau 1). En outre, des bulles peuvent également se former dans la colonne Winogradsky. Les bulles dans les couches aérobies indiquent la production d’oxygène par les cyanobactéries. Les bulles dans les couches anaérobies sont probablement dues à l’activité des méthanogènes,des organismes qui décomposent anaérobiement la matière organique et forment le méthane comme sous-produit.
| Position dans la colonne | Groupe fonctionnel | Exemples d’organismes | Indicateur visuel |
| Retour au début | Photosynthétiseurs | Cyanobactéries | Couche verte ou brun-rougeâtre. Parfois des bulles d’oxygène. |
| Oxydants de soufre non photosynthétiques | Thiobacilus Beggiatoa | Couche blanche. | |
| Bactéries non sulfureuses violettes | Rhodomicrobium, Rhodospirilum, Rhodopseuodmonas | Couche rouge, violette, orange ou brune. | |
| Bactéries de soufre pourpre | Chromatium | Couche pourpre ou rouge pourpre. | |
| Bactéries vertes de soufre | Chlorobium | Couche verte. | |
| Sulfate Réduction des bactéries | Desulfovibrio, Desulfotomaculum, Desulfobacter, Desulfuromonas | Couche noire. | |
| bas | Methanogens | Méthanocoque, Methanosarcina | Parfois des bulles de méthane. |
Tableau 1 : Les principaux groupes de bactéries qui peuvent apparaître dans une colonne classique Winogradsky, de haut en bas. Des exemples d’organismes de chaque groupe sont donnés, et les indicateurs visuels de chaque couche d’organismes sont énumérés. D’après Perry et coll. (2002) et Rogan et coll. (2005).
Procedure
Results
In this experiment, water and sediment were collected from a freshwater habitat. Two Winogradsky columns were constructed and allowed to develop: a classical Winogradsky column incubated in the light at room temperature (Fig. 2A) and a Winogradsky column incubated in the dark at room temperature (Fig. 2B).

Figure 2B: A photo of classical Winogradsky column (left), incubated at room temperature in light for 68 days and a Winogradsky column incubated at room temperature in the dark for 68 days (right).
After allowing the columns to develop for 7-9 weeks, the layers in the classical column can be compared to the column incubated in the dark (Fig. 2B). In the classical Winogradsky column, a green cyanobacterial layer can be observed near the top of the tube. Near the center of the tube, a red-purple layer can be observed, indicative of purple nonsulfur bacteria. Under this layer, a purple-red layer is observed, indicative of purple sulfur bacteria. Directly under this layer, black sediment can be observed in the anaerobic region of the column, indicative of sulfate reducing bacteria.
The column grown in the dark (Fig. 2B) developed differently than the classical Winogradsky column. Like the classical column, the dark column yielded black sediment near the bottom of the column, indicative of sulfate reducing bacteria. The dark column did not yield the green cyanobacterial layer, nor the red, purple, or green layers indicative of purple nonsulfur, purple sulfur, and green sulfur bacteria, respectively. These groups are dependent on light for growth, and therefore unable to grow in the dark.
The precise results of each Winogradsky column will vary widely with their incubation conditions and their source habitats.
Microbial communities originating from freshwater habitats will not be accustomed to high salt concentrations and the addition of salt may slow down or inhibit growth. Conversely, there may be sufficient halophilic bacteria in brackish and saltwater habitats so that the addition of salts makes no difference or even enhances the growth of particular layers when compared to a column without added salts.
Sandy sediments are more porous than muddy sediments. If enough sulfide is produced in such porous sediments, sulfides can diffuse all the way to the top of the column and inhibit growth of aerobic organisms. In this case, the column may only contain layers indicative of anaerobes and may not contain any aerobes, such as the cyanobacteria.
Freshwater generally contains less sulfate than saltwater. Sulfate is important for the growth of sulfate-reducing bacteria. Sulfate reducers create sulfide as a byproduct and are indicated by the development of a black layer in the bottom of the column. If sulfate is not supplemented to freshwater communities, sulfate reducers may not produce enough sulfide. The creation of the sulfide byproduct is important for the growth of green and purple sulfur bacteria and the nonphotosynthetic sulfur oxidizers. In these cases, sulfur oxidizers can still grow using the egg yolk as a source of sulfur, even if the sulfate reducers (black layer) never develop.
Different wavelengths of light should select for organisms with different absorption pigments. A column kept in the dark will only allow for nonphotosynthetic organisms to grow, including sulfate reducers, iron oxidizers, and methanogens. Photosynthesizers have pigments that absorb light at different wavelengths within the visible range (~400-700nm). By covering a column with, for example, blue cellophane, blue light (~450-490nm) is blocked from entering the column. All of the photosynthesizers in the column have pigments which require the blue wavelengths (6) and their growth should be inhibited. On the other hand, red cellophane will block light of ~635-700nm. These wavelengths are important for the pigments used by cyanobacteria (6), while purple sulfur, green sulfur, and purple nonsulfur bacteria may still be able to grow.
Different microbial communities may have vastly different adaptive abilities to cope with changes in temperatures. High temperatures can enhance rates of microbial activity when sufficient thermophiles are present. On the other hand, in the absence of thermophiles, high temperatures may decrease overall microbial activity. Similarly, low temperatures may decrease overall microbial activity unless the microbial community contains sufficient psychrophiles.
Applications and Summary
The Winogradsky column is an example of an interdependent microbial ecosystem. After mixing mud, water, and additional carbon and sulfur substrates in a vertical column, the stratified ecosystem should stabilize into separate, stable zones over several weeks. These zones are occupied by different microorganisms which flourish at a particular spot along the gradient between the sulfide-rich sediment in the bottom and the oxygen-rich sediment at the top. By manipulating the conditions and substrates within the Winogradsky column, the presence and activity of different microorganisms such as halophiles, thermophiles, psychrophiles, sulfur oxidizers, sulfur reducers, iron oxidizers, and photosynthesizers can be observed.
References
- Zavarzin G. (2006). Winogradsky and modern microbiology. Microbiology 75(6): 501-511. doi: 10.1134/s0026261706050018
- Esteban DJ, Hysa B, and Bartow-McKenney C (2015). Temporal and Spatial Distribution of the Microbial Community of Winogradsky Columns. PLoS ONE 10(8): e0134588. doi:10.1371/journal.pone.0134588
- Lloyd KG, Steen AD, Ladau J, Yin J, and Crosby L. (2018). Phylogenetically novel uncultured microbial cells dominate Earth microbiomes. mSystems 3(5): e00055-18. doi:10.1128/mSystems.00055-18
- Anderson DC, and Hairston RV (1999). The Winogradsky Column & Biofilms: Models for Teaching Nutrient Cycling & Succession in an Ecosystem. The American Biology Teacher, 61(6): 453-459. doi: 10.2307/4450728
- Dang H, Klotz MG, Lovell CR and Sievert SM (2019) Editorial: The Responses of Marine Microorganisms, Communities and Ecofunctions to Environmental Gradients. Frontiers in Microbiology 10(115). doi: 10.3389/fmicb.2019.00115
- Stomp M, Huisman J, Stal LJ, and Matthijs HCP. (2007) Colorful niches of phototrophic microorganisms shaped by vibrations of the water molecule. ISME Journal. 1(4): 271-282. doi:10.1038/ismej.2007.59
- Perry JJ, Staley JT, and Lory S. (2002) Microbial Life, First Edition, published by Sinauer Associates
- Rogan B, Lemke M, Levandowsky M, and Gorrel T. (2005) Exploring the Sulfur Nutrient Cycle Using the Winogradsky Column. The American Biology Teacher, 67(6): 348-356. doi: 10.2307/4451860
Transcript
Most of the Earth’s microorganisms cannot be cultured in a lab, often because they rely on other microbes within their native communities. A Winogradsky column, named for its inventor Sergei Winogradsky, is a miniature, enclosed ecosystem which enriches the microbial communities within a sediment sample, enabling scientists to study many of the microbes that play a vital role in Earth’s biogeochemical processes, without needing to isolate and culture them individually.
Typically, mud and water from an ecosystem, such as a pond or a marsh, are mixed. As an optional experiment, salt can be added to this mixture to enrich various halophile species. Next, a small portion of the mixture is supplemented with carbon, usually in the form of cellulose from newspaper, and sulfur, usually from an egg yolk. For another optional experiment, a nail can be added to this mixture to enrich certain Gallionella species. This new mixture is then added to a transparent column, so that the column is one quarter full. Finally, the rest of the mud mixture and more water is added to the column until it is most of the way full.
Succession, which refers to the consecutive development of different microbial communities over time, can be observed in real time with a Winogradsky column. As microbes grow within the column, they consume specific substrates and change the chemistry of their environment. When their substrates are depleted, the original microbes die off and microbes with different metabolic needs can flourish in the altered environment. Over time, visibly distinct layers begin to form, each containing parts of a bacterial community with different microenvironmental needs.
For example, photosynthetic microbes, largely composed of cyanobacteria, form green or red-brown layers near the top of the column. Since photosynthesis produces oxygen, often seen as bubbles in the top portion of the column, a gradient is formed with the highest oxygen concentrations near the top, and the lowest towards the bottom. Depending upon the available substrates, different microbial communities can grow in the anaerobic bottom layer. Bubbles in this layer can indicate the presence of methanogens, which create methane gas via fermentation. Here, the microbial fermentation of cellulose results in organic acids. Sulfate reducers oxidize those acids to produce sulfide, and their activity is indicated by black sediment. Sulfide diffuses upward in the column, creating yet another gradient where sulfide concentrations are highest towards the bottom of the column, and lowest near the top. Towards the middle of the column, sulfur oxidizers utilize the oxygen from above and sulfide from below. With adequate light, photosynthetic sulfur oxidizers, such as green and purple sulfur bacteria, develop. Green sulfur bacteria tolerate higher sulfide concentrations. Thus, they grow directly below the purple sulfur bacteria. Directly above this layer, purple non-sulfur bacteria form a red-orange layer. Nonphotosynthetic sulfur oxidizers are indicated by the presence of white filaments.
Conditions such as light and temperature can also be varied to enrich other communities. In this video, you will learn how to construct a Winogradsky column, and vary the growing conditions and substrates to enrich specific microbial communities.
First, locate an appropriate aquatic ecosystem, such as a pond or marsh. The sediment samples should come from the area near the water’s edge, and be completely saturated with water. Then, use a shovel and a bucket to collect one to two liters of the saturated mud. Next, obtain approximately three liters of fresh water from the same source and return to the lab with the field samples.
In the lab, put on the appropriate personal protective equipment, including a lab coat and gloves. Now, transfer approximately 750 milliliters of mud to a mixing bowl. Then, sift through the mud to remove large rocks, twigs, or leaves and use a spoon to break apart any clumps. Next, add some of the fresh water to the mixing bowl, and stir with a large spoon. Add water until the consistency of the water-mud mixture is similar to a milkshake. Continue to make sure there are no clumps.
As an optional experiment, select for halophilic bacteria by adding 25 to 50 milligrams of salt to the mud mixture.
Then, transfer approximately 1/3 of the water-mud mixture to a second mixing bowl. Add one egg yolk and a handful of shredded newspaper to the bowl. Next, add this mixture to the column, until it is about 1/4 full. Next, add the water-mud mixture without the egg and newspaper to the column, until it is approximately 3/4 full. Then, add more water to the column, leaving a 1/2 inch space on top. Cover the column with plastic wrap and secure it with a rubber band.
Incubate the column in the light near a window at room temperature for the next four to eight weeks. Throughout the incubation period, monitor changes in the Winogradsky column at least once a week for the development of different colored layers and the formation of bubbles. Additionally, record the time it takes for different layers to develop.
Another modification that can be done is incubating the column near a radiator to select for thermophilic bacteria, or in a refrigerator to select for psychrophilic bacteria. Vary the light conditions by placing different columns in high light, low light, or darkness to incubate. Alternatively, limit the wavelength of incoming light by covering the column with different shades of cellophane to determine which colors select for different bacterial groups. For another optional experiment, to enrich iron-oxidizing bacteria, add a nail to the mud-water mixture prior to the addition of newspaper and an egg yolk.
After one to two weeks, growth of the cyanobacterial layer is indicated by a green or red-brown film on top of the mud layer of the classical Winogradsky column. Over time, the appearance and evolution of the different layers is monitored, each indicative of the different types of bacteria present. When comparing a column grown in the dark to a traditional Winogradsky column, we see the dark treatment yields the black layer at the bottom of the column, indicative of sulfate-reducing bacteria.
The dark column may also yield other layers, depending on other incubation conditions. Additionally, the dark column doesn’t yield the green cyanobacterial layer, nor the red, purple, or green layers indicative of purple non-sulfur, purple sulfur, and green sulfur bacteria respectively. These groups are dependent on light for growth.
