تحليل ديناميات البروتين عن طريق صرف الهيدروجين الطيف الكتلي
Summary
التشكل البروتين وديناميات هي المفتاح لفهم العلاقة بين بنية البروتين ووظيفته. تبادل الهيدروجين مقرونا عالية الدقة قياس الطيف الكتلي هو طريقة تنوعا لدراسة ديناميكية بتكوين جزئي للبروتينات وكذلك تميز البروتين يجند والبروتين البروتين التفاعلات، بما في ذلك واجهات الاتصال والآثار تفارغي.
Abstract
تعتمد جميع العمليات الخلوية على وظيفة البروتينات. على الرغم من أن وظيفة بروتين معين هو نتيجة مباشرة لتسلسل الأحماض الأمينية فريدة من نوعها، ويتحقق ذلك إلا من خلال للطي سلسلة ببتيد في ترتيب ثلاثي الأبعاد تحديدا واحدة أو أكثر شيوعا في مجموعة متكاملة من التشكل interconverting. التحقيق في العلاقة بين التشكل البروتين وظيفتها لذا فمن الضروري لفهم كامل لكيفية البروتينات هي قادرة على الوفاء تنوعها كبير من المهام. احتمال واحد لدراسة التغيرات متعلق بتكوين البروتين يخضع بينما تتقدم من خلال دورة وظيفية لها هو الهيدروجين H-1/2 H-الصرف بالاشتراك مع عالية الدقة قياس الطيف الكتلي (HX-MS). HX-MS هو أسلوب تنوعا والقوية التي تضيف بعدا جديدا إلى المعلومات التي حصلت عليها الهيكلية مثل البلورات. يتم استخدامه لدراسة البروتين للطي والتي تتكشف، ملزم من مول الصغيرةبروابط ecule، البروتين البروتين التفاعلات، والتغيرات متعلق بتكوين مرتبطة انزيم الحفز، وallostery. بالإضافة إلى ذلك، يستخدم HX-MS في كثير من الأحيان عندما كمية البروتين محدودة جدا أو بلورة البروتين ليست مجدية. ونحن هنا نقدم بروتوكول عام لدراسة ديناميات البروتين مع HX-MS ووصف كمثال كيفية الكشف عن واجهة التفاعل من اثنين من البروتينات في مجمع.
Introduction
ارتفع عدد هياكل الكريستال من البروتينات والمجمعات البروتين بسرعة في السنوات الأخيرة. ما يقدمونه لقطات لا تقدر بثمن للتنظيم الهيكلية لهذه البروتينات وتوفير أساس لتحليل هيكل وظيفة. ومع ذلك، فإن ديناميات البروتينات والتغيرات متعلق بتكوين جزئي، والتي هي ضرورية لمهامهم، ونادرا ما كشفت عنه البلورات بالأشعة السينية. البرد electronmicroscopy، من ناحية أخرى، قادرة على التقاط مجمعات البروتين والبروتين في التشكل مختلفة ولكن بصفة عامة لا يمكن حل التغييرات متعلق بتكوين وصولا الى المستوى الثانوي هيكل 1. ديناميات بتكوين جزئي للبروتينات في الحل في التفاصيل الذرية لا يمكن حلها إلا عن طريق الرنين المغناطيسي، ولكن هذا الأسلوب لا يزال يقتصر على البروتينات ذات أحجام صغيرة نسبيا (عادة ≤ 30 كيلو دالتون) ويحتاج تركيزات عالية من البروتينات (≥ 100 ميكرومتر)، الذي يعيق التجارب مع oligomerization أو تجميع البروتينات عرضة 2. أسلوب واحدقادرة على سد بين عالية الدقة البلورات بالأشعة السينية والبرد electronmicroscopy والذي لا يقتصر حسب حجم البروتين أو تركيز أميد الهيدروجين H-1/2 H-الصرف (HX) في تركيبة مع مطياف الكتلة (MS). في السنوات الأخيرة تطورت هذه الطريقة إلى أداة تحليلية قيمة لتحليل ديناميات البروتين، والبروتين للطي، والاستقرار البروتين والتغيرات متعلق بتكوين 3-5. الأساس الجزيئي لهذه الطريقة هي طبيعة عطوب من الهيدروجين أميد العمود الفقري في البروتينات، والتي سوف تبادل مع ذرات الديوتيريوم عندما يتم وضع البروتين في D 2 O الحل. يتم قياس زيادة لاحقة في البروتين الشامل على مر الزمن مع ارتفاع القرار-MS.
في الببتيدات غير منظم قصيرة HX يعتمد فقط على درجة الحرارة، وتركيز محفز (OH -، H 3 O + أي درجة الحموضة، انظر الشكل 3) وسلاسل الأحماض الأمينية الجانب المخلفات المجاورة بسبب الاستقرائي، والقطآثار alytic والفراغية. هذه التأثيرات الجوهرية على سعر الصرف الكيميائية ك الفصل تم كميا بأناقة من قبل باي وآخرون. 6 والبرنامج متاح (مجاملة Z. تشانغ)، الذي يحسب ك الفصل لكل الأحماض الأمينية داخل ببتيد تعتمد على درجة الحموضة ودرجة الحرارة. في الرقم الهيدروجيني محايدة ودرجات الحرارة المحيطة ك ch غير في الترتيب من 10 1 -10 3 ثانية -1. في البروتينات مطوية HX يمكن أن تكون 2-9 أوامر من حجم أبطأ ويرجع ذلك أساسا إلى الرابطة الهيدروجينية في هيكل الثانوية وبدرجة طفيفة بسبب الوصول المحدود للرطب OH – الأيونات إلى داخل البروتين مطوية بإحكام. لذا HX في البروتينات الأم تورط تتكشف، وتبادل الكيميائية جزئية أو العالمية وطوي ثانية إلى الدولة الأم وفقا للمعادلة (1) وفقا لأسعار الصرف المرصودة ك OBS تعتمد على المرجع سعر الافتتاح ك، سعر الإقفال ك البنود وتبادل الكيميائية الذاتية راالشركة المصرية للاتصالات ك الفصل وفقا لمعادلة (2).
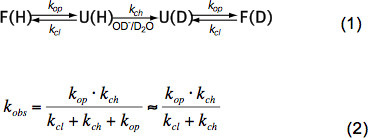
في ظل ظروف الدولة الأم ك المرجع هو أصغر بكثير من الفصل ك ويمكن إهمالها في المقام. هناك نوعان من أنظمة الصرف المدقع دعا EX1 EX2 و. إذا كانت البنود ك هو أصغر بكثير من الفصل ك (EX1) معدل احظ تساوي عمليا إلى سعر الافتتاح وHX يسمح الملاحظة المباشرة للتتكشف من عنصر هيكلي. مثل هذا النظام الصرف، حيث جميع البروتونات أميد الصرف في آن واحد على افتتاح العنصر الهيكلي، ويمكن ملاحظتها بسهولة في MS قبل توزيع ذات النسقين من قمم النظير 7. إذا ك البنود هو أكبر بكثير من الفصل ك (EX2) معدل وحظ يتناسب مع ك الفصل حيث ثابت التناسب يساوي التوازنات-تتكشف للطي المستمر K = ش ك المرجع </sub> / ك البنود. في ظل هذه الظروف، فإن العديد من افتتاح واختتام الأحداث ضرورية قبل كل تبادل البروتونات أميد لدوتيرونس، مما يؤدي إلى زيادة تدريجية في متوسط كتلة بينما يبقى توزيع النظائر تقريبا نفس. النظام EX2 يسمح تحديد الطاقة خالية من تتكشف ΔG u و بالتالي استقرار عنصر هيكلي. تحت شرط الدولة الأم النظام EX2 هو الأكثر شيوعا. زيادة درجة الحموضة وإضافة وكلاء chaotropic يمكن تحويل آلية الصرف لEX1. وبالتالي، HX-MS يمكن استخدامها لاستكشاف الحرارية وكذلك المعلمات الحركية للطي البروتين والتغيرات متعلق بتكوين.
كما ذكر أعلاه HX هو جوهرها ودرجة الحموضة ودرجة الحرارة تعتمد وتبادل عمر النصف للبروتون يتعرض المذيبات تماما من مجموعة أميد العمود الفقري ما بين 5-400 ميللي ثانية في درجة الحموضة الفسيولوجية (الرقم الهيدروجيني 7.6) و 30 درجة مئوية، ولكن 10 دقيقة ل> 15 ساعة بمتوسط> 2 ساعة في درجة الحموضة 2.9 و 0 °C (ما عدا البروتون من أول العمود الفقري أميد السندات من ببتيد، والتي تتبادل مع حياة نصف من كاليفورنيا. 1-2 دقيقة). في ظل هذه الظروف تبادل بطيئة فمن الممكن لهضم العينة باستخدام البروتياز (مثل البيبسين) التي تنشط في ظل هذه الظروف، مع من فقدان جميع المعلومات الواردة في دوتيرونس يدمج. منذ إدخال الهضم المعوية في ظل ظروف تبادل بطيئة، وليس فقط حركية HX العام للبروتينات كامل طول يمكن تحليلها ولكن يمكن أن تكون مترجمة إلى HX مناطق محددة 8،9. يقتصر القرار المكانية حاليا لحجم الشظايا الناتجة الهضمية، والتي هي بشكل عام بين 10-30 المخلفات. ومع ذلك، يمكن تداخل شظايا إنشاؤها نظرا لطبيعة غير محددة من الانقسام قبل البيبسين يؤدي إلى زيادة في القرار المكانية. بالإضافة إلى ذلك، تم العثور على العديد من البروتياز الأخرى أن تكون نشطة في ظل ظروف إخماد، ومع ذلك، أقل كفاءة بكثير من البيبسين 10. مزيد من increaذاتها من القرار المكانية ويمكن الوصول عن طريق تجزئة الببتيدات في الطور الغازي من قبل الأساليب التي حافظت على نمط معالجة بالديوتريوم مثل أسر الإلكترون تفارق (تنمية الطفولة المبكرة)، ونقل الإلكترون تفارق (المفتشون) والأشعة تحت الحمراء multiphoton تفارق (IRMPD) 11-13. هذه التقنيات منع فقدان القرار المكانية بسبب الهجرة داخل الجزيء بروتون ("الهرولة")، والذي لوحظ من قبل الناجم عن الاصطدام تفارق (CID) تقنية تجزئة الأكثر استخداما. ومع ذلك، وهذه الأساليب تتطلب التحسين لكل الببتيد الفردية وبالتالي لا تزال صعبة للغاية.
وقد استخدم HX-MS لتحليل البروتين يجند والبروتين البروتين التفاعلات بما في ذلك التجمع الفيروسية قفيصة 14-17. البروتين تتكشف وطوي ثانية وكذلك تم التحقيق في درجة الحرارة الناجمة عن التغيرات متعلق بتكوين 7،18،19. الفسفرة واحد من الأحماض الأمينية المتصلة بتكوين طفرة يغير 16،20 وnucleotوالتغيرات الناجمة عن بيئة تطوير متكاملة تحليل 21،22. وبالتالي، فإن هذا الأسلوب يبدو مناسبة بشكل مثالي لتحليل التجمع وديناميات الآلات الجزيئية. مرشح واحد جذاب، الذي هو آلية من المصلحة العامة كبيرة، هو مجمع كوصي Hsp90.
Protocol
Representative Results
Discussion
ملزمة من شريك إلى التفاعل البروتين حتما يسبب تغيرات في الوصول المذيب على موقع ملزمة. بالإضافة إلى ذلك، العديد من البروتينات تغيرات ديناميكية بتكوين عليها ملزمة، والتي تؤثر على مناطق أخرى من واجهة الربط الفعلي. HX-MS هو طريقة قوية لرصد هذه التغيرات وحتى قادرة على الكشف …
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر M. بويسن للتعليق على المخطوطة. وقد تم تمويل هذا المشروع من قبل جمعية الألمانية للبحوث (SFB638 وMA 1278/4-1 لإم، والكتلة التميز: CellNetworks EXC 81/1). إم هو محقق من الكتلة التميز: CellNetworks.
Materials
| Reagent/Equipment | Company | Catalogue number | Comments (optional) |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
References
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5′-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O’Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).

