النمذجة سريع مسح بيانات فولتامتري دوري من تحفيز الدوبامين كهربائيا نقل البيانات باستخدام QNsim1.0
Summary
سريع المسح الضوئي فولتامتري دوري يمكن رصد في العصبي الدوبامين العصبي في سياق المخدرات، والمرض، والتلاعب التجريبية الأخرى. ويصف هذا العمل تنفيذ QNsim1.0، وهو برنامج لنموذج استجابات الدوبامين حفز كهربائيا وفقا لنموذج نيوروبيبيولوجيكال الكمي لتحديد تقديرات الإفراج الدوبامين وديناميكيات إعادة الامتصاص.
Abstract
تلعب مسارات الدوبامين المركزية (دارجيك) دورا هاما في مجموعة واسعة من الوظائف، مثل الاهتمام والدافع والحركة. والدوبامين (دا) متورط في الأمراض والاضطرابات بما في ذلك اضطراب نقص الانتباه فرط النشاط، ومرض باركنسون، وإصابات في الدماغ. وهكذا، دا نقل العصبية وطرق دراستها هي ذات أهمية علمية مكثفة. في الجسم الحي سريع المسح الضوئي فولتامتري دوري (فسكف) هو الأسلوب الذي يسمح لمراقبة انتقائية التغييرات تركيز دا مع الدقة الزمانية والمكانية غرامة. وتستخدم هذه التقنية عادة بالتزامن مع التحفيز الكهربائي من مسارات دارجيك تصاعدي للسيطرة على تدفق دفعة من الناقلات العصبية الدوبامين. على الرغم من أن تحفيز دا نموذج العصبي يمكن أن تنتج ردود دا قوية مع مورفولوجيز واضحة، مما يجعلها قابلة للتحليل الحركي، لا يزال هناك الكثير من النقاش حول كيفية تفسير الردود من حيث إطلاقها دا و كليريانسي. لمعالجة هذا القلق، تم تطوير إطار نيوروبيولوجيكال الكمي (قن) من العصبي دا حفز مؤخرا لنموذج واقعي ديناميات الإفراج دا وإعادة امتصاص على مدى استجابة دا حفز. وتستند أسس هذا النموذج على البيانات التجريبية من حفز دا نقل العصبي وعلى مبادئ النقل العصبي المعتمدة من مختلف خطوط البحث. نموذج ق تنفذ 12 المعلمات المتعلقة تحفيز دا الافراج عن وديناميات إعادة امتصاص نموذج الاستجابة دا. يصف هذا العمل كيفية محاكاة ردود دا باستخدام QNsim1.0 وأيضا تفاصيل المبادئ التي تم تنفيذها لتبين بشكل منهجي التعديلات في الإفراج عن الدوبامين حفز وديناميكيات امتصاص.
Introduction
يلعب الدوبامين (دا) العصبي دورا أساسيا في مختلف الوظائف المعرفية والسلوكية، ويتورط خلل وظيفته في العديد من الأمراض والاضطرابات الشائعة. على هذا النحو، فمن الأهمية بمكان لتطوير طرق دقيقة لدراسة كمية دنا نقل العصبي في الجسم الحي لتقييم كيفية تغيير العصب دا في سياقات نماذج المرض وعلم الأدوية المخدرات. سريع المسح الضوئي فولتامتري دوري (فسكف) يسمح للرصد في الجسم الحي دا العصبي مع قرار المكاني والزماني غرامة. في حين أنه من الممكن لمراقبة العصبي دا الفسيولوجية في مستيقظا، الحيوانات تتصرف بحرية، والتحفيز الكهربائي من مسارات الدوبامين تصاعدي في الحيوانات تخدير يمكن أن تنتج ردود دا قوية التي هي قابلة للتحليل الحركي تعزيز دا نقل العصبي.
تعكس ردود فعل دا المحفزة كهربائيا تفاعلا ديناميكيا لإطلاق سراح دا وإعادة امتصاصه، والتفسيراتمن هذه الردود قد استخدمت في الغالب نموذج بسيط من حفز دا العصبي دعا ميكلايس-منتن (مم) نموذج 12 . ويتألف نموذج مم من 3 متغيرات لوصف استجابات دا من حيث معدل إطلاق ثابت دا وكفاءة إعادة امتصاص ثابتة ( أي العلاقة بين معدل امتصاص دا وتركيزات دا خارج الخلية)، كما هو موضح في المعادلة 1 : 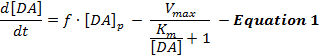
(الإفراج دا) (دا امتصاص)
في المعادلة 1، و هو تردد التحفيز. [دا] p هو زيادة تركيز دا المقدرة لكل نبض من التحفيز. V ماكس يمثل معدل امتصاص القصوى المقدرة. و K m هو ثابت مم المقدرة، وهو ما يعادل نظريا لتركيز خارج الخلية دا التي تشبع 50٪ من دات، مما يؤدي إلى معدل امتصاص نصف القصوى. هذا الاختلافيمكن دمج معادلة آل لمحاكاة ردود دا التجريبية بتقدير معلمات [دا] p و V ماكس و K m .
على الرغم من أن نموذج مم قد سهلت تقدما كبيرا في فهم حركية الناقل العصبي دا في سياقات تجريبية مختلفة، فإن نموذج مم يجعل الافتراضات الأساسية التبسيط التي تحد من انطباقه عند نمذجة ردود دا التي أثارها التحفيز سوبرافيسيولوجيكال 2 ، 13 . على سبيل المثال، يمكن لنموذج مم تقريب أشكال الاستجابة دا فقط إذا كانت ترتفع بطريقة محدبة، ولكنها لا يمكن أن تمثل ردود فعل تدريجية (مقعرة) المتصاعدة الموجودة في المناطق الظهرية المخططة 12 . وبالتالي، فإن افتراضات نموذج مم لا تعبر بدقة عن إطلاق ديناميكية وعمليات إعادة امتصاص الناقلات دا المحفزة.
لنموذج استجابات دا حفز وفقا لكمية واقعيةالإطار الإطاري، تم تطوير الإطار الكهربي العصبي الكمي (قن) استنادا إلى مبادئ حركية العصب الحركي المستمدة من البحث التكميلي والتجريب 2 . وتظهر خطوط مختلفة من البحوث العصبية أن (1) تحفيز الافراج العصبي هو عملية ديناميكية التي تنخفض في معدل على مدى التحفيز 14 ، (2) لا يزال الافراج في مرحلة ما بعد التحفيز مع حركية الاضمحلال ثنائي الطور 15 ، و (3) دا تمنع كفاءة امتصاص تدريجيا خلال مدة التحفيز نفسه 2 ، 16 . هذه المفاهيم الثلاثة هي الأساس لإطار قن، والمعادلات الثلاثة تتكون من 12 معلمات تصف ديناميات الإفراج دا وإعادة امتصاص ( الجدول 1 ). يمكن لإطار كن محاكاة عن كثب أنواع التجاوب التجريبي دا غير المتجانسة، وكذلك pالآثار المصابة للتلاعب التجريبية من المعلمات التحفيز وإدارة المخدرات 2 ، 6 . على الرغم من أن مزيد من البحث هو ضروري لصقل نهج النمذجة البيانات، يمكن للتجارب في المستقبل الاستفادة إلى حد كبير من هذا النهج النمذجة ترتكز على نيوروبيولوجيكالي، مما يضيف إلى حد كبير إلى الاستدلالات المستمدة من نموذج دا الناقل العصبي حفز.

الجدول 1: معادلات النمذجة والمعلمات . الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
يصف هذا البرنامج التعليمي كيفية نموذج حفز بيانات الاستجابة دا لتقدير دا إطلاق وحركية ريوبتيك باستخدام قنسم 1.0. جمع البيانات التجريبية الفعلية والعلاقات العامةلم يتم وصف أوسيسينغ هنا ويتطلب فقط بيانات تركيز دا الزمنية. وقد تم وصف الدعم النظري والأسس لإطار قن بشكل موسع سابقا 2 ، ولكن يرد وصف للمنظور العملي لتطبيق إطار الشبكة القطرية لنموذج بيانات استجابة جدول أعمال التنمية أدناه.
الإطار القاري نموذج التفاعل الديناميكي بين: 1) دينامية إصدار دا، 2) دا امتصاص، و 3) آثار التحفيز الفوقي السلفي على هذه العمليات لاستخراج المعلومات الحركية ذات مغزى من بيانات الاستجابة دا. إطار قن هو الأنسب لنمذجة فسكف البيانات المكتسبة باستخدام التحفيز فوق الفسيولوجية للغاية لفترة طويلة (على سبيل المثال، 60 هرتز، 10 ثانية التحفيز)، والتي تنتج ردود دا قوية التي هي قابلة للتحليل الحركي. وبعد النمذجة الدقيقة لعمليات الإطلاق وإعادة الامتصاص الأساسية، يمكن استعمال معلمات النموذج لمحاكاة استجابة دا التي ينبغي أن تقارب شكل المقياس السابقاستجابة تجريبية دا.
وتصف معادلات إطار الشبكة القطرية معدلات إطلاق سراح دا وإعادة امتصاصها على مدى ردود دا المحفزة. يصف إطار كن معدل إطلاق دا المحفز كدالة من الوقت من بداية التحفيز (t)، عندما ينخفض معدل إطلاق دا بشكل كبير على مدى التحفيز. ويتسق ذلك مع استنفاد تجمع قابل للنشر بسهولة، مع إضافة معدل إطلاق دا ثابت الحالة (دارس) لحساب تجديد الحويصلات، على غرار التقارير الأخرى ( المعادلة 2 ) 14 ، 17 .
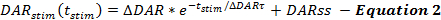
يؤدي التلاعب الذي يزيد من معدل إطلاق دا، مثل زيادة Δ دار أو Δ دار أو دارس، إلى زيادة اتساع الاستجابة على دا مقابل المؤامرات الزمنية. كل بارامتر يساهم بشكل تفاضلي في أشكال الاستجابة دا. زيادة دارس و Δ دار τ على حد سواء جعل المرحلة الصاعدة من الردود أكثر خطية (أقل محدبة). تناقص Δ دار τ يعزز التحدب، الذي يسيطر عليه مقدار Δ دار. استنادا إلى تجربة النمذجة، دارس عموما أقل من 1/5 من Δ دار؛ وبالتالي، Δ دار هي معلمة الافراج التي تحدد في المقام الأول اتساع الاستجابة الشاملة للاستجابة دا.
يتم وضع نموذج معدل تحفيز دا بعد التحفيز من خلال المعادلة 3 كاستمرار لمعدل إطلاق دا حفز من نهاية التحفيز (دار إس ) كدالة من الوقت بعد التحفيز (ر آخر ). يتبع معدل إطلاق دا بعد التحفيز نمط تسوس ثنائي الطور، كما هو موضح سابقا 15 ، مع مرحلة تسوس الأسي السريع ومرحلة تسوس خطية لفترات طويلة لنموذج اثنين كاعمليات الإفراج العصبي التي تعتمد على لسيوم.
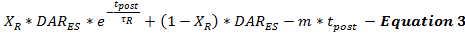
(التسوس الأسي السريع) (الاضمحلال الخطي المطول)
ليس من الممكن حاليا لتحديد مدى ما بعد التحفيز إصدار دا يحدث. ويمكن معالجة هذا الحد عن طريق التقليل المنهجي من تقديرات ما بعد التحفيز إصدار دا والتحقق من صحة المعلمات نموذج عبر مجموعة من الردود دا التجريبية التي تم جمعها من نفس الموقع تسجيل باستخدام فترات التحفيز متفاوتة. يسمح هذا التقليل للمستخدمين بإجراء تقديرات متحفظة من الإفراج وإعادة امتصاص. لأن التحفيز الكهربائي يؤدي إلى تراكم الكالسيوم الذي يعزز بعد تحفيز الناقلات العصبية الإفراج، ومدة التحفيز يؤثر على ما بعد التحفيز العصبيونميتر ريليس باراميترز 18 ، 19 . واستنادا إلى تجربة النمذجة، وجد أنه كلما زادت مدة التحفيز، يزداد τ R وينخفض X R ، بما يتفق مع الآثار المتوقعة لزيادة تراكم الكالسيوم 20 .
وتصف المعادلة 4 معدل امتصاص دا باعتباره امتدادا لإطار مم ويشتمل على المدى K ديناميكية، مما يزيد خلال التحفيز لنموذج تدريجيا انخفاض كفاءة امتصاص الناجمة عن التحفيز سوبرافيسيولوجيكال 2 ، 16 . يتم الاحتفاظ K م بعد التحفيز ثابتة في قيمة K م في نهاية التحفيز (K ميس).
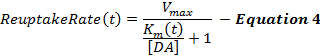
أين،
<img alt = "المعادلة 6" سرك = "/ فيليز / ftp_upload / 55595 / 55595eq6.jpg" />
(خلال التحفيز) (بعد التحفيز)
وغالبا ما تكون ردود الفعل المحفزة من دا، وخاصة من المناطق القبلية البطنية، غير حساسة للتغيرات في قيمة K m الأولية (كي مي )، الأمر الذي يجعل تحديد قيمة K مي مشكلة. وهكذا، مثل إطار مم الأصلي، يتم تقريب K مي في 0.1-0.4 μ M لاستجابات دا جمعها من السيطرة على الحيوانات غير المعالجة 12 . و Δ K المدى المدى يحدد مدى تغيير كفاءة امتصاص خلال التحفيز، والتي من تجربتنا حوالي 2081. M على مدى 60 هرتز، 10-ق التحفيز. وتحدد قيم k و مينف كيف تتغير K m بمرور الوقت، ويؤدي أي من هذين المصطلحين إلى تعزيز تقعر المرحلة الصاعدة. V ماكس هو معدل امتصاص القصوى التي تتصل جزئيا لكثافة دا الناقل المحلي، الذي يعرض فينتروميديال إلى التدرج الظهراني الوحشي 21 . وفقا لذلك، القيم V ماكس في المخطط الظهري (D- ستر) هي عموما أكبر من 30 μ م / ث ولكن عموما أقل من 30 μ م / ث في المناطق البطني، مثل نواة أكومبنس (ناك) 6 .
ويمكن للمبادئ التوجيهية العامة أعلاه أن تساعد في نمذجة بيانات الاستجابة التجريبية دا، ولكن توليد محاكاة تقارب استجابة دا التجريبية يتطلب تعديل نموذجي المعلمات نموذجيا. دقة المعلمات نموذج يمكن تحسينها عن طريق الحصول على ردود دا للتحفيز سوبرافيسيولوجيكال التي تقدمركيزة قوية للمحاكاة، وكذلك من خلال الحصول على نماذج متعددة دا والاستجابة لها لتحفيز فترات متفاوتة في نفس موقع التسجيل (على سبيل المثال، 60 هرتز، 5-S و 10-S التحفيز) للتحقق من صحة المعلمات ( انظر بيانات العينة). للتدليل، يتم تضمين مجموعة البيانات مع حزمة البرامج التي تحتوي على ريجيوسبيسيفيك تحفيز ردود دا جمعت في نواة أكومبنس والمخطط الظهري، قبل وبعد التحدي الدوائي الذي تم بالفعل نمذجة باستخدام إطار قن. في النهاية، سوف تجد المستخدمين يمكن تطبيق هذه المنهجية بالمثل لتوصيف حركية العصبي دا في سياقات المرض المختلفة والتلاعب الدوائية.
Protocol
Representative Results
Discussion
استخدام فسكف لدراسة في الجسم الحي حفز دا العصبي نشأت في 1980s 30 ولا تزال مستمرة لتكون مصدرا غنيا من البيانات في الجسم الحي العصبي مع قرار المكاني والزماني لا مثيل لها. ردود دا تحفيز تعكس توازن معقد من إطلاق دا وإعادة امتصاص التي يتم تشكيلها من قبل ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونعترف بمعهد أوبك لإعادة التأهيل لدعم هذا العمل.
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. 神经科学. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. 神经科学. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

