Modelado de datos de voltametría cíclica de exploración rápida de datos de neurotransmisión de dopamina estimulada eléctricamente usando QNsim1.0
Summary
La voltamperometría cíclica de exploración rápida puede monitorizar la neurotransmisión in vivo de dopamina en el contexto de fármacos, enfermedades y otras manipulaciones experimentales. Este trabajo describe la implementación de QNsim1.0, un software para modelar las respuestas de dopamina eléctricamente estimuladas de acuerdo con el modelo neurobiológico cuantitativo para cuantificar las estimaciones de liberación de dopamina y la dinámica de recaptura.
Abstract
Las vías dopaminérgicas centrales (DAergic) tienen un papel importante en una amplia gama de funciones, tales como atención, motivación y movimiento. La dopamina (DA) está implicada en enfermedades y trastornos incluyendo trastorno por déficit de atención con hiperactividad, enfermedad de Parkinson y lesión cerebral traumática. Por lo tanto, la neurotransmisión DA y los métodos para estudiarla son de intenso interés científico. La voltamperometría cíclica de exploración rápida in vivo (FSCV) es un método que permite el monitoreo selectivo de cambios de concentración de DA con resolución temporal y espacial fina. Esta técnica se usa comúnmente en conjunción con estimulaciones eléctricas de rutas ascendentes de DAergic para controlar el flujo de impulso de la neurotransmisión de dopamina. Aunque el paradigma estimulado DA neurotransmission puede producir respuestas robustas DA con morfologías claras, haciéndolos susceptibles para el análisis cinético, todavía hay mucho debate sobre cómo interpretar las respuestas en términos de su liberación de DA y clearanComponentes. Para abordar esta preocupación, se desarrolló recientemente un marco neurobiológico cuantitativo (QN) de neurotransmisión estimulada de DA para modelar de forma realista la dinámica de liberación de DA y recaptación a lo largo de una respuesta estimulada de DA. Las bases de este modelo se basan en datos experimentales de la neurotransmisión estimulada de DA y en los principios de neurotransmisión adoptados a partir de diversas líneas de investigación. El modelo QN implementa 12 parámetros relacionados con la liberación estimulada de DA y la dinámica de recaptura para modelar las respuestas DA. Este trabajo describe cómo simular las respuestas DA usando QNsim1.0 y también se detallan principios que se han implementado para discernir sistemáticamente alteraciones en la liberación estimulada de liberación de dopamina y la dinámica de recaptura.
Introduction
La neurotransmisión de dopamina (DA) desempeña un papel esencial en diversas funciones cognitivas y de comportamiento, y su disfunción está implicada en varias enfermedades y trastornos comunes. Como tal, es crítico desarrollar métodos precisos de estudiar cuantitativamente DA neurotransmission in vivo para evaluar cómo DA neurotransmission se altera en los contextos de los modelos de enfermedad y farmacología de drogas. La voltamperometría cíclica de exploración rápida (FSCV) permite monitorear la neurotransmisión in vivo de DA con resolución espacial y temporal fina. Aunque es posible monitorear la neurotransmisión fisiológica de DA en animales despiertos y de comportamiento libre, la estimulación eléctrica de vías ascendentes dopaminérgicas en animales anestesiados puede producir respuestas robustas de DA que son susceptibles al análisis cinético mejorado de la neurotransmisión DA.
Las respuestas de DA estimuladas eléctricamente reflejan una interacción dinámica de liberación y recaptura de DA y las interpretacionesDe estas respuestas han utilizado predominantemente un modelo simple de DA estimulada neurotransmisión llamada el Michaelis-Menten (MM) modelo [ 12] . El modelo MM consta de 3 variables para describir las respuestas DA en términos de una velocidad de liberación de DA constante y una eficiencia de recaptación constante ( es decir, la relación entre la tasa de reabsorción de DA y las concentraciones extracelulares de DA), como se describe en la Ecuación 1 : 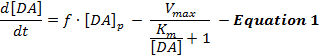
(Liberación de DA) (recaptación de DA)
En la Ecuación 1, f es la frecuencia de estimulación; [DA] p es el aumento estimado de la concentración de DA por impulso de estimulación; Vmax representa la tasa de recaptación máxima estimada; Y K m es la constante de MM estimada, que es teóricamente equivalente a la concentración de DA extracelular que satura el 50% de DAT, dando lugar a una tasa de reabsorción medio-máxima. Este diferencialSe puede integrar una ecuación para simular respuestas de DA experimentales mediante la estimación de los parámetros [DA] p , V max y K m .
Aunque el modelo MM ha facilitado avances significativos en la comprensión de la cinética de neurotransmisión DA en varios contextos experimentales, el modelo MM hace suposiciones fundamentales simplistas que limitan su aplicabilidad al modelar las respuestas de DA suscitadas por estimulaciones suprafisiológicas 2 , 13 . Por ejemplo, el modelo MM sólo puede aproximarse a las formas de respuesta DA si se elevan de forma convexa, pero no puede explicar las respuestas crecientes (cóncavas) graduales encontradas en las regiones estriadas dorsales 12 . Por lo tanto, las hipótesis del modelo MM no capturan con precisión los procesos dinámicos de liberación y reabsorción de la neurotransmisión DA estimulada.
Para modelar las respuestas de DA estimuladas de acuerdo con una cantidad realistaEl marco cuantitativo neurobiológico (QN) se desarrolló sobre la base de los principios de cinética estimulada neurotransmisión derivados de la investigación complementaria y la experimentación [ 2] . Varias líneas de la investigación de la neurotransmisión demuestran que (1) la liberación estimulada del neurotransmisor es un proceso dinámico que disminuye en tarifa sobre el curso de la estimulación 14 , (2) la liberación continúa en la fase post-estimulación con la cinética bifásica de la decaimiento 15 , y (3) DA La eficiencia de la reabsorción se inhibe progresivamente durante la duración de la propia estimulación 2 , 16 . Estos tres conceptos sirven de base al marco QN y las tres ecuaciones consisten en 12 parámetros que describen la dinámica de liberación de DA y reabsorción ( Tabla 1 ). El marco QN puede simular de cerca heterogénea experimental DA tipos de respuesta, así como la pRedicted efectos de manipulaciones experimentales de los parámetros de estimulación y la administración de fármacos [ 2 , 6] . Aunque es necesario seguir investigando para refinar el enfoque de modelado de datos, los futuros experimentos pueden beneficiarse enormemente de este enfoque de modelado basado en la neurobiología, que se añade significativamente a las inferencias extraídas del paradigma estimulado de la neurotransmisión DA.

Tabla 1: Ecuaciones y parámetros de modelado . Haga clic aquí para ver una versión más grande de esta figura.
Este tutorial describe cómo modelar los datos estimulados de respuesta DA para estimar la liberación de DA y la cinética de reabsorción usando QNsim 1.0. La recopilación de datos experimentales reales y prEl proceso no se describe aquí y sólo requiere datos de concentración de DA temporal. El apoyo teórico y los fundamentos de la QN marco se han descrito ampliamente anteriormente [ 2] , pero una perspectiva práctica en la aplicación de la QN marco de modelo DA respuesta de datos se describe a continuación.
El modelo QN modela la interacción dinámica entre: 1) liberación dinámica de DA, 2) recaptación de DA y 3) los efectos de las estimulaciones suprafisiológicas en estos procesos para extraer información cinética significativa de los datos de respuesta de DA. El marco QN es el más adecuado para modelar datos FSCV adquiridos utilizando estimulaciones altamente suprafisiológicas de larga duración ( por ejemplo, estimulaciones de 60 Hz, 10 s), que producen respuestas robustas de DA que son susceptibles de análisis cinético. Siguiendo el modelado preciso de los procesos subyacentes de liberación y reabsorción, los parámetros del modelo pueden usarse para simular una respuesta de DA que debe aproximarse a la forma del exPerimental DA respuesta.
Las ecuaciones del marco QN describen las tasas de liberación de DA y recaptación durante el curso de las respuestas estimuladas de DA. El marco QN describe la tasa de liberación estimulada de DA en función del tiempo desde el inicio de la estimulación (t stim ), cuando la velocidad de liberación de DA disminuye exponencialmente durante el curso de la estimulación. Esto es consistente con el agotamiento de un grupo fácilmente liberable, con una tasa de liberación de DA de estado estacionario añadida (DARss) para tener en cuenta la reposición de vesículas, similar a otros informes ( Ecuación 2 ) 14 , 17 .
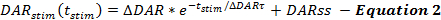
Las manipulaciones que aumentan la velocidad de liberación de DA, tales como el aumento de Δ DAR, Δ DAR τ o DARss, conducen a amplitudes de respuesta incrementadas en DA en función de los gráficos de tiempo. Cada parameTer contribuye de forma diferencial a las formas de respuesta DA. El aumento de DARss y Δ DAR τ hacen que la fase ascendente de las respuestas sea más lineal (menos convexa). La disminución de Δ DAR τ promueve la convexidad, que está controlada por la magnitud de Δ DAR. Sobre la base de la experiencia de modelado, DARss es generalmente menor que 1/5 th de Δ DAR; Por lo tanto, Δ DAR es el parámetro de liberación que determina principalmente la amplitud de respuesta global de una respuesta DA.
La tasa de liberación de DA post-estimulación es modelada por la ecuación 3 como una continuación de la tasa de liberación de DA estimulada desde el final de la estimulación (DAR ES ) como una función del tiempo después de la estimulación (t post ). La tasa de liberación de DA posterior a la estimulación sigue un patrón de decaimiento bifásico, como se describió anteriormente 15 , con una fase de decaimiento exponencial rápido y una fase de decaimiento lineal prolongado para modelar dos caDependientes del litio, los procesos de liberación de neurotransmisores.
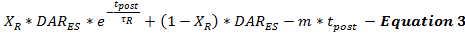
(Desintegración exponencial rápida) (Desintegración lineal prolongada)
Actualmente no es posible determinar cuánto se produce la liberación de DA post-estimulación. Esta limitación puede abordarse minimizando sistemáticamente las estimaciones de liberación de DA post-estimulación y validando los parámetros del modelo a través de un conjunto de respuestas de DA experimentales recogidas del mismo sitio de registro utilizando diferentes duraciones de estimulación. Esta minimización permite a los usuarios hacer estimaciones conservadoras de liberación y recaptación. Debido a que las estimulaciones eléctricas conducen a la acumulación de calcio que promueve la liberación del neurotransmisor después de la estimulación, la duración de la estimulación influye en los neurotrans post-estimulaciónLos parámetros de liberación 18 , 19 . Basado en la experiencia de modelado, se encontró que a medida que aumenta la duración de la estimulación, τ R aumenta y X R disminuye, en consonancia con los efectos anticipados de una mayor acumulación de calcio 20 .
La ecuación 4 describe la tasa de recaptación de DA como una extensión del marco MM e incorpora un término dinámico de K m , que aumenta durante la estimulación para modelar una eficiencia de recaptación progresivamente decreciente causada por las estimulaciones suprafisiológicas 2 , 16 . El K m después de la estimulación se mantiene constante al valor K m al final de la estimulación (K mES).
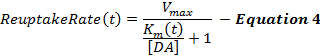
dónde,
<img alt = "Ecuación 6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(Durante la estimulación) (después de la estimulación)
Las respuestas estimuladas de DA, especialmente de las regiones estriadas ventrales, son a menudo insensibles a los cambios en el valor inicial de K m (K mi ), lo que hace que la definición de un valor de K mi sea problemática. Así, al igual que el marco MM original, K mi se aproxima a 0,1-0,4 μ M para DA respuestas recogidas de control de animales no tratados [ 12] . El término Δ K m determina la magnitud del cambio en la eficiencia de recaptación durante la estimulación, que según nuestra experiencia es de aproximadamente 2081; M en el transcurso de una estimulación de 60 Hz, 10 s. Los valores k y K minf determinan cómo K m cambia con el tiempo, y el aumento de cualquiera de estos términos promueve la concavidad de la fase ascendente. Vmax es la tasa máxima de recaptación que se relaciona en parte con la densidad del transportador DA local, que exhibe un gradiente ventromedial a dorsolateral 21 . En consecuencia, los valores de Vmax en el estriado dorsal (D-Str) son generalmente mayores que 30 μ M / s pero generalmente menores de 30 μ M / s en las regiones ventrales, como el núcleo accumbens (NAc) 6 .
Las directrices generales anteriores pueden ayudar a modelar los datos experimentales de la respuesta DA, pero generar una simulación que se aproxima a la respuesta DA experimental requiere un ajuste iterativo de los parámetros del modelo. La exactitud de los parámetros del modelo puede mejorarse mediante la obtención de respuestas DA a estímulos suprafisiológicos que proporcionanUn sustrato robusto para la simulación, así como obteniendo y modelando respuestas de DA múltiples a estímulos de duraciones variables en el mismo sitio de registro ( por ejemplo, estimulaciones de 60 Hz, 5 y 10) para validar la precisión de los parámetros ( Ver los datos de la muestra). Para demostrar, se incluye un conjunto de datos con el paquete de software que contiene respuestas de DA estimuladas regioespecíficas recogidas en el núcleo accumbens y striatum dorsal, antes y después de un desafío farmacológico que ya estaba modelado usando el marco QN. Por extensión, los usuarios encontrarán que esta metodología puede aplicarse de manera similar para caracterizar la cinética de DA neurotransmisión en diversos contextos de enfermedad y manipulaciones farmacológicas.
Protocol
Representative Results
Discussion
El uso de FSCV para estudiar in vivo estimulado DA neurotransmission se originó en la década de 1980 [ 30] y sigue siendo una fuente rica de datos de neurotransmisión in vivo con inigualable espacial y temporal de resolución. Las respuestas de DA estimuladas reflejan un equilibrio complejo de liberación de DA y recaptación que son moduladas por los propios estimulantes eléctricos. El modelo QN incorpora los principios de la investigación contemporánea de neurotransmisi?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Reconocemos al Instituto de Rehabilitación de la UPMC por apoyar este trabajo.
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. 神经科学. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. 神经科学. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

