Schaalbare isolatie en zuivering van extracellulaire blaasjes van Escherichia coli en andere bacteriën
Summary
Bacteriën scheiden nanometergrote extracellulaire blaasjes (EV’s) af die bioactieve biologische moleculen dragen. EV-onderzoek richt zich op het begrijpen van hun biogenese, rol in microbe-microbe en gastheer-microbe interacties en ziekte, evenals hun potentiële therapeutische toepassingen. Een workflow voor schaalbare isolatie van EV’s van verschillende bacteriën wordt gepresenteerd om standaardisatie van EV-onderzoek te vergemakkelijken.
Abstract
Diverse bacteriesoorten scheiden ~ 20-300 nm extracellulaire blaasjes (EV’s) af, bestaande uit lipiden, eiwitten, nucleïnezuren, glycanen en andere moleculen afgeleid van de ouderlijke cellen. EV’s functioneren als intra- en inter-species communicatievectoren en dragen tegelijkertijd bij aan de interactie tussen bacteriën en gastheerorganismen in de context van infectie en kolonisatie. Gezien de veelheid aan functies die aan EV’s worden toegeschreven in gezondheid en ziekte, is er een groeiende interesse in het isoleren van EV’s voor in vitro en in vivo studies. Er werd verondersteld dat de scheiding van EV’s op basis van fysieke eigenschappen, namelijk grootte, de isolatie van blaasjes uit verschillende bacterieculturen zou vergemakkelijken.
De isolatieworkflow bestaat uit centrifugatie, filtratie, ultrafiltratie en grootte-uitsluitingschromatografie (SEC) voor de isolatie van EV’s uit bacterieculturen. Een pompgestuurde tangentiële flowfiltratie (TFF) stap werd opgenomen om de schaalbaarheid te verbeteren, waardoor materiaal uit liters startcelcultuur kon worden geïsoleerd. Escherichia coli werd gebruikt als een modelsysteem dat EV-geassocieerde nanoluciferase en niet-EV-geassocieerde mCherry tot expressie brengt als reportereiwitten. De nanoluciferase was gericht op de EV’s door zijn N-terminus te fuseren met cytolysine A. Vroege chromatografiefracties met 20-100 nm EV’s met geassocieerd cytolysine A – nanoLuc verschilden van de latere fracties die de vrije eiwitten bevatten. De aanwezigheid van EV-geassocieerd nanoluciferase werd bevestigd door immunogold labeling en transmissie-elektronenmicroscopie. Deze EV-isolatieworkflow is van toepassing op andere menselijke darmgerelateerde gramnegatieve en grampositieve bacteriesoorten. Kortom, de combinatie van centrifugatie, filtratie, ultrafiltratie / TFF en SEC maakt schaalbare isolatie van EV’s van verschillende bacteriesoorten mogelijk. Het gebruik van een gestandaardiseerde isolatieworkflow zal vergelijkende studies van microbiële EV’s tussen soorten vergemakkelijken.
Introduction
Extracellulaire blaasjes (EV’s) zijn nanometergrote, liposoomachtige structuren die bestaan uit lipiden, eiwitten, glycanen en nucleïnezuren, uitgescheiden door zowel prokaryote als eukaryote cellen1. Sinds de vroege studies die de afgifte van EV’s van gramnegatieve bacteriën2 visualiseren, is het aantal biologische functies dat wordt toegeschreven aan bacteriële EV’s (20-300 nm in diameter) de afgelopen decennia voortdurend gegroeid. Hun functies omvatten het overbrengen van antibioticaresistentie3, biofilmvorming4, quorumdetectie5 en toxineafgifte6. Er is ook een groeiende belangstelling voor het gebruik van bacteriële EV’s als therapieën, vooral in vaccinologie7 en kankertherapie8.
Ondanks de groeiende belangstelling voor EV-onderzoek, zijn er nog steeds technische uitdagingen met betrekking tot isolatiemethoden. In het bijzonder is er behoefte aan isolatiemethoden die reproduceerbaar, schaalbaar en compatibel zijn met diverse EV-producerende organismen. Om een uniforme reeks principes te creëren voor het plannen en rapporteren van EV-isolatie en onderzoeksmethoden, publiceert en actualiseert de International Society for Extracellular Vesicles de MISEV-position paper9. Bovendien biedt het EV-TRACK-consortium een open platform voor het rapporteren van gedetailleerde methodologieën voor EV-isolatie die worden gebruikt in gepubliceerde manuscripten om de transparantie te vergroten10.
In dit protocol werden eerdere methodologieën die werden gebruikt voor de isolatie van EV’s uit zoogdiercelkweekaangepast 11,12 om de isolatie van EV’s uit bacteriële celkweek mogelijk te maken. We hebben geprobeerd methoden te gebruiken die EV-isolatie van een verscheidenheid aan microben mogelijk maken, die schaalbaar kunnen zijn en de zuiverheid en opbrengst van EV’s in evenwicht brengen (zoals besproken in de MISEV-position paper9). Na het verwijderen van bacteriële cellen en puin door centrifugering en filtratie, wordt het kweekmedium geconcentreerd door ultrafiltratie van centrifugaalapparaten (voor een volume tot ~ 100 ml) of pompaangedreven TFF (voor grotere volumes). EV’s worden vervolgens geïsoleerd door SEC met behulp van kolommen die zijn geoptimaliseerd voor de zuivering van kleine EV’s.
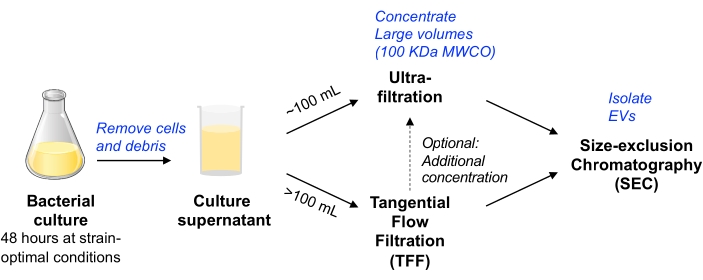
Figuur 1: Bacterial EV isolatie workflow schematisch overzicht. Afkortingen: EV = extracellulair blaasje; TFF = tangentiële stromingsfiltratie; SEC = grootte-uitsluitingschromatografie; MWCO = afsnijding van het molecuulgewicht. Klik hier om een grotere versie van deze figuur te bekijken.
Een muis-commensale stam van Escherichia coli (d.w.z. E. coli MP113) werd gebruikt als een modelorganisme en gemodificeerd om EV-geassocieerd nanoluciferase tot expressie te brengen door fusie tot cytolysine A, zoals eerder gemeld14. De methoden die hier worden gebruikt, kunnen ten minste enkele liters bacterieculturen verwerken en EV-geassocieerde van niet-EV-geassocieerde eiwitten effectief scheiden. Ten slotte kan deze methode ook worden gebruikt voor andere grampositieve en gramnegatieve bacteriesoorten. Alle relevante gegevens van de gerapporteerde experimenten werden ingediend bij de EV-TRACK-kennisbank (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
In het bovenstaande protocol wordt een methode beschreven die schaalbaar is en ev’s betrouwbaar isoleert van verschillende gramnegatieve / positieve en aerobe / anaërobe bacteriën. Het heeft verschillende potentiële stoppunten tijdens de procedure, hoewel het beter is om te voorkomen dat het langer dan 48 uur duurt om EV’s te isoleren van geconditioneerde bacteriële kweekmedia.
Ten eerste bestaat het uit het kweken van bacteriën om geconditioneerd bacteriekweekmedium te genereren. Het ble…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Het hierboven beschreven onderzoek werd ondersteund door NIH TL1 TR002549-03 trainingsbeurs. We bedanken Drs. John C. Tilton en Zachary Troyer (Case Western Reserve University) voor het vergemakkelijken van de toegang tot het deeltjesgrootte-analyse-instrument; Lew Brown (Spectradyne) voor technische assistentie bij de analyse van de deeltjesgrootteverdelingsgegevens; Dr. David Putnam aan de Cornell University voor het verstrekken van pClyA-GFPplasmide 14; en Dr. Mark Goulian aan de Universiteit van Pennsylvania voor het verstrekken van de E. coli MP113.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

