تبلور البروتين عالي الإنتاجية عن طريق غسيل الكلى
Summary
يصف البروتوكول المقدم نهجا مباشرا لفحص ظروف تبلور البروتين ونمو البلورات باستخدام لوحة غسيل الكلى عالية الإنتاجية المكونة من 96 بئرا. كما تم إثبات استخدام أنابيب غسيل الكلى للنمو على نطاق واسع للبلورات الدقيقة لعلم البلورات التسلسلي وتطبيقات MicroED.
Abstract
إن فهم العلاقات بين البنية والوظيفة للجزيئات الكبيرة ، مثل البروتينات ، على المستوى الجزيئي أمر حيوي للطب الحيوي واكتشاف الأدوية الحديثة. حتى الآن ، لا يزال علم البلورات بالأشعة السينية هو الطريقة الأكثر نجاحا لحل هياكل البروتين ثلاثية الأبعاد بدقة ذرية. مع التطورات الحديثة في علم البلورات التسلسلي ، إما باستخدام ليزر الإلكترون الخالي من الأشعة السينية (XFELs) أو مصادر ضوء السنكروترون ، تقدم علم بلورات البروتين إلى الحدود التالية ، حيث توفر القدرة على الحصول على بيانات تم حلها بمرور الوقت رؤى ميكانيكية مهمة في سلوك الجزيئات البيولوجية في درجة حرارة الغرفة. يصف هذا البروتوكول سير عمل مباشر عالي الإنتاجية (HTP) لفحص ظروف التبلور من خلال استخدام لوحة غسيل الكلى ذات 96 بئرا. تتبع هذه اللوحات معيار جمعية الفحص الجزيئي الحيوي (SBS) ويمكن إعدادها بسهولة باستخدام أي مختبر تبلور قياسي. بمجرد تحديد الظروف المثلى ، يمكن إنتاج كميات كبيرة من البلورات (مئات البلورات الدقيقة) باستخدام جهاز غسيل الكلى. للتحقق من متانة وتعدد استخدامات هذا النهج ، تم تبلور أربعة بروتينات مختلفة ، بما في ذلك اثنين من البروتينات الغشائية.
Introduction
على مدى القرن الماضي ، كان علم البلورات بالأشعة السينية حاسما في توضيح وفهم نموذج وظيفة البنية للجزيئات البيولوجية الكبيرة. حتى الآن ، لا تزال واحدة من أنجح الطرق في توضيح هياكل الدقة الذرية للعديد من البروتينات المختلفة بشكل فريد والتي تعتبر حاسمة للفهم الأساسي للكيمياء الحيوية للخلية والطب والاكتشاف المبكر للأدوية 1,2. ومع ذلك ، لا يزال تبلور البروتين عنق الزجاجة في دراسة العديد من أهداف البروتين ، وخاصة البروتينات الغشائية ومجمعات البروتين الكبيرة3. وبالتالي ، يعتبر تبلور البروتين دائما فنا بسبب مناهج التجربة والخطأ كثيفة العمالة المستخدمة4،5،6.
عادة ما يضاف عامل ترسيب إلى محلول بروتيني بتركيز عال لتكوين ترتيب شبكي جيد التنظيم ومنتظم ومتكرر لجزيئات البروتين ، والمعروفة باسم البلورات. في ظل ظروف مواتية ، مثل درجة الحرارة ودرجة الحموضة والتركيز وعامل الراسب ، يتشكل محلول مفرط التشبع في النهاية ، يليه نواة بلورية ونمو 7,8. على الرغم من وجود العديد من التطورات في إعدادات تجارب التبلور ، في الغالب مع تطوير أنظمة روبوتية عالية الإنتاجية وتوافر شاشات “مصفوفة متفرقة” جاهزة ، إلا أن الأساليب العامة لبلورة البروتين ظلت إلى حد كبير دون تغيير على مر السنين. تشمل تقنيات بلورة البروتين التجريبية الشائعة انتشار البخار (قطرة معلقة وقطرة جلوس)9 ، ودفعة صغيرة (تحت الزيت) 10،11 ، ونشر الواجهة الحرة (أجهزة الموائع الدقيقة)12 ، وغسيل الكلى (باستخدام الأزرار والتقنيات الأخرى)13،14،15. ومع ذلك ، توجد أيضا إعدادات أخرى أكثر تخصصا ، مثل مناهج الطور المتوسط لبلورة بروتينات الغشاء16,17. في حين أن غالبية هياكل بروتين الأشعة السينية المودعة في بنك بيانات البروتين قد تم حلها حتى الآن من خلال التبلور بطرق انتشار البخار6،18 ، يبدو أن الأساليب الأخرى ، مثل التبلور عن طريق غسيل الكلى ، غير مستغلة بشكل كاف ، ويرجع ذلك على الأرجح إلى الجوانب العملية المتعلقة بإعدادها التجريبي.
يعتمد التبلور عن طريق غسيل الكلى ببساطة على الانتشار البطيء للمواد المذابة (المرسبات والأيونات والمواد المضافة والمخازن المؤقتة) من خلال غشاء شبه منفذ يمنع جزيئات البروتين من الدوران في نفس الوقت. وبهذه الطريقة، يدخل محلول البروتين ببطء في حالة اتزان، مع وصول الراسب إلى التركيز اللازم للتبلور. تعتمد حركية النظام على درجة الحرارة وتركيز المرسب وقطع الوزن الجزيئي لغشاء السليلوز (MWCO) 19. حتى الآن ، كان إعداد التبلور الأكثر شيوعا عن طريق غسيل الكلى يستخدم أزرار غسيل الكلى الدقيقة المصنوعة من ألواح الأكريليك الشفافة. عادة ما يتم غمرها في الخزانات (في الغالب باستخدام ألواح إسقاط معلقة لنشر البخار) تحتوي على محاليل راسب التبلور. ومع ذلك، تتطلب طريقة الإنتاجية المنخفضة هذه أيضا تجميعا محددا لإغلاق محلول البروتين داخل غشاء غسيل الكلى الموجود فوق حجرة الزر، كما هو موضح في الشكل 1. علاوة على ذلك ، فإن فقاعات الهواء المحبوسة بين غشاء غسيل الكلى ومحلول البروتين هي مشكلة متكررة تضعف نمو البلورات. ومن القيود الأخرى لهذه الطريقة متطلبات العينة، حيث تكون التركيزات والأحجام الأعلى بكثير ضرورية مقارنة بطرق نشر البخار، لاستيعاب أزرار غسيل الكلى. لذلك ، ينظر إلى التبلور باستخدام أزرار غسيل الكلى الدقيقة على أنه طريقة غير جذابة ، خاصة بالنسبة للأهداف الصعبة مثل البروتينات الغشائية ، التي تكون غلات تنقيتها منخفضة بشكل محبط. في الآونة الأخيرة ، تم تطوير أجهزة الموائع الدقيقة لتسهيل تبلور البروتين عن طريق غسيل الكلى15. تم تصميم هذه الرقائق أيضا للحصول على شفافية عالية للأشعة السينية مع خلفية منخفضة ، مما يسمح باستخدام الرقائق لجمع البيانات في الموقع في درجة حرارة الغرفة ، وبالتالي القضاء على إزعاج بلورات الحصاد والتبريد بالتبريد. على الرغم من هذه التطورات ، لا يزال النهج منخفض الإنتاجية ومكلفا للغاية.
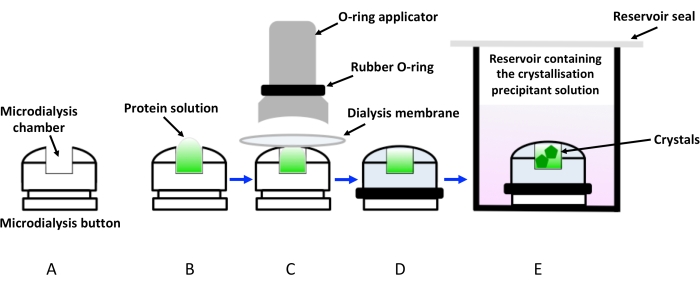
الشكل 1: تمثيل تخطيطي للتبلور عن طريق غسيل الكلى باستخدام أزرار غسيل الكلى. أ: تمثيل تخطيطي لزر غسيل الكلى بالتبلور. (ب) يضاف محلول البروتين إلى حجرة زر غسيل الكلى الدقيق. (ج) يمسك غشاء غسيل الكلى بزر غسيل الكلى بمساعدة حلقة مطاطية (حلقة O) توضع عبر قضيب. (د) زر غسيل الكلى جاهز للغمر في الخزان الذي يحتوي على محلول التبلور (محلول غسيل الكلى)، كما هو موضح في (ه). يجب إغلاق القارورة التي تحتوي على زر غسيل الكلى المغمور لتجنب التبخر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هنا ، يتم تقديم بروتوكول مباشر لفحص ظروف تبلور البروتين ونمو البلورات باستخدام لوحة غسيل الكلى عالية الإنتاجية المكونة من 96 بئرا. تم تصميم هذه الألواح التي تستخدم لمرة واحدة لاستخدامها بشكل مشابه لألواح تبلور انتشار البخار (ماصة ثم ختم) ، كما هو موضح في الشكل 2. يمكن أن تستوعب الألواح ما يصل إلى 3.2 ميكرولتر من البروتين و 350 ميكرولتر من محلول غسيل الكلى. يتميز كل بئر بغشاء سليلوز منفصل مجدد لمنع التلوث المتبادل بين الآبار. يستغرق الإعداد حوالي 10 دقائق لإكماله ولا يتطلب أي معدات متخصصة إلى جانب ما يمكن العثور عليه في جميع مختبرات التبلور القياسية. يتم استخدام أربعة بروتينات مختلفة ، بما في ذلك اثنين من البروتينات الغشائية ، لإثبات هذا النهج والتحقق من صحته كطريقة فعالة لعلم بلورات البروتين عالي الإنتاجية (HTP).
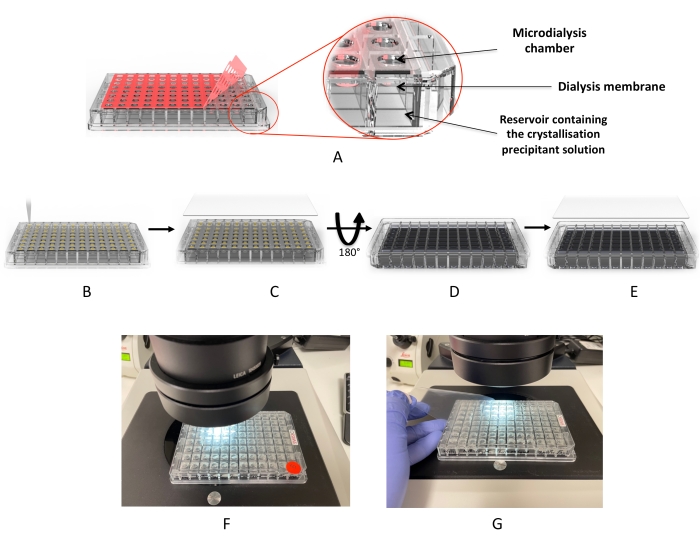
الشكل 2: سير عمل التبلور باستخدام لوحة غسيل الكلى المجهري . (أ) إزالة “فيلم الغطاء” اللاصق الأحمر. ب: توزيع قطرات البروتين في كل بئر من الآبار المتساقطة. (ج) الآبار مغطاة ب “فيلم الغطاء” للأشعة فوق البنفسجية. (د) اللوحة مقلوبة لإضافة محاليل غسيل الكلى (أو غربال التبلور). (ه) الصفيحة محكمة الغلق ومحتضنة. (و ، ز) الفحص المجهري للقطرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إثبات استخدام هذا التبلور بواسطة بروتوكول غسيل الكلى باستخدام أنبوب غسيل الكلى 0.5 مل (الشكل 3) لإنتاج البلورات الدقيقة على نطاق واسع (مئات إلى آلاف) ، وهو مناسب لأحدث طرق جمع البيانات مثل علم البلورات التسلسلي في كل من مرافق XFEL 20،21،22،23،24 والسنكروترونات 25،26،27 ، وكذلك لنهج MicroED28،29،30.
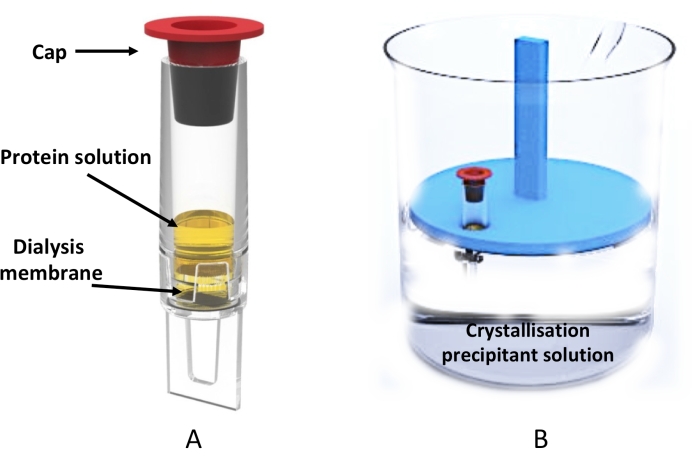
الشكل 3: تبلور غسيل الكلى على نطاق واسع باستخدام أنبوب غسيل الكلى. أ: تمثيل تخطيطي لأنبوب غسيل الكلى سعة 0.5 mL. (ب) منظر جانبي لكأس زجاجية تحتوي على محلول التبلور ورف أنبوب عائم يحمل أنبوب غسيل الكلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
وفي الوقت الراهن، يعد التبلور عن طريق غسيل الكلى أكثر طرق التبلور غير المستغلة، وذلك بسبب انخفاض الإنتاجية والطبيعة المملة للنهج الحالية، مثل غسيل الكلى الدقيق باستخدام الأزرار. هنا ، يتبع بروتوكول بسيط ولكنه قوي سير عمل HTP لنمو بلورات البروتين عن طريق غسيل الكلى من خلال لوحة غسيل الكلى الدقيقة المتاحة تجاريا وأنبوب غسيل الكلى. اعتمادا على البروتين المستهدف ، تأتي لوحة غسيل الكلى الدقيقة وأنبوب غسيل الكلى المستخدم في الإجراء مع اختيار غشاء غسيل الكلى مع 3 أو 5 أو 10 أو 30 كيلو دالتون MWCO. يمكن إعداد البروتوكول بسهولة في أي مرفق تبلور قياسي وله ميزة كبيرة تتمثل في كونه قابلا للتطبيق على كل من البروتينات القابلة للذوبان والغشاء. ومع ذلك ، لم يتم اختبار مجمعات البروتين والبروتين والحمض النووي خلال هذا البروتوكول.
كما هو الحال في أي نهج تبلور عن طريق غسيل الكلى ، فإن نسبة الحجم بين عينة البروتين ومحلول غسيل الكلى أمر بالغ الأهمية. في هذا البروتوكول ، يوصى بنسبة 1: 100 بين العينة ومحلول غسيل الكلى ، ولكن نظرا لأن لوحة غسيل الكلى الدقيقة تسمح بسعة قصوى تبلغ 350 ميكرولتر من محلول غسيل الكلى ، يمكن استكشاف هذه النسب للحصول على ضربات بلورية. يتم استخدام حجم 1-2 ميكرولتر من البروتين في البروتوكول المقدم عند إعداد لوحات التبلور. هذا لضمان ضبط القطرات بدقة باستخدام ماصة يدوية متعددة القنوات. باستخدام الماصات الإلكترونية (ماصات التوزيع متعددة القنوات أو المتكررة) أو روبوتات توزيع السوائل HTP ، يمكن تحقيق قطرات ذات أحجام أقل بدقة ، وبالتالي تقليل كمية البروتين المطلوبة. علاوة على ذلك ، نظرا للأحجام المنخفضة نسبيا من المخزن المؤقت لغسيل الكلى الذي تتطلبه لوحة غسيل الكلى الدقيقة (على عكس طرق غسيل الكلى التقليدية الأخرى) ، فمن الممكن (بدون الاستخدام المكثف للموارد) استكشاف مساحات كيميائية كبيرة ، ليس فقط باستخدام شاشات التبلور المتاحة تجاريا ولكن أيضا مع شاشات التحسين (المصممة حول حالة التبلور الأولية).
تتمثل الخطوة الحاسمة في إجراء HTP المقدم في تطبيق أحجام البروتين الصغيرة في الوقت المناسب (0.50-3.2 ميكرولتر لكل حالة) على لوحة غسيل الكلى للحد من الجفاف وفقدان العينة. يمكن التخفيف من ذلك بسهولة باستخدام ماصة متعددة القنوات أو ماصة توزيع متكررة أو نظام بلورة روبوتي. قد يؤدي وقت الحضانة الطويل ، مثل أكثر من أسبوعين ، للألواح عند 20 درجة مئوية إلى جفاف قطرات البروتين أو تلف البلورات المشكلة حديثا. يمكن أن يؤدي الاحتفاظ بألواح غسيل الكلى داخل غرفة الترطيب أو كيس قابل للغلق إلى تخفيف هذا التأثير. بالإضافة إلى ذلك ، يوصى باستخدام مواد وتقنيات معقمة لتجنب نمو البكتيريا.
كما ذكر في المقدمة ، في الآونة الأخيرة ، مع زيادة الحاجة إلى فهم الديناميات الهيكلية للبروتين لآليات المرض ، وتفاعلات ربط البروتين والليجند ، وتفاعلات البروتين والبروتين ، تم إحداث ثورة في مجال علم البلورات بالأشعة السينية للبروتين من خلال تطوير تقنيات التبلور الجديدة والحالية ، والأساليب الحديثة لتسليم عينات البلورات ، والأجيال الجديدة من مصادر الأشعة السينية ، وطرق متطورة جديدة للحصول على البيانات ومعالجتها36 ، 37,38. لذلك ، ظهر ظهور علم البلورات الدقيقة التسلسلي بدرجة حرارة الغرفة ، إما باستخدام XFELs أو مصادر ضوء السنكروترون ، كأداة رائعة في علم الأحياء الهيكلي ، وتحديدا في مجال البروتينات الغشائية39. ومع ذلك ، هناك حاجة إلى الآلاف من البلورات الدقيقة لتوليد بيانات كافية لحل بنية قوي ، وهي ليست مهمة سهلة (على الأقل بطرق التبلور التقليدية). تتيح طريقة تبلور غسيل الكلى الموصوفة هنا إنتاج عدد كبير من البلورات الدقيقة. بمجرد تحديد حالة التبلور لإنتاج البلورات الدقيقة (1-10 ميكرومتر) من خلال استخدام لوحة غسيل الكلى الدقيقة ، يمكن إنتاج كميات كبيرة من البلورات الدقيقة عالية الكثافة باستخدام جهاز غسيل الكلى 0.5 مل (الشكل 5). هذه البلورات مناسبة بشكل مثالي لجمع البيانات باستخدام أهداف ثابتة أو أنظمة توصيل العينات النفاثة السائلة27,40. يمكن أن تكون البلورات التي تم الحصول عليها من خلال هذه الطريقة مناسبة أيضا لتطبيقات MicroED. ومع ذلك ، قد تحتاج إلى طحنها إلى حجم وسمك مناسبين لهذا التطبيق المحدد ، حيث تتفاعل الإلكترونات بقوة أكبر مع البلورات من فوتونات الأشعة السينية41.
في الختام ، يضيف نهج التبلور عن طريق غسيل الكلى الموصوف هنا إلى الاستراتيجيات المتطورة في بلورة البروتين لتحديد البنية ويوسع نطاق الجهود التي يمكن استخدامها لتحديد أهداف البروتين الجديدة التي لم تنجح في السابق مع الطرق التقليدية الأخرى.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نحن نعترف بالتمويل من وزارة الأعمال والطاقة والاستراتيجية الصناعية في المملكة المتحدة (BEIS). نشكر أليكس آر جونز ومايك شو من المختبر الفيزيائي الوطني على ملاحظاتهم على المخطوطة.
Materials
| 0.2 mL tubes | Thermo Scientific | AB0620 | For aliquoting protein solutions. |
| 0.2 µm syringe filter | Sartorius | 17823———-K | Surfactant-free cellulose acetate filters. For filtering dialysis solutions. |
| 0.22 µm membrane filters | Millipore | GSTF04700 | Membrane filters for filtering large volumes of buffers |
| 12-channel, variable 0.5 – 10 µL Research plus pipette | Eppendorf | 3125000028 | For dispensing protein drops onto the Diaplate. |
| 12-channel, variable 30 – 300 µL Eppendorf Research plus pipette | Eppendorf | 3125000060 | For dispensing dialysis solutions on the Diaplate reservoirs. |
| 20 mL syringe | Fisherbrand | 15889152 | For use with syringe filters. |
| 96 well 2.2 mL deep-well plates | Thermo Scientific | AB0788 | Polypropylene deep-well storage plates; for preparing screens using the Hamilton Microlab STARlet. |
| Centrifuge 5425 | Eppendorf | 5405000565 | With rotor FA-24×2 with a maximum g-force of 21,300 x g. |
| Diacon dialyser | SWISSCI | W72010 | Dialyzer tubes with a regenerated cellulose membrane with a molecular weight cut-off of 10 kDa. Ideal for protein solutions of up to 0.5 mL. |
| Diaplate 96-well plate | SWISSCI | W82010 | Microdialysis plate. The Diaplate consists of two sides with a regenerated cellulose membrane in-between with a molecular weight cut-off of 10 kDa. |
| Falcon 50 mL High Clarity PP Centrifuge Tube | Corning | 352070 | For holding dialysis solutions. |
| Floating rack | SWISSCI | n/a | Included in the Diacon kit |
| Floor-standing vibration-free incubator | Molecular Dimensions | MD5-01 | 400 L temperature-controlled incubator set to 20 °C. |
| Leica M205 C stereo microscope | Leica | Planapo 1.0x objective, 7.8x – 160x zoom range with DMC 4500 camera | |
| Lysozyme from chicken egg white | Sigma Aldrich | 62971 | Lyophilized protein |
| Memgold2 | Molecular Dimensions | MD1-64 | Sparse-matrix screen |
| Microlab STARlet | Hamilton | n/a | Liquid handler system. |
| Reservoir cover film | SWISSCI | n/a | Included in the Diaplate kit |
| Reusable bottle top filter | Thermo Scientific | DS0320-5045 | For fitering large volumes of buffers, for use with 0.22 µm membrane filters |
| Sealing paddle | SWISSCI | n/a | Included in the Diaplate kit |
| Thaumatin from Thaumatococcus daniellii | Sigma Aldrich | T7638 | Lyophilized protein |
| UV cover film | SWISSCI | n/a | Included in the Diaplate kit |
References
- Brooks-Bartlett, J. C., Garman, E. F. The nobel science: One hundred years of crystallography. Interdisciplinary Science Reviews. 40 (3), 244-264 (2015).
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), (2020).
- Kwan, T. O. C., Axford, D., Moraes, I. Membrane protein crystallography in the era of modern structural biology. Biochemical Society Transactions. 48 (6), 2505-2524 (2020).
- Birch, J., et al. The fine art of integral membrane protein crystallisation. Methods. 147, 150-162 (2018).
- Gorrec, F., Löwe, J. Automated protocols for macromolecular crystallization at the MRC laboratory of molecular biology. Journal of Visualized Experiments. 131 (131), (2018).
- Govada, L., Chayen, N. E. Choosing the method of crystallization to obtain optimal results. Crystals. 9 (2), 106 (2019).
- Chayen, N. E. Turning protein crystallisation from an art into science. Current Opinion in Structural Biology. 14 (5), 577-583 (2004).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F: Structural Biology Communications. 70 (1), 2-20 (2014).
- Gulbis, J. Protein crystallography: methods and protocols. Crystallography Reviews. 24 (2), 136-143 (2018).
- D’Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Shaw Stewart, ., D, P., Kolek, S. A., Briggs, R. A., Chayen, N. E., Baldock, P. F. Random microseeding: a theoretical and practical exploration of seed stability and seeding techniques for successful protein crystallization. Crystal Growth & Design. 11 (8), 3432-3441 (2011).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20 (2), 296-310 (2020).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), 686-698 (2020).
- Vahdatahar, E., Junius, N., Budayova-Spano, M. Optimization of crystal growth for neutron macromolecular crystallography. Journal of Visualized Experiments. 169, (2021).
- Jaho, S., et al. Crystallization of proteins on chip by microdialysis for in situ X-ray diffraction studies. Journal of Visualized Experiments. 170, (2021).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. Journal of Visualized Experiments. 49, 2501 (2011).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lipidic bicelle method. Journal of Visualized Experiments. 59, (2012).
- Parker, J. L., Newstead, S. Membrane protein crystallisation: Current trends and future perspectives. Advances in Experimental Medicine and Biology. 922. , 61-72 (2016).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semi-permeable membranes and of convection. Crystal Growth & Design. 20 (6), 3927-3936 (2020).
- Neutze, R., Wouts, R., Vander Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-78 (2011).
- Mizohata, E., Nakane, T., Fukuda, Y., Nango, E., Iwata, S. Serial femtosecond crystallography at the SACLA: breakthrough to dynamic structural biology. Biophysical Reviews. 10 (2), 209-218 (2018).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Johansson, L. C., et al. XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569 (7755), 289-292 (2019).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73 (4), 373-378 (2017).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature communications. 8 (1), 542 (2017).
- Axford, D., et al. Two states of a light-sensitive membrane protein captured at room temperature using thin-film sample mounts. Acta Crystallographica Section D: Structural Biology. 78 (1), 52-58 (2022).
- Nannenga, B. L., Gonen, T. The cryo-EM method microcrystal electron diffraction (MicroED). Nature Methods. 16 (5), 369-379 (2019).
- Nguyen, C., Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology. 64, 51-58 (2020).
- Mu, X., Gillman, C., Nguyen, C., Gonen, T. An overview of microcrystal electron diffraction (MicroED). Annual Review of Biochemistry. 90, 431-450 (2021).
- Kwan, T. O. C., et al. Selection of biophysical methods for characterisation of membrane proteins. International Journal of Molecular Sciences. 22 (10), 2605 (2019).
- Pos, K. M., Purification Diederichs, K. crystallization and preliminary diffraction studies of AcrB, an inner-membrane multi-drug efflux protein. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1865-1867 (2002).
- Guan, L., Mirza, O., Verner, G., Iwata, S., Kaback, H. R. Structural determination of wild-type lactose permease. Proceedings of the National Academy of Sciences. 104 (39), 15294-15298 (2007).
- Kwan, T. O. C., Reis, R., Moraes, I. In situ measurements of polypeptide samples by dynamic light scattering: membrane proteins, a case study. Methods in Molecular Biology. , 189-202 (2021).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA)-Biomembranes. (1-2), 105-117 (2004).
- Wickstrand, C., et al. A tool for visualizing protein motions in time-resolved crystallography. Structural Dynamics. 7 (2), 024701 (2020).
- Orville, A. M. Recent results in time resolved serial femtosecond crystallography at XFELs. Current Opinion in Structural Biology. 65, 193-208 (2020).
- Schulz, E. C., Yorke, B. A., Pearson, A. R., Mehrabi, P. Best practices for time-resolved serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 78 (1), 14-29 (2022).
- Neutze, R., Brändén, G., Schertler, G. F. Membrane protein structural biology using X-ray free eletron lasers. Current Opinion in Structural Biology. 33, 115-125 (2015).
- Wierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337 (2014).
- Shi, D., Nannenga, B. L., Iadanza, M. G., Gonen, T. Three-dimensional electron crystallography of protein microcrystals. eLife. 2, 01345 (2013).

