Mikrodiyaliz ile Yüksek Verimli Protein Kristalizasyonu
Summary
Sunulan protokol, 96 kuyucuklu yüksek verimli bir diyaliz plakası kullanarak protein kristalleşme koşullarını ve kristal büyümesini taramak için basit bir yaklaşımı açıklamaktadır. Mikrokristallerin büyük ölçekli büyümesi için diyalizör tüplerinin kullanımı, seri kristalografi ve MicroED uygulamaları için de gösterilmiştir.
Abstract
Proteinler gibi makromoleküllerin yapı-fonksiyon ilişkilerini moleküler düzeyde anlamak, biyotıp ve modern ilaç keşfi için hayati önem taşımaktadır. Bugüne kadar, X-ışını kristalografisi, üç boyutlu protein yapılarını atomik çözünürlükte çözmek için en başarılı yöntem olmaya devam etmektedir. X-ışını serbest elektron lazerleri (XFEL’ler) veya senkrotron ışık kaynakları kullanan seri kristalografideki son gelişmelerle birlikte, protein kristalografisi, zamana bağlı veri elde etme yeteneğinin, biyolojik moleküllerin oda sıcaklığındaki davranışlarına önemli mekanik bilgiler sağladığı bir sonraki sınıra ilerlemiştir. Bu protokol, 96 delikli bir diyaliz plakası kullanarak kristalleşme koşullarını taramak için basit bir yüksek verimli (HTP) iş akışını açıklar. Bu plakalar Biyomoleküler Tarama Derneği (SBS) standardını takip eder ve herhangi bir standart kristalizasyon laboratuvarı kullanılarak kolayca kurulabilir. En uygun koşullar belirlendikten sonra, diyalizör kullanılarak büyük miktarlarda kristal (yüzlerce mikrokristal) üretilebilir. Bu yaklaşımın sağlamlığını ve çok yönlülüğünü doğrulamak için, iki membran proteini de dahil olmak üzere dört farklı protein kristalize edildi.
Introduction
Geçen yüzyıl boyunca, X-ışını kristalografisi, biyolojik makromoleküllerin yapı-işlev paradigmasını aydınlatmada ve anlamada kritik öneme sahiptir. Bugüne kadar, hücre biyokimyası, tıp ve erken ilaç keşfinin temel anlayışı için çok önemli olan birçok benzersiz farklı proteinin atomik çözünürlük yapılarını aydınlatmada en başarılı yöntemlerden biri olmaya devam etmektedir 1,2. Bununla birlikte, protein kristalizasyonu, birçok protein hedefinin, özellikle membran proteinlerinin ve büyük protein komplekslerinin incelenmesinde bir darboğaz olmaya devam etmektedir3. Sonuç olarak, protein kristalizasyonu, 4,5,6’da kullanılan emek yoğun deneme-yanılma yaklaşımları nedeniyle neredeyse her zaman bir sanat olarak kabul edilir.
Bir çökeltici ajan genellikle kristaller olarak bilinen protein moleküllerinin iyi sıralanmış, düzenli ve tekrarlayan bir kafes düzenlemesini oluşturmak için yüksek konsantrasyonda bir protein çözeltisine eklenir. Sıcaklık, pH, konsantrasyon ve çökeltici madde gibi elverişli koşullar altında, sonunda aşırı doymuş bir çözelti oluşur, bunu kristal çekirdeklenme ve büyüme 7,8 izler. Kristalizasyon deneme kurulumlarında, ağırlıklı olarak yüksek verimli robotik sistemlerin geliştirilmesi ve hazır “seyrek matris” ekranlarının mevcudiyeti ile birçok ilerleme olmasına rağmen, protein kristalizasyonuna yönelik genel yaklaşımlar yıllar içinde büyük ölçüde değişmeden kalmıştır. Yaygın deneysel protein kristalizasyon teknikleri arasında buhar difüzyonu (asılı damla ve oturma damlası)9, mikroparti (yağ altında)10,11, serbest arayüzlü difüzyon (mikroakışkan cihazlar)12 ve diyaliz (düğmeler ve diğer teknikler kullanılarak)13,14,15 bulunur. Bununla birlikte, membran proteinlerini kristalize etmek için mezofaz yaklaşımları gibi daha uzmanlaşmış başka kurulumlar da mevcuttur16,17. Protein Veri Bankası’nda biriken X-ışını protein yapılarının çoğunluğu şimdiye kadar buhar difüzyonyöntemleri 6,18 ile kristalizasyon yoluyla çözülmüş olsa da, diyaliz ile kristalleşme gibi diğer yaklaşımlar, muhtemelen deney kurulumlarıyla ilgili pratik yönlerden dolayı, yetersiz kullanılmış gibi görünmektedir.
Diyaliz ile kristalleşme, çözünenlerin (çökeltiler, iyonlar, katkı maddeleri ve tamponlar) aynı anda protein moleküllerinin dolaşımını önleyen yarı geçirgen bir zardan yavaş difüzyonuna dayanır. Bu şekilde, protein çözeltisi yavaşça dengeye getirilir ve çökeltici kristalleşmek için gerekli konsantrasyona ulaşır. Sistemin kinetiği sıcaklığa, çökeltici konsantrasyonuna ve selüloz membran moleküler ağırlık kesme (MWCO)19’a bağlıdır. Bugüne kadar, diyaliz ile en popüler kristalizasyon kurulumu, şeffaf akrilik levhalardan yapılmış mikrodiyaliz düğmeleri kullanıyordu. Bunlar genellikle kristalleşme çökeltici çözeltilerini içeren rezervuarlara (çoğunlukla buhar difüzyonu asılı damla plakaları kullanılarak) daldırılır. Bununla birlikte, bu düşük verimli yöntem, Şekil 1’de gösterildiği gibi, düğme odasının üzerine yerleştirilen diyaliz zarı içindeki protein çözeltisini kapatmak için özel bir montaj gerektirir. Ayrıca, diyaliz zarı ile protein çözeltisi arasında sıkışan hava kabarcıkları, kristal büyümesini bozan sık görülen bir sorundur. Yöntemin bir diğer kısıtlaması, diyaliz düğmelerini yerleştirmek için buhar difüzyon yöntemlerine kıyasla çok daha yüksek konsantrasyonların ve hacimlerin gerekli olduğu numune gereksinimleridir. Bu nedenle, mikrodiyaliz düğmeleri kullanılarak kristalizasyon, özellikle saflaştırma verimleri sinir bozucu derecede düşük olan membran proteinleri gibi zor hedefler için çekici olmayan bir yöntem olarak algılanmıştır. Son zamanlarda, diyaliz ile protein kristalizasyonunu kolaylaştırmak için mikroakışkan cihazlar geliştirilmiştir15. Bu çipler aynı zamanda düşük arka plana sahip yüksek X-ışını şeffaflığına sahip olacak şekilde tasarlanmıştır, bu da çiplerin oda sıcaklığında yerinde veri toplanması için kullanılmasına izin verir, böylece hasat ve kriyosoğutma kristallerinin rahatsızlığını ortadan kaldırır. Bu ilerlemelere rağmen, yaklaşım hala çok düşük verimli ve pahalıdır.
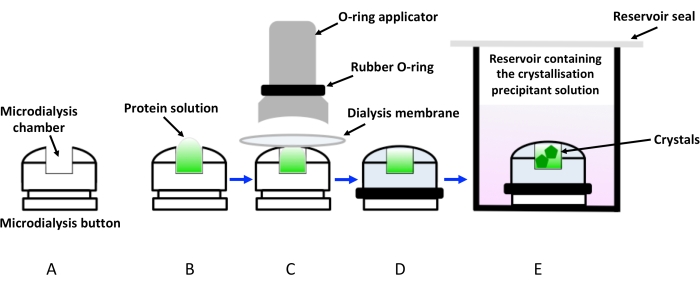
Resim 1: Diyaliz butonları kullanılarak diyaliz ile kristalizasyonun şematik gösterimi. (A) Bir kristalleşme diyaliz düğmesinin şematik gösterimi. (B) Protein çözeltisi mikrodiyaliz düğme odasına eklenir. (C) Diyaliz zarı, bir aplikatör aracılığıyla uygulanan kauçuk bir halka (O-ring) yardımıyla mikrodiyaliz düğmesine tutulur. (D) Diyaliz düğmesi, (E)’de gösterildiği gibi kristalleşme solüsyonunu (diyaliz solüsyonu) içeren hazneye daldırılmaya hazırdır. Daldırılmış diyaliz düğmesini içeren şişe, buharlaşmayı önlemek için kapatılmalıdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Burada, 96 kuyucuklu yüksek verimli diyaliz plakasını kullanarak protein kristalleşme koşullarını ve kristal büyümesini taramak için basit bir protokol sunulmaktadır. Bu tek kullanımlık plakalar, Şekil 2’de gösterildiği gibi buhar difüzyon kristalizasyon plakalarına (pipet sonra conta) benzer şekilde kullanılmak üzere tasarlanmıştır. Plakalar 3.2 μL’ye kadar protein ve 350 μL’ye kadar diyaliz çözeltisi barındırabilir. Her kuyu, kuyular arasında çapraz kontaminasyonu önlemek için ayrı bir rejenere selüloz membranına sahiptir. Kurulumun tamamlanması yaklaşık 10 dakika sürer ve tüm standart kristalizasyon laboratuvarlarında bulunanların yanı sıra herhangi bir özel ekipman gerektirmez. İki membran proteini de dahil olmak üzere dört farklı protein, bu yaklaşımı yüksek verimli (HTP) protein kristalografisi için etkili bir yöntem olarak göstermek ve doğrulamak için kullanılır.
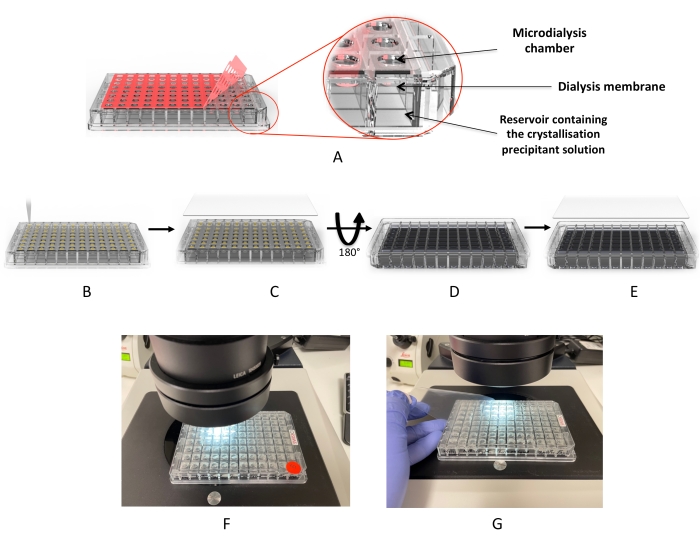
Şekil 2: Mikrodiyaliz plakasını kullanarak kristalizasyon iş akışı . (A) Kırmızı yapışkan “kapak filminin” çıkarılması. (B) Protein damlacıklarının damla kuyucuklarının her birine dağıtılması. (C) Kuyular UV “kapak filmi” ile kaplanmıştır. (D) Plaka, diyaliz solüsyonlarını (veya kristalizasyon eleğini) eklemek için ters çevrilir. (E) Plaka mühürlenir ve inkübe edilir. (F,G) Damlaların mikroskop muayenesi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Bu kristalizasyonun diyaliz protokolü ile kullanımı, hem XFEL tesislerinde seri kristalografi20,21,22,23,24 hem de senkrotronlar 25,26,27’de seri kristalografi gibi son teknoloji ürünü veri toplama yöntemleri için uygun olan mikrokristallerin büyük ölçekli (yüz ila binlerce) üretimi için 0,5 mL diyalizör tüpü (Şekil 3) kullanılarak gösterilmiştir , MicroED 28,29,30 yaklaşımlarının yanı sıra.
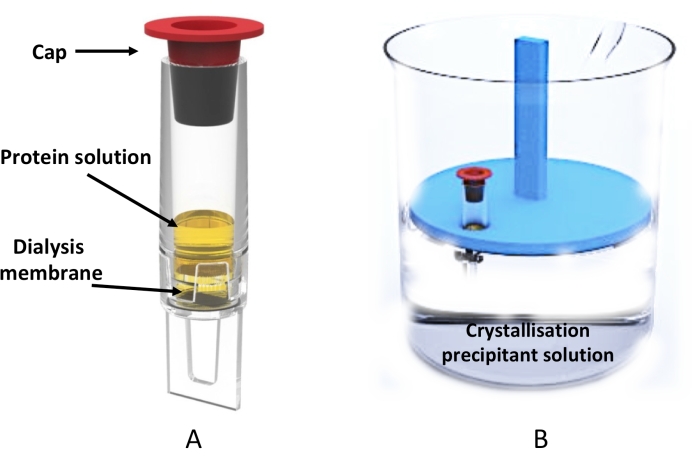
Resim 3: Diyalizör tüpü kullanılarak büyük ölçekli mikrodiyaliz kristalizasyonu . (A) 0,5 mL diyalizör tüpünün şematik gösterimi. (B) Kristalleşme çözeltisini içeren bir beherin ve diyalizör tüpünü tutan yüzer tüp rafının yandan görünümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Şu anda, diyaliz ile kristalizasyon, düğmelerle mikrodiyaliz gibi mevcut yaklaşımların düşük verimli ve sıkıcı doğası nedeniyle, en az kullanılan kristalizasyon yöntemidir. Burada, basit ama sağlam bir protokol, ticari olarak temin edilebilen bir mikrodiyaliz plakası ve diyalizör tüpü aracılığıyla diyaliz yoluyla protein kristal büyümesi için bir HTP iş akışını izler. Hedef proteine bağlı olarak, prosedürde kullanılan mikrodiyaliz plakası ve diyalizör tüpü, 3, 5, 10 veya 30 kDa MWCO’lu bir diyaliz zarı seçeneği ile birlikte gelir. Protokol, herhangi bir standart kristalizasyon tesisinde kolayca kurulabilir ve hem çözünür hem de membran proteinlerine uygulanabilir olma avantajına sahiptir. Bununla birlikte, protein-protein ve protein-nükleik asit kompleksleri bu protokol sırasında test edilmemiştir.
Diyaliz ile herhangi bir kristalizasyon yaklaşımında olduğu gibi, protein numunesi ile diyaliz çözeltisi arasındaki hacim oranı kritik öneme sahiptir. Bu protokolde, numune ve diyaliz çözeltisi arasında 1:100’lük bir oran önerilir, ancak mikrodiyaliz plakası maksimum 350 μL diyaliz çözeltisi kapasitesine izin verdiğinden, kristal vuruşları elde etmek için bu oranlar araştırılabilir. Kristalizasyon plakaları kurulurken sunulan protokolde 1-2 μL’lik bir protein hacmi kullanılır. Bunun amacı, manuel çok kanallı pipet ile damlaların doğru şekilde ayarlanmasını sağlar. Elektronik pipetler (çok kanallı veya tekrarlı dağıtım pipetleri) veya HTP sıvı dağıtım robotları kullanılarak, daha düşük hacimlerde düşüşler doğru bir şekilde elde edilebilir, böylece gerekli protein miktarı azaltılabilir. Ayrıca, mikrodiyaliz plağının gerektirdiği nispeten düşük diyaliz tamponu hacimleri nedeniyle (diğer geleneksel diyaliz yöntemlerinin aksine), sadece ticari olarak temin edilebilen kristalizasyon ekranlarını kullanarak değil, aynı zamanda optimizasyon ekranlarıyla (ilk kristalleşme vuruş koşulu etrafında tasarlanmış) geniş kimyasal alanları keşfetmek (kaynakların yaygın kullanımı olmadan) mümkündür.
Sunulan HTP prosedüründe kritik bir adım, dehidrasyonu ve numune kaybını sınırlamak için diyaliz plağına küçük protein hacimlerinin (koşul başına 0.50-3.2 μL) zamanında uygulanmasıdır. Bu, çok kanallı pipet, tekrar eden dağıtım pipeti veya robotik kristalizasyon sistemi kullanılarak kolayca azaltılabilir. Plakaların 20 ° C’de 2 haftadan fazla gibi uzun inkübasyon süresi, protein damlacıklarının dehidrasyonuna veya yakın zamanda oluşan kristallerin zarar görmesine neden olabilir. Diyaliz plakalarını bir nemlendirme odasının veya kapatılabilir bir torbanın içinde tutmak bu etkiyi hafifletebilir. Ek olarak, bakteri üremesini önlemek için steril malzemeler ve teknikler kullanılması önerilir.
Girişte belirtildiği gibi, son zamanlarda, hastalık mekanizmaları, protein-ligand bağlanma etkileşimleri ve protein-protein etkileşimleri için protein yapısal dinamiklerini anlama ihtiyacının artmasıyla, protein X-ışını kristalografisi alanı, yeni ve mevcut kristalizasyon tekniklerinin, kristal numune dağıtımına modern yaklaşımların, yeni nesil X-ışını kaynaklarının ve veri toplama ve işleme için yeni sofistike yöntemlerin geliştirilmesiyle devrim yaratmıştır36 ,37,38. Bu nedenle, XFEL’ler veya senkrotron ışık kaynakları kullanılarak gerçekleştirilen oda sıcaklığı seri mikro-kristalografisinin ortaya çıkışı, yapısal biyolojide, özellikle membran proteinleri alanında dikkate değer bir araç olarak ortaya çıkmıştır39. Bununla birlikte, sağlam bir yapı çözümü için yeterli veri üretmek için binlerce mikrokristal gereklidir, bu kolay bir iş değildir (en azından geleneksel kristalizasyon yöntemleriyle). Burada açıklanan diyaliz kristalizasyon yöntemi, çok sayıda mikrokristalin üretilmesini sağlar. Bir mikrodiyaliz plağı kullanılarak mikrokristallerin (1-10 μm) üretimi için kristalleşme koşulu belirlendikten sonra, 0,5 mL diyalizör cihazı kullanılarak büyük miktarlarda yüksek yoğunluklu mikrokristaller üretilebilir (Şekil 5). Bu kristaller, sabit hedefler veya sıvı jet numune dağıtım sistemleri27,40 kullanılarak veri toplama için idealdir. Bu yöntemle elde edilen kristaller MicroED uygulamaları için de uygun olabilir. Bununla birlikte, elektronlar kristallerle X-ışını fotonları41’den çok daha güçlü bir şekilde etkileşime girdiğinden, bunların bu özel uygulama için uygun bir boyut ve kalınlığa indirilmesi gerekebilir.
Sonuç olarak, burada tarif edilen diyaliz ile kristalizasyon yaklaşımı, yapı tayini için protein kristalizasyonunda gelişen stratejilere katkıda bulunmakta ve daha önce diğer geleneksel yöntemlerle başarısız olan yeni protein hedeflerini belirlemek için kullanılabilecek çaba yelpazesini genişletmektedir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Birleşik Krallık İşletme, Enerji ve Endüstriyel Strateji Bakanlığı’ndan (BEIS) gelen fonları kabul ediyoruz. Ulusal Fizik Laboratuvarı’ndan Alex R. Jones ve Mike Shaw’a makale hakkındaki geri bildirimleri için teşekkür ederiz.
Materials
| 0.2 mL tubes | Thermo Scientific | AB0620 | For aliquoting protein solutions. |
| 0.2 µm syringe filter | Sartorius | 17823———-K | Surfactant-free cellulose acetate filters. For filtering dialysis solutions. |
| 0.22 µm membrane filters | Millipore | GSTF04700 | Membrane filters for filtering large volumes of buffers |
| 12-channel, variable 0.5 – 10 µL Research plus pipette | Eppendorf | 3125000028 | For dispensing protein drops onto the Diaplate. |
| 12-channel, variable 30 – 300 µL Eppendorf Research plus pipette | Eppendorf | 3125000060 | For dispensing dialysis solutions on the Diaplate reservoirs. |
| 20 mL syringe | Fisherbrand | 15889152 | For use with syringe filters. |
| 96 well 2.2 mL deep-well plates | Thermo Scientific | AB0788 | Polypropylene deep-well storage plates; for preparing screens using the Hamilton Microlab STARlet. |
| Centrifuge 5425 | Eppendorf | 5405000565 | With rotor FA-24×2 with a maximum g-force of 21,300 x g. |
| Diacon dialyser | SWISSCI | W72010 | Dialyzer tubes with a regenerated cellulose membrane with a molecular weight cut-off of 10 kDa. Ideal for protein solutions of up to 0.5 mL. |
| Diaplate 96-well plate | SWISSCI | W82010 | Microdialysis plate. The Diaplate consists of two sides with a regenerated cellulose membrane in-between with a molecular weight cut-off of 10 kDa. |
| Falcon 50 mL High Clarity PP Centrifuge Tube | Corning | 352070 | For holding dialysis solutions. |
| Floating rack | SWISSCI | n/a | Included in the Diacon kit |
| Floor-standing vibration-free incubator | Molecular Dimensions | MD5-01 | 400 L temperature-controlled incubator set to 20 °C. |
| Leica M205 C stereo microscope | Leica | Planapo 1.0x objective, 7.8x – 160x zoom range with DMC 4500 camera | |
| Lysozyme from chicken egg white | Sigma Aldrich | 62971 | Lyophilized protein |
| Memgold2 | Molecular Dimensions | MD1-64 | Sparse-matrix screen |
| Microlab STARlet | Hamilton | n/a | Liquid handler system. |
| Reservoir cover film | SWISSCI | n/a | Included in the Diaplate kit |
| Reusable bottle top filter | Thermo Scientific | DS0320-5045 | For fitering large volumes of buffers, for use with 0.22 µm membrane filters |
| Sealing paddle | SWISSCI | n/a | Included in the Diaplate kit |
| Thaumatin from Thaumatococcus daniellii | Sigma Aldrich | T7638 | Lyophilized protein |
| UV cover film | SWISSCI | n/a | Included in the Diaplate kit |
References
- Brooks-Bartlett, J. C., Garman, E. F. The nobel science: One hundred years of crystallography. Interdisciplinary Science Reviews. 40 (3), 244-264 (2015).
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), (2020).
- Kwan, T. O. C., Axford, D., Moraes, I. Membrane protein crystallography in the era of modern structural biology. Biochemical Society Transactions. 48 (6), 2505-2524 (2020).
- Birch, J., et al. The fine art of integral membrane protein crystallisation. Methods. 147, 150-162 (2018).
- Gorrec, F., Löwe, J. Automated protocols for macromolecular crystallization at the MRC laboratory of molecular biology. Journal of Visualized Experiments. 131 (131), (2018).
- Govada, L., Chayen, N. E. Choosing the method of crystallization to obtain optimal results. Crystals. 9 (2), 106 (2019).
- Chayen, N. E. Turning protein crystallisation from an art into science. Current Opinion in Structural Biology. 14 (5), 577-583 (2004).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F: Structural Biology Communications. 70 (1), 2-20 (2014).
- Gulbis, J. Protein crystallography: methods and protocols. Crystallography Reviews. 24 (2), 136-143 (2018).
- D’Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Shaw Stewart, ., D, P., Kolek, S. A., Briggs, R. A., Chayen, N. E., Baldock, P. F. Random microseeding: a theoretical and practical exploration of seed stability and seeding techniques for successful protein crystallization. Crystal Growth & Design. 11 (8), 3432-3441 (2011).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20 (2), 296-310 (2020).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), 686-698 (2020).
- Vahdatahar, E., Junius, N., Budayova-Spano, M. Optimization of crystal growth for neutron macromolecular crystallography. Journal of Visualized Experiments. 169, (2021).
- Jaho, S., et al. Crystallization of proteins on chip by microdialysis for in situ X-ray diffraction studies. Journal of Visualized Experiments. 170, (2021).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. Journal of Visualized Experiments. 49, 2501 (2011).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lipidic bicelle method. Journal of Visualized Experiments. 59, (2012).
- Parker, J. L., Newstead, S. Membrane protein crystallisation: Current trends and future perspectives. Advances in Experimental Medicine and Biology. 922. , 61-72 (2016).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semi-permeable membranes and of convection. Crystal Growth & Design. 20 (6), 3927-3936 (2020).
- Neutze, R., Wouts, R., Vander Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-78 (2011).
- Mizohata, E., Nakane, T., Fukuda, Y., Nango, E., Iwata, S. Serial femtosecond crystallography at the SACLA: breakthrough to dynamic structural biology. Biophysical Reviews. 10 (2), 209-218 (2018).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Johansson, L. C., et al. XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569 (7755), 289-292 (2019).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73 (4), 373-378 (2017).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature communications. 8 (1), 542 (2017).
- Axford, D., et al. Two states of a light-sensitive membrane protein captured at room temperature using thin-film sample mounts. Acta Crystallographica Section D: Structural Biology. 78 (1), 52-58 (2022).
- Nannenga, B. L., Gonen, T. The cryo-EM method microcrystal electron diffraction (MicroED). Nature Methods. 16 (5), 369-379 (2019).
- Nguyen, C., Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology. 64, 51-58 (2020).
- Mu, X., Gillman, C., Nguyen, C., Gonen, T. An overview of microcrystal electron diffraction (MicroED). Annual Review of Biochemistry. 90, 431-450 (2021).
- Kwan, T. O. C., et al. Selection of biophysical methods for characterisation of membrane proteins. International Journal of Molecular Sciences. 22 (10), 2605 (2019).
- Pos, K. M., Purification Diederichs, K. crystallization and preliminary diffraction studies of AcrB, an inner-membrane multi-drug efflux protein. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1865-1867 (2002).
- Guan, L., Mirza, O., Verner, G., Iwata, S., Kaback, H. R. Structural determination of wild-type lactose permease. Proceedings of the National Academy of Sciences. 104 (39), 15294-15298 (2007).
- Kwan, T. O. C., Reis, R., Moraes, I. In situ measurements of polypeptide samples by dynamic light scattering: membrane proteins, a case study. Methods in Molecular Biology. , 189-202 (2021).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA)-Biomembranes. (1-2), 105-117 (2004).
- Wickstrand, C., et al. A tool for visualizing protein motions in time-resolved crystallography. Structural Dynamics. 7 (2), 024701 (2020).
- Orville, A. M. Recent results in time resolved serial femtosecond crystallography at XFELs. Current Opinion in Structural Biology. 65, 193-208 (2020).
- Schulz, E. C., Yorke, B. A., Pearson, A. R., Mehrabi, P. Best practices for time-resolved serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 78 (1), 14-29 (2022).
- Neutze, R., Brändén, G., Schertler, G. F. Membrane protein structural biology using X-ray free eletron lasers. Current Opinion in Structural Biology. 33, 115-125 (2015).
- Wierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337 (2014).
- Shi, D., Nannenga, B. L., Iadanza, M. G., Gonen, T. Three-dimensional electron crystallography of protein microcrystals. eLife. 2, 01345 (2013).

