عزل وإدماج هوائيات حصاد الضوء من دياتوم مينيغينيانا سيكلوتيلا في الدهنية مع الدهون ثايلاكويد
Summary
نقدم هنا، بروتوكولا لعزل فوكوكسانثين الكلوروفيل المكيفات ملزم البروتينات (FCP) من الدياتومات ودمجها في الدهنية مع التراكيب الدهن الطبيعي لدراسة نقل الطاقة الإثارة على تغييرات تكوين أيون.
Abstract
أداء التمثيل الضوئي للنباتات والطحالب والدياتومات يعتمد بشدة على اللائحة بسرعة وكفاءة لحصاد الضوء والطاقة عمليات نقل في غشاء ثايلاكويد المعايشة. على ضوء حصاد هوائي الدياتومات، ما يسمى فوكوكسانثين الكلوروفيل المكيفات ملزم البروتينات (FCP)، المطلوبة لامتصاص الضوء ونقل تتسم بالكفاءة لرد فعل التمثيل الضوئي المراكز كذلك أما بالنسبة لصور–الحماية من الضوء المفرط. التبديل بين هاتين الوظيفتين مسألة طويلة الأمد للبحوث. العديد من هذه الدراسات قد أجريت مع FCP في المذيلات المنظفات. دراسات التفاعل، أزيلت المنظفات، مما أدى إلى تجميع غير محدد لمجمعات FCP. وفي هذا النهج، من الصعب أن تميز بين القطع الأثرية والبيانات ذات الصلة فسيولوجيا. ومن ثم، يمكن الحصول على أكثر قيمة من المعلومات حول FCP والضوء غشاء ملزمة أخرى حصاد المجمعات بدراسة تفاعلات البروتين البروتين، ونقل الطاقة والخصائص الطيفية الأخرى إذا كانت متأصلة في بيئتها الأصلية في الدهون. والميزة الرئيسية هي أن الدهنية لها حجم محدد ونسبة محددة بدهن/بروتين الذي يتم التحكم في مدى تجميع FCP. علاوة على ذلك، يمكن بسهولة محاكاة التغييرات في تكوين الحموضة وأيون التي تنظم الضوء الحصاد في فيفو . بالمقارنة مع الغشاء ثايلاكويد، الدهنية أكثر تجانساً وأقل تعقيداً، مما يجعل من الأسهل للحصول على وفهم البيانات الطيفية. البروتوكول يصف إجراءات عزل FCP وتنقية وإعداد الحويصلية وإدماج FCP في الدهنية مع تكوين الدهن الطبيعي. ينتج عن تطبيق نموذجي يجري النظر ومناقشتها.
Introduction
الكائنات التمثيل الضوئي مثل الدياتومات ويجب التعامل مع ظروف الإضاءة المتغيرة والاستجابة مع آليات التأقلم متطورة للحفاظ على كفاءة التمثيل الضوئي عالية وحماية من التلف صور الأكسدة بالضوء المفرط. هو عملية كبيرة واقية من الضوء في التمثيل الضوئي حقيقيات النوى الطاقة عالية التبريد (ه) يمتص الضوء الذي يحدث كمساهمة رئيسية غير الضوئية التبريد (نبق) تحت ظروف الإجهاد الخفيفة1،2 ،3. مجمعات الهوائي الحصاد الخفيفة (LHC) تشارك في تنظيم مسارات نقل الطاقة الإثارة. في استجابة للضوء العالي الناجم عن انخفاض درجة الحموضة في التجويف بلاستيدات الخضراء، مفاتيح نظام الهوائي من ضوء حصاد الدولة إلى الدولة التبريد. وتحمي هذه الدولة المسرف الطاقة فوتوسيستيمس (PS) والمجمعات الأخرى في غشاء ثايلاكويد من التأكسد. في حقيقيات النوى التمثيل الضوئي، فعله عادة اثنين العوامل1،،من23. عامل واحد هو الضوء المتخصصة حصاد البروتين الذي يستجيب لانخفاض درجة الحموضة. يستحث البروتين الهيئاته في أعلى النباتات4. لهكسرس5، عن طريق نشاط الهيئات الفرعية الرئيسية، والتضمين الحث سه في الطحالب الخضراء6. الدياتومات تمتلك لك مثل البروتينات التي هيكلياً المتصلة لهكسرس7،،من89،10.
والعامل الثاني من سه هو دورة كزانتوفيل حيث تحويلها إلى نموذج واقية من الصور بواسطة إبوكسدة دي الكاروتينات الهوائي وعادت قبل إبوكسدة. وفي النباتات والطحالب الخضراء، يتم تحويل فيولاكسانثين إلى تين وزياكسانثين. في الدياتومات، يتم تحويل ديادينوكسانثين إلى دياتوكسانثين، الذي ثم يرتبط بمدى نبق11. ضوء دياتوم حصاد هوائي تمتلك بعض الخصائص المميزة على الرغم من أنها التطورية المتعلقة بالنباتات والطحالب لهكس. التبديل من الضوء الحصاد لحماية الصور بسرعة هائلة وقدرة نبق أعلى بالمقارنة بالنباتات12. قد يكون هذا أحد الأسباب لماذا الدياتومات ناجحة جداً في مختلف المنافذ الإيكولوجية في طريقة التي هم مسؤولون عنها ليصل إلى 45 في المائة من المحيطات صافي الإنتاج الأولى13. ومن ثم، دياتوم الخفيفة نظم الحصاد كائن مثيرة لاهتمام لبحوث عملية التمثيل الضوئي.
الدياتومات، مثل الأنواع التي تركز على مينيغينيانا سيكلوتيلا، تمتلك ثايلاكويد الخفيفة الأصيلة سميت الأصباغ أنها نظم الحصاد ربط-فوكوكسانثين، الكلوروفيل (شيلي) وج، ومن ثم الضوء FCP. حصاد البروتينات، مثل فيرفااس، هي جزءا لا يتجزأ من نظام غشاء ثايلاكويد تتألف من عدة طبقات الغشاء. الدياتومات تشكيل عصابات من ثلاث ثيلاكويدس. هذا المجمع الوضع يجعل من الصعب على دراستها على المستوى الجزيئي في غشاء ثايلاكويد. وبالإضافة إلى ذلك، العديد من العناصر المساهمة في تنظيم الضوء الحصاد (انظر أعلاه). ولذلك، في العديد من النهج، كانت المجمعات المعزولة من الغشاء باستخدام المنظفات معتدل، مثل ن-دوديسيل-β-د-مالتوبيرانوسيدي (β-DDM)، الذي جعل الغشاء ولكن الاحتفاظ مجمعات FCP سليمة. أجريت العديد من الدراسات الطيفية باستخدام solubilized FCP للتحقيق في الطاقة إينتراموليكولار نقل14،15،،من1617. غير أن هذا النهج السابق كان محدودا نظراً لتنظيم نقل الطاقة يحتاج تفاعل اكسسيتونيك مع مجمعات الهوائي أو فوتوسيستيمس أخرى. ومن ثم فهذه الأنواع من الدراسات لا تنفذ مع مجمعات solubilized نظراً للتفاعل بين المجمعات يتم فقدان.
هو سمة هامة في التنظيم هوائي “الزحام الجزيئي” هوائي وفوتوسيستيمس بغشاء ثايلاكويد18. التي أجريت سابقا، نهج بسيط لمحاكاة هذا التأثير في المختبر. تمت إزالة مواد التنظيف، مما يؤدي إلى تجميع عشوائي لمجمعات الهوائي. على الرغم من أن تم الحصول على بعض البيانات معقولة بهذا النهج،من1719، إزالة المنظفات لا تعكس الحالة في فيفو ولديها بعض القيود نظراً للمجمعات لا تتفاعل في تلك المرحلة الجامعية العادية الهيكل.
استخدام الدهنية ويتغلب على العديد من القيود السابقة. بنية التعليم العالي لا تزال سليمة تماما. غشاء الحويصلية يوفر بيئة شبه أصلية لمجمعات الهوائي. الغشاء الذي يفصل داخل الحويصلية البيئة الخارجية. بهذه الوسائل، توفر الدهنية المقصورات رد فعل اثنين للدراسات من التدرجات أيون ودرجة الحموضة، وكذلك فيما يتعلق بعمليات النقل. علاوة على ذلك، يمكن التحكم معلمات النظام التجريبي أكثر سهولة لدراسات في غشاء ثايلاكويد. وعرضت الدهنية أصلاً لتكون أداة ممتازة لدراسة المجمعات التمثيل الضوئي. وكان محورا رئيسيا في الماضي على مصنع LHC حيث تم اختبار تأثير الدهن غيرت تركيبة على الثاني LHC20. في نهج أخرى، كانت البروتين-بروتين التفاعل بين مختلف LHC ثانيا التحقيق21. أيضا، بعض الدراسات في الطحالب الخضراء نفذت تصف تجميع عفوية بين LHC22. وبالنظر إلى أهمية الدياتومات للنظم الإيكولوجية المائية، أجريت دراسات قليلة نسبيا مع مجمعات الهوائي من الدياتومات. دراستان التحقيق مجمعات الهوائي لمركزية مينيغينيانا سيكلوتيلا، وعرضت فيها تجميع الهوائي FCP23 والاستجابة من FCP للتدرجات الكهروكيميائية24 . وهكذا، الدهنية أداة ممتازة لدراسة الهوائيات دياتوم والتفاعل والتنظيم في الشروط الأصلية تقريبا. الدهنية تنوعاً منذ العديد من الشروط مثل تكوين الدهن والحويصليه حجم وكثافة البروتين ويمكن التحكم في المرحلة المائية المحيطة بها. وعلاوة على ذلك، يتطلب الأسلوب كميات قليلة من العينات. النظام التجريبي أقوى واستنساخه بدرجة عالية. تجزئة الدهنية يسمح لدراسة درجة الحموضة وأيون التدرجات، التي تتسم بأهمية العوامل في تنظيم مجمعات الهوائي.
وهنا يصف لنا عزل مجمعات الهوائي FCP من مينيغينيانا جيم وإدماجها في الدهنية مع تكوين الدهن ثايلاكويد الطبيعية. أيضا، ونحن تقديم بيانات نموذجية لتوصيف solubilized FCP الطيفية ومقارنتها مع FCP في الدهنية. ويلخص الأسلوب المعرفة والبروتوكولات الموحدة التي تم الحصول عليها من التحسينات التي غوندرومان و 2012 بوشل23وناتالي et al. عام 201622، و أحمد و 2017 ديتزيل24.
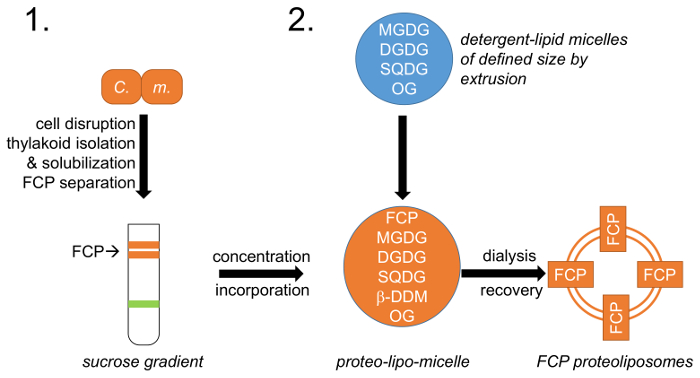
رقم 1: التمثيل التخطيطي لسير العمل. (1) يشير إلى الفقرة 1 التي تصف نمو الخلايا، واضطراب والعزلة ثايلاكويد مع عقب الانفصال FCP على السكروز كثافة التدرجات؛ جيم-م. –مينيغينيانا سيكلوتيلا الخلايا. (2) إعداد خليط دهن ثايلاكويد الطبيعية (مجدج ودجدج وسقدج) الوارد وصفها في الفقرة 2، وإنشاء المذيلات المنظفات الدهنية مع أوكتيلجليكوسيدي (الجريدة الرسمية). حجم مذيل دهن محددة يتحقق عن طريق البثق استخدام الأغشية لقطر المسام محددة. FCP والدهن-المذيلات هي موحدة في دهن مسبقاً: نسبة البروتين والمنظفات OG و β-DDM يتم إزالتها عن طريق التحكم في الغسيل الكلوي تشكيل بروتيوليبوسوميس FCP. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
الدهنية FCP مع تكوين الدهن الطبيعية توفر أداة يدوية وبسيطة واستنساخه للتحقيق في الخصائص الطيفية في المختبر. البيئة المادة الدهنية في FCP الدهنية تشبه الحالة داخل الغشاء ثايلاكويد، مما أدى إلى النتائج التجريبية التي أقرب إلى الظروف الطبيعية.
وهناك العديد من المزايا لاست?…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
ونشكر أحمد عديل رنا للمساعدة في تنقية FCP. الأستاذ كلوديا بوشل المسلم لإجراء مناقشات مفيدة وقراءة المخطوطة. هذا العمل كان تدعمها “مؤسسة البحوث الألمانية” إلى دينار (DI1956-1/1) ومؤسسة هومبولدت لزمالة فيودور لنن إلى ld.
Materials
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel – por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer – Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | |||
| For specific safety instructions please refer to material safety sheets and repective manuals. | |||
| Standard lab material and substances are not listed. |
Referenzen
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemie. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemie. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemie. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).

