Karakterisering van intrakraakbeen transport eigenschappen van Cationic Peptide Carriers
Summary
Dit protocol bepaalt evenwichtsopname, penetratiediepte en niet-evenwichtsdiffusiepercentage voor kationische peptidedragers in kraakbeen. Karakterisering van transporteigenschappen is van cruciaal belang voor een effectieve biologische respons. Deze methoden kunnen worden toegepast voor het ontwerpen van een optimaal geladen drug dragers voor het richten van negatief geladen weefsels.
Abstract
Verschillende negatief geladen weefsels in het lichaam, zoals kraakbeen, vormen een barrière voor de gerichte levering van geneesmiddelen vanwege hun hoge dichtheid van negatief geladen aggrecans en vereisen daarom verbeterde targetingmethoden om hun therapeutische respons te verhogen. Omdat kraakbeen een hoge negatieve vaste ladingsdichtheid heeft, kunnen geneesmiddelen worden gewijzigd met positief geladen geneesmiddelendragers om te profiteren van elektrostatische interacties, waardoor een verbeterd intrakraakbeentransport mogelijk is. Het bestuderen van het vervoer van drugsdragers is daarom van cruciaal belang om de werkzaamheid van geneesmiddelen te voorspellen die een biologische respons opwekken. We tonen het ontwerp van drie experimenten die de evenwichtsopname, de diepte van penetratie en niet-evenwichtsdiffusiesnelheid van kationische peptidedragers in kraakbeenexplants kunnen kwantificeren. Evenwichtsopname-experimenten bieden een maat voor de oplosconcentratie in het kraakbeen in vergelijking met het omringende bad, wat handig is voor het voorspellen van het potentieel van een geneesmiddelendrager bij het verbeteren van de therapeutische concentratie van geneesmiddelen in kraakbeen. Diepte van penetratiestudies met behulp van confocale microscopie zorgen voor de visuele weergave van 1D-oplosmiddeldiffusie van de oppervlakkige tot diepe zone van kraakbeen, wat belangrijk is om te beoordelen of solutes hun matrix- en cellulaire doelsites bereiken. Niet-evenwichtsdiffusiegraadstudies met behulp van een op maat ontworpen transportkamer maakt het mogelijk de sterkte van bindingsinteracties met de weefselmatrix te meten door de diffusiesnelheden van fluorescerende gelabelde solutes over het weefsel te karakteriseren; dit is gunstig voor het ontwerpen van dragers van optimale bindingssterkte met kraakbeen. Samen vormen de resultaten van de drie vervoersexperimenten een richtlijn voor het ontwerpen van optimaal geladen geneesmiddelendragers die profiteren van zwakke en omkeerbare ladingsinteracties voor toepassingen voor de levering van geneesmiddelen. Deze experimentele methoden kunnen ook worden toegepast om het vervoer van drugs en drug-drug carrier conjugaats te evalueren. Verder kunnen deze methoden worden aangepast voor het gebruik bij het richten van andere negatief geladen weefsels zoals meniscus, hoornvlies en de glasachtige humor.
Introduction
Drug-levering aan negatief geladen weefsels in het lichaam blijft een uitdaging als gevolg van het onvermogen van geneesmiddelen om diep door te dringen in het weefsel om cel en matrix doelsites1te bereiken. Een aantal van deze weefsels bestaat uit dicht verpakte, negatief geladen aggrecans die een hoge negatieve vaste ladingsdichtheid (FCD)2 in het weefsel creëren en fungeren als een barrière voor de levering van de meeste macromoleculen3,4. Echter, met de hulp van positief geladen drugsdragers, kan deze negatief geladen weefselbarrière daadwerkelijk worden omgezet in een medicijndepot via elektrostatische ladingsinteracties voor aanhoudende levering van geneesmiddelen1,5,6,7( figuur1).
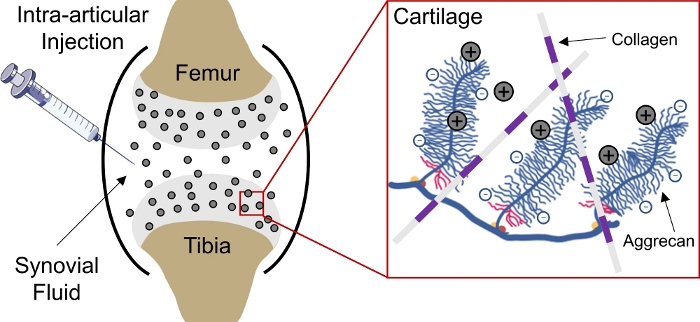
Figuur 1: Op kosten gebaseerde intrakraakbeenlevering van CPC’s. Intra-articulaire injectie van CPC’s in de kniegewrichtruimte. Elektrostatische interacties tussen positief geladen CPC’s en negatief geladen aggrecangroepen maken een snelle en volledige dieptepenetratie door kraakbeen mogelijk. Dit cijfer is gewijzigd van Vedadghavami et al4. Klik hier om een grotere versie van dit cijfer te bekijken.
Onlangs, korte lengte cationic peptide dragers (CPC’s) werden ontworpen met het doel van het creëren van kleine kationische domeinen in staat het dragen van grotere grootte therapeutica voor de levering aan de negatief geladen kraakbeen4. Voor effectieve levering van geneesmiddelen aan het kraakbeen voor de behandeling van heersende8,,9 en degeneratieve ziekten zoals artrose (OA)10, is het van cruciaal belang dat therapeutische concentraties van geneesmiddelen diep in het weefsel doordringen, waar een meerderheid van de kraakbeencellen (chondrocyten)11liggen. Hoewel er verschillende potentiële ziekte wijzigen van geneesmiddelen beschikbaar zijn, geen hebben opgedaan FDA goedkeuring, omdat deze niet in staat zijn om effectief te richten op hetkraakbeen 12,13. Daarom is evaluatie van de transporteigenschappen van drugsdragers noodzakelijk om de effectiviteit van geneesmiddelen te voorspellen die een therapeutische respons opwekken. Hier hebben we drie afzonderlijke experimenten ontworpen die kunnen worden gebruikt voor het beoordelen van de evenwichtsopname, de diepte van penetratie en de verspreidingsgraad van CPC’s4zonder evenwicht.
Om ervoor te zorgen dat er een voldoende medicijnconcentratie in het kraakbeen is die een optimale therapeutische respons kan bieden, werden opname-experimenten ontworpen om de CPC-concentratie in kraakbeen4te kwantificeren. In dit ontwerp, na een evenwicht tussen het kraakbeen en het omringende bad, kan de totale hoeveelheid oplosmiddel in het kraakbeen (gebonden aan de matrix of vrij) worden bepaald met behulp van een opnameverhouding. Deze verhouding wordt berekend door de concentratie van oplosmiddel in het kraakbeen te normaliseren tot die van het evenwichtsbad. In principe zou neutrale oplosmiddel, waarvan de verspreiding door het kraakbeen niet wordt bijgestaan door ladingsinteracties, een opnameverhouding van minder dan 1 hebben. Omgekeerd vertonen kationische oplosmiddelen, waarvan het transport wordt verbeterd via elektrostatische interacties, een opnameverhouding van meer dan 1. Zoals blijkt uit CPC’s kan het gebruik van een optimale positieve lading echter leiden tot een veel hogere opnameratio (groter dan 300)4.
Hoewel een hoge medicijnconcentratie in het kraakbeen belangrijk is voor het bereiken van therapeutisch voordeel, is het ook van cruciaal belang dat geneesmiddelen zich verspreiden door de volledige dikte van het kraakbeen. Daarom zijn studies die de diepte van penetratie laten zien nodig om ervoor te zorgen dat geneesmiddelen diep in het kraakbeen reiken, zodat de matrix- en cellulaire doellocaties kunnen worden bereikt, waardoor een effectievere therapie wordt geboden. Dit experiment was ontworpen om de eenrichtingspreiding van oplosmiddelen door kraakbeen te beoordelen, waarbij de verspreiding van geneesmiddelen in kraakbeen na intra-articulaire injectie in vivo werd gesimuleerd. Fluorescentie beeldvorming met behulp van confocale microscopie zorgt voor de evaluatie van de diepte van penetratie in kraakbeen. Netto deeltjeslading speelt een belangrijke rol bij het matigen van hoe diepe geneesmiddelen zich door de matrix kunnen verspreiden. Een optimale nettolading op basis van een weefsel FCD is vereist om zwakke-omkeerbare binding interacties tussen kationische deeltjes en de anionische weefselmatrix mogelijk te maken. Dit houdt in dat elke interactie zwak genoeg is, zodat deeltjes zich kunnen loskoppelen van de matrix, maar omkeerbaar van aard, zodat het kan binden aan een andere matrix binding site dieper in het weefsel4. Omgekeerd kan een overmatige positieve nettolading van een deeltje schadelijk zijn voor diffusie, omdat een te sterke matrixbinding het losmaken van deeltjes van de oorspronkelijke bindingsplaats in de oppervlakkige zone van kraakbeen verhindert. Dit zou resulteren in een onvoldoende biologische respons, aangezien een meerderheid van de doellocaties diep in het weefsel ligt11.
Om de sterkte van de bindende interacties verder te kwantificeren, is analyse van de verspreidingssnelheden van geneesmiddelen via kraakbeen voordelig. Niet-evenwichtsdiffusiestudies maken het mogelijk om real-time diffusiepercentages tussen verschillende oplospercentages te vergelijken. Als geneesmiddelen verspreiden door de oppervlakkige, middelste en diepe zones van kraakbeen, de aanwezigheid van bindende interacties kan sterk veranderen diffusie tarieven. Wanneer bindende interacties aanwezig zijn tussen geneesmiddelen en de kraakbeenmatrix, wordt deze gedefinieerd als de effectieve diffusiviteit (DEFF). In dit geval, zodra alle bindende plaatsen zijn bezet, wordt het verspreidingspercentage van drugs beheerst door de steady-state diffusie (DSS). Vergelijking tussen de DEFF van verschillende oplosmiddel bepaalt de relatieve bindende sterkte van de oplosmiddel met de matrix. Voor een bepaalde oplosmiddel, als de DEFF en DSS binnen dezelfde orde van grootte zijn, impliceert dit dat er minimale binding aanwezig is tussen het medicijn en de matrix tijdens diffusie. Als DEFF echter groter is dan DSS,bestaat er een aanzienlijke binding van deeltjes aan matrix.
De ontworpen experimenten individueel zorgen voor de karakterisering van het vervoer oplosbaar door het kraakbeen, echter, een holistische analyse inclusief alle resultaten is vereist voor het ontwerpen van een optimaal geladen drug drager. De zwakke en omkeerbare aard van lading interacties regelt deeltjes diffusie en zorgt voor een hoge evenwichtsopname en snelle volledige diepte penetratie door kraakbeen. Door middel van experimenten met evenwichtsopnames moeten we zoeken naar dragers die een hoge opname vertonen als gevolg van ladingsinteracties die kunnen worden geverifieerd met behulp van niet-evenwichtsdiffusieratiostudies. Deze bindende interacties moeten echter zwak en omkeerbaar van aard zijn om volledige diktepenetratie van het oplosmiddel door kraakbeen mogelijk te maken. Een ideale drug drager zou beschikken over een optimale lading die het mogelijk maakt sterk genoeg binding voor opname en hoge intra-kraakbeen drug concentraties, maar niet te sterk om volledige dikte diffusie4belemmeren. De gepresenteerde experimenten zullen helpen bij de ontwerpkenmerken voor op lading gebaseerd weefsel gericht op geneesmiddelendragers. Deze protocollen werden gebruikt voor het karakteriseren van CPC-transport viakraakbeen 4,maar deze kunnen ook worden toegepast op een verscheidenheid van geneesmiddelen en drugsdragers via kraakbeen en andere negatief geladen weefsels.
Protocol
Representative Results
Discussion
De methoden en protocollen die hier worden beschreven zijn belangrijk voor het gebied van gerichte levering van geneesmiddelen aan negatief geladen weefsels. Vanwege de hoge dichtheid van negatief geladen aggrecans aanwezig in deze weefsels, wordt een barrière gecreëerd, waardoor drugs hun cellulaire doelsites die diep in de matrix liggen, niet bereiken. Om deze nog opmerkelijke uitdaging het land aan te pakken, kunnen geneesmiddelen worden aangepast om positief geladen drugsdragers op te nemen die het vervoerspercenta…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gefinancierd door het Amerikaanse ministerie van Defensie door middel van de Congressionally Directed Medical Research Programs (CDMRP) onder contract W81XWH-17-1-0085, en het National Institute of Health R03 EB025903-1. AV werd gefinancierd door het College of Engineering Dean’s Fellowship aan de Northeastern University.
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Referenzen
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

