Caractérisation des propriétés de transport intra-cartilage des porteurs de peptides cationiques
Summary
Ce protocole détermine l’absorption d’équilibre, la profondeur de pénétration et le taux de diffusion non-équilibre pour les porteurs de peptide cationique dans le cartilage. La caractérisation des propriétés du transport est essentielle pour assurer une réponse biologique efficace. Ces méthodes peuvent être appliquées pour la conception d’un transporteur de drogue chargé de façon optimale pour cibler les tissus chargés négativement.
Abstract
Plusieurs tissus chargés négativement dans le corps, comme le cartilage, présentent une barrière à l’administration ciblée de médicaments en raison de leur forte densité d’agvrecans chargés négativement et, par conséquent, nécessitent des méthodes de ciblage améliorées pour augmenter leur réponse thérapeutique. Parce que le cartilage a une forte densité négative de charge fixe, les médicaments peuvent être modifiés avec des transporteurs de médicaments chargés positivement pour tirer parti des interactions électrostatiques, permettant un transport amélioré de médicaments intra-cartilage. L’étude du transport des transporteurs de médicaments est donc cruciale pour prédire l’efficacité des médicaments dans l’induction d’une réponse biologique. Nous montrons la conception de trois expériences qui peuvent quantifier l’absorption d’équilibre, la profondeur de pénétration et le taux de diffusion non-équilibre des porteurs de peptide cationique dans les explants de cartilage. Les expériences d’absorption d’équilibre fournissent une mesure de la concentration de soluté dans le cartilage par rapport à son bain environnant, qui est utile pour prédire le potentiel d’un porteur de drogue dans l’amélioration de la concentration thérapeutique des médicaments dans le cartilage. La profondeur des études de pénétration utilisant la microscopie confocale permet la représentation visuelle de la diffusion de soluté 1D de la zone superficielle à profonde du cartilage, ce qui est important pour évaluer si les solutés atteignent leurs sites cibles matriciels et cellulaires. Les études sur le taux de diffusion hors équilibre à l’aide d’une chambre de transport conçue sur mesure permettent de mesurer la force des interactions de liaison avec la matrice tissulaire en caractérisant les taux de diffusion des solutés fluorescents étiquetés dans le tissu; ceci est bénéfique pour la conception de porteurs de la force de liaison optimale avec le cartilage. Ensemble, les résultats obtenus à partir des trois expériences de transport fournissent une ligne directrice pour la conception de transporteurs de médicaments chargés de façon optimale qui tirent parti des interactions faibles et réversibles de charge pour les applications de livraison de médicaments. Ces méthodes expérimentales peuvent également être appliquées pour évaluer le transport de médicaments et de conjugués de trafiquants de drogues. En outre, ces méthodes peuvent être adaptées pour l’utilisation dans le ciblage d’autres tissus chargés négativement tels que le ménisque, la cornée et l’humour vitreux.
Introduction
L’administration de médicaments aux tissus chargés négativement dans le corps reste un défi en raison de l’incapacité des médicaments à pénétrer profondément dans le tissu pour atteindre les sites cibles cellulaires et matricielles1. Plusieurs de ces tissus comprennent des agglements de charges denses et chargés négativement qui créent une densité de charge fixe négative élevée (FCD)2 dans le tissu et agissent comme une barrière pour la livraison de la plupart des macromolécules3,4. Toutefois, avec l’aide de transporteurs de médicaments chargés positivement, cette barrière tissulaire chargée négativement peut en fait être convertie en dépôt de drogue par l’intermédiaire d’interactions de charge électrostatique pour la livraison soutenue de médicaments1,5,6,7(Figure 1).
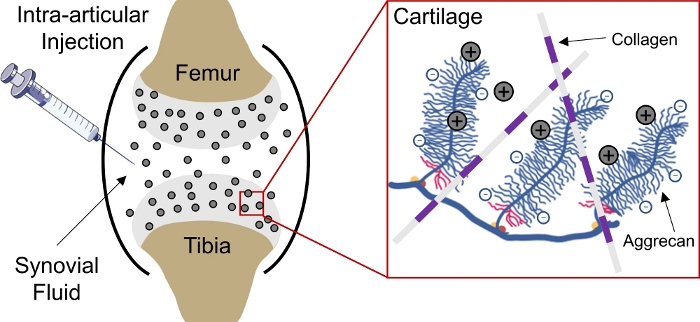
Figure 1 : Livraison intra-cartilage basée sur les frais des CPC. Injection intra-articulaire de CPC dans l’espace des articulations du genou. Les interactions électrostatiques entre les CPC chargés positivement et les groupes aggrecans chargés négativement permettent une pénétration rapide et complète de la profondeur par le cartilage. Ce chiffre a été modifié à partir de Vedadghavami et al4. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Récemment, les porteurs de peptides cationiques de courte longueur (CPC) ont été conçus dans le but de créer de petits domaines cationiques capables de transporter des thérapies de plus grande taille pour la livraison au cartilage chargé négativement4. Pour l’administration efficace de médicaments au cartilage pour le traitement des maladies répandues8,,9 et dégénératives telles que l’arthrose (OA)10, il est essentiel que les concentrations thérapeutiques de médicaments pénètrent profondément dans le tissu, où la majorité des cellules du cartilage (chondrocytes) se trouvent11. Bien qu’il existe plusieurs médicaments potentiels de modification de la maladie disponibles, aucun n’a obtenu l’approbation de la FDA parce que ceux-ci sont incapables de cibler efficacement le cartilage12,13. Par conséquent, l’évaluation des propriétés de transport des transporteurs de médicaments est nécessaire pour prédire l’efficacité des médicaments dans l’induction d’une réponse thérapeutique. Ici, nous avons conçu trois expériences distinctes qui peuvent être utilisées pour évaluer l’absorption de l’équilibre, la profondeur de pénétration et le taux de diffusion hors équilibre des CPC4.
Pour s’assurer qu’il y a une concentration suffisante de drogue dans le cartilage qui peut fournir une réponse thérapeutique optimale, des expériences d’absorption ont été conçues pour quantifier la concentration de CPC d’équilibre dans le cartilage4. Dans cette conception, suivant un équilibre entre le cartilage et son bain environnant, la quantité totale de soluté à l’intérieur du cartilage (soit lié à la matrice ou libre) peut être déterminée à l’aide d’un rapport d’absorption. Ce rapport est calculé en normalisant la concentration de solutés à l’intérieur du cartilage par rapport à celle du bain d’équilibre. En principe, les solutés neutres, dont la diffusion par le cartilage n’est pas assistée par des interactions de charge, auraient un rapport d’absorption inférieur à 1. Inversement, les solutés cationiques, dont le transport est amélioré par des interactions électrostatiques, montrent un taux d’absorption supérieur à 1. Toutefois, comme le montrent les CPC, l’utilisation d’une charge positive optimale peut entraîner des ratios d’absorption beaucoup plus élevés (supérieurs à 300)4.
Bien que la concentration élevée de drogue dans le cartilage soit importante pour réaliser l’avantage thérapeutique, il est également critique que les drogues diffusent par toute l’épaisseur du cartilage. Par conséquent, des études montrant la profondeur de pénétration sont nécessaires pour s’assurer que les médicaments atteignent profondément dans le cartilage de sorte que la matrice et les sites cibles cellulaires peuvent être atteints, fournissant ainsi une thérapie plus efficace. Cette expérience a été conçue pour évaluer la diffusion à sens unique des solutés par le cartilage, simulant la diffusion des drogues dans le cartilage suivant l’injection intra-articulaire in vivo. L’imagerie par fluorescence à l’aide de la microscopie confocale permet d’évaluer la profondeur de pénétration dans le cartilage. La charge nette des particules joue un rôle clé dans la modération de la façon dont les médicaments profonds peuvent se diffuser à travers la matrice. Une charge nette optimale basée sur un tissu FCD est nécessaire pour permettre des interactions de liaison faible-réversible entre les particules cationiques et la matrice anionique de tissu. Cela implique que toute interaction est assez faible pour que les particules puissent se dissocier de la matrice mais réversibles dans la nature afin qu’elle puisse se lier à un autre site de liaison matricielle plus profondément dans le tissu4. Inversement, la charge nette positive excessive d’une particule peut être préjudiciable à la diffusion, car une liaison matricielle trop forte empêche le détachement des particules du site de liaison initial dans la zone superficielle du cartilage. Cela se traduirait par une réponse biologique insuffisante car la majorité des sites cibles se trouvent profondément dans le tissu11.
Pour quantifier davantage la force des interactions de liaison, l’analyse des taux de diffusion de drogue par le cartilage est avantageuse. Les études de diffusion hors équilibre permettent de comparer les taux de diffusion en temps réel entre les différents solutés. Comme les médicaments diffusent à travers les zones superficielles, moyennes et profondes du cartilage, la présence d’interactions contraignantes peut modifier considérablement les taux de diffusion. Lorsque des interactions de liaison sont présentes entre les médicaments et la matrice du cartilage, il est défini comme la diffusion efficace (DEFF). Dans ce cas, une fois que tous les sites contraignants ont été occupés, le taux de diffusion des médicaments est régi par la diffusion à l’état stable (DSS). La comparaison entre le DEFF de différents solutés détermine la force relative de liaison des solutés avec la matrice. Pour un soluté donné, si le DEFF et le DSS sont dans le même ordre de grandeur, cela implique qu’il y a une liaison minimale entre le médicament et la matrice pendant la diffusion. Toutefois, si le DEFF est supérieur à DSS,il existe une liaison substantielle des particules à la matrice.
Les expériences conçues individuellement permettent la caractérisation du transport soluté à travers le cartilage, cependant, une analyse holistique comprenant tous les résultats est nécessaire pour concevoir un transporteur de drogue chargé de façon optimale. La nature faible et réversible des interactions de charge contrôle le taux de diffusion des particules et permet une absorption d’équilibre élevé et une pénétration rapide de la pleine profondeur par le cartilage. Grâce à des expériences d’absorption d’équilibre, nous devrions rechercher des porteurs qui montrent une forte absorption à la suite d’interactions de charge qui peuvent être vérifiées à l’aide d’études de taux de diffusion hors équilibre. Cependant, ces interactions de liaison devraient être faibles et réversibles dans la nature pour permettre la pénétration de pleine épaisseur du soluté par le cartilage. Un transporteur de médicaments idéal posséderait une charge optimale qui permet une liaison assez forte pour l’absorption et des concentrations élevées de médicaments intra-cartilage, mais pas trop forte pour entraver la diffusion de pleine épaisseur4. Les expériences présentées aideront à concevoir des tissus ciblant les tissus à charge. Ces protocoles ont été utilisés pour caractériser le transport CPC par le cartilage4, cependant, ceux-ci peuvent également être appliqués à une variété de médicaments et de transporteurs de médicaments par le cartilage et d’autres tissus chargés négativement.
Protocol
Representative Results
Discussion
Les méthodes et les protocoles décrits ici sont importants dans le domaine de l’administration ciblée de médicaments pour les tissus chargés négativement. En raison de la forte densité d’agvrecans chargés négativement présents dans ces tissus, une barrière est créée, empêchant ainsi les médicaments d’atteindre leurs sites cibles cellulaires qui se trouvent profondément dans la matrice. Pour relever ce défi en suspens, les médicaments peuvent être modifiés pour incorporer des transporteurs de mé…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Ce travail a été financé par le département de la Défense des États-Unis par le biais des programmes de recherche médicale dirigés par le Congrès (CDMRP) dans le cadre du contrat W81XWH-17-1-0085, et le National Institute of Health R03 EB025903-1. AV a été financé par le College of Engineering Dean’s Fellowship de l’Université Northeastern.
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
Referenzen
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

