Quantifizierung der Antikörper-abhängigen zellulären Zytotoxizität in einem Tumor-Sphäroid-Modell: Anwendung für die Wirkstoffforschung
Summary
In dieser Arbeit stellen wir eine Methode zur Identifizierung von Verbindungen vor, die den ADCC-Mechanismus, einen wichtigen Krebszell-Abtötungsmechanismus von Antitumor-Antikörpern, modulieren. Die zytotoxische Wirkung von NK-Zellen wird in Brustkrebszell-Sphäroiden in Gegenwart von Trastuzumab gemessen. Die Bildanalyse identifiziert lebende und tote Killer- und Zielzellen in Sphäroide.
Abstract
Die auf monoklonalen Antikörpern basierende Immuntherapie, die auf Tumorantigene abzielt, ist heute eine tragende Säule der Krebsbehandlung. Einer der klinisch relevanten Wirkmechanismen der Antikörper ist die antikörperabhängige zelluläre Zytotoxizität (ADCC), bei der der Antikörper an die Krebszellen bindet und die zelluläre Komponente des Immunsystems, z. B. natürliche Killerzellen (NK-Zellen), angreift, um die Tumorzellen abzutöten. Die Wirksamkeit dieser Therapien könnte verbessert werden, indem adjuvante Verbindungen identifiziert werden, die die Empfindlichkeit der Krebszellen oder die Potenz der Immunzellen erhöhen. Darüber hinaus können unentdeckte Wechselwirkungen mit anderen Medikamenten bei Krebspatienten, die wegen früherer Erkrankungen oder krebsassoziierter Symptome behandelt wurden, den Erfolg der Antikörpertherapie bestimmen. Daher müssen solche unerwünschten Wechselwirkungen mit anderen Medikamenten eliminiert werden. Mit diesen Zielen im Hinterkopf haben wir ein Krebs-ADCC-Modell erstellt und beschreiben hier ein einfaches Protokoll, um ADCC-modulierende Medikamente zu finden. Da 3D-Modelle wie Krebszell-Sphäroide 2D-Kulturen bei der Vorhersage von In-vivo-Reaktionen von Tumoren auf Krebstherapien überlegen sind, werden Sphäroid-Kokulturen von EGFP-exprimierenden HER2+ JIMT-1-Brustkrebszellen und dem NK92 verwendet. CD16-Zelllinien wurden aufgebaut und mit Trastuzumab, einem monoklonalen Antikörper, der klinisch gegen HER2-positiven Brustkrebs zugelassen ist, induziert. JIMT-1-Sphäroide konnten sich in zellabweisenden U-Boden-96-Well-Platten bilden. An Tag 3 wurden NK-Zellen und Trastuzumab hinzugefügt. Die Sphäroide wurden dann mit Annexin V-Alexa 647 gefärbt, um den apoptotischen Zelltod zu messen, der in der peripheren Zone der Sphäroide mit einem automatisierten Mikroskop quantifiziert wurde. Die Anwendbarkeit unseres Assays zur Identifizierung von ADCC-modulierenden Molekülen wird demonstriert, indem gezeigt wird, dass Sunitinib, ein von der FDA zugelassener Rezeptor-Tyrosinkinase-Inhibitor gegen metastasierenden Krebs, ADCC fast vollständig eliminiert. Die Generierung der Sphäroide und die Bildaufnahme- und Analysepipelines sind mit dem Hochdurchsatz-Screening auf ADCC-modulierende Verbindungen in Krebszell-Sphäroiden kompatibel.
Introduction
Multizelluläre Tumorsphäroide (MCTS) sind weit verbreitete dreidimensionale (3D) Modelle, die sich aufgrund der Neigung adhärenter Zellen zur Aggregation bilden und ein wichtiges Werkzeug darstellen, um mechanistische Einblicke in die Biologie von Krebszellen zu gewinnen. Sie können aus einer Vielzahl von Zelltypen durch zahlreiche Techniken erzeugt werden, wie z. B. flüssigkeits- und gerüstbasierte 3D-Kulturen1. Ihr Hauptvorteil gegenüber monolayern 2D-Modellen besteht darin, dass sie die Hauptmerkmale von In-vivo-Tumoren , nämlich strukturelle Organisation und Hypoxie, rekapitulieren, indem sie das biologische Verhalten von Tumorzellen nachahmen, insbesondere die Mechanismen, die zu therapeutischer Flucht und Arzneimittelresistenz führen2. Da MCTS die Vorhersagbarkeit von Toxizität und Arzneimittelempfindlichkeit verbessern können, werden sie häufig zur Untersuchung von Krebserkrankungen in 3D eingesetzt und könnten die Entwicklung wirksamer Medikamente für verschiedene Krebsarten verbessern3.
Um eine Krankheit zu untersuchen, besteht ein entscheidender Bedarf an relevanten und praktischen Modellen. Der Aufbau von Modellen für krebsimmunologische Studien ist eine Herausforderung, da das Immunsystem aus mehreren Zelltypen besteht. Jeder Zelltyp hat mehrere Subtypen und ein breites Spektrum an Aktivierungszuständen. Diese verschiedenen Immunzelltypen interagieren mit Krebszellen und anderen Tumorbestandteilen und beeinflussen letztlich den Ausgang der Krankheit. 2D-In-vitro-Zellkulturmethoden sind nicht in der Lage, diese komplexen zellulären Interaktionen zu rekapitulieren, da sie nicht übersetzbar sind und nicht in der Lage sind, die Wirkung eines Arzneimittels auf Systemebene (z. B. in Geweben) vorherzusagen4,5. Darüber hinaus haben Mausmodelle aufgrund der grundlegenden Unterschiede zwischen dem menschlichen und dem murinen Immunsystem auch starke Einschränkungen. 3D-Kultursysteme können daher die derzeitigen Lücken in den verfügbaren Modellen schließen, eine alternative Methode darstellen und unser Verständnis der Krebsimmunologie verbessern6. Insbesondere könnten Sphäroidmodelle zum Testen von Immuntherapien verwendet werden, hauptsächlich um die Wirksamkeit von Wirkstoff-Screenings und therapeutischen Antikörpern zur Verbesserung der Immunzellinfiltration und der antitumoralen Wirkung gegen die Sphäroidziele zu bewerten7. Darüber hinaus wurde das Potenzial von MCTS, das aus Zellen in verschiedenen metabolischen und proliferativen Zuständen besteht, zur Untersuchung der Wechselwirkungen zwischen Stromazellen (z. B. Lymphozyten, Makrophagen, Fibroblasten) und Krebszellen sowie zur Entwicklung neuer Antikrebsstrategien hinreichend nachgewiesen8. Daher ist es von entscheidender Bedeutung, prädiktive und genaue Plattformen zu untermauern, um den Prozess der Arzneimitteltests unter Berücksichtigung der Pathophysiologie der Tumormikroumgebung zu beschleunigen.
Brustkrebs (BC) ist weltweit die häufigste Krebserkrankung, die bei Frauen diagnostiziert wird. Die klinische Klassifikation dieser heterogenen Erkrankung basiert auf dem Vorhandensein von Transmembranrezeptoren, z. B. Östrogen- (ER) und Progesteronrezeptoren (PR) (zusammenfassend als Hormonrezeptoren bezeichnet, HR) sowie auf der Überexpression oder Amplifikation des humanen Proteins/Onkogens des epidermalen Wachstumsfaktorrezeptors 2 (HER2). Basierend auf der immunhistochemischen Expression dieser Rezeptoren werden vier Subtypen allgemein unterschieden: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-positiv (HR-/HER2+) und triple-negativer Brustkrebs (HR-/HER2-). Die HER2+-Gruppe macht 10-15% der BC-Fälle aus und zeichnet sich durch eine hohe HER2-Expression ohne ER und PR aus, hat eine schlechtere Prognose im Vergleich zu luminalen Tumoren und erfordert spezifische Medikamente, die gegen das HER2/neu-Proteingerichtet sind 9.
Die Entwicklung des Basalzellkarzinoms ist ein mehrstufiger Prozess, und eine frühzeitige Diagnose ist für eine erfolgreiche Behandlung der Krankheit unerlässlich10. Trotz der kürzlich entstandenen personalisierten BC-Behandlungsoptionen (z. B. endokrine und Anti-HER2-Antikörpertherapien) stellt BC die Onkologen weiterhin vor Herausforderungen. Genau wie Operationen, Chemotherapien und Strahlentherapien können auch diese personalisierten Therapien schwerwiegende Nebenwirkungen haben, und die Patienten können Resistenzen gegen diese Wirkstoffe entwickeln, was es zu einer langfristigen Herausforderung macht, die beste Strategie zu bestimmen11,12. Daher ist ein besseres Verständnis des Zusammenspiels zwischen dem Tumor und seiner Mikroumgebung von entscheidender Bedeutung und wird voraussichtlich neue Richtungen für die Entwicklung neuartiger Behandlungen liefern, die die Besonderheiten der verschiedenen BC-Subtypen berücksichtigen13. Eine neue Welle von Immuntherapien wie Antikörper-Wirkstoff-Konjugate, adoptive T-Zell-Therapien, Impfstoffe und neuartige HER2-gerichtete monoklonale Antikörper (mAbs) wird in einer breiten Population von Patienten mit HER2-exprimierenden Tumoren untersucht14.
Trastuzumab beispielsweise stellt eine effiziente Behandlungsmethode für HER2+ BC dar. Als Teil seiner Wirkungsweise vermittelt Trastuzumab fragmentkristallisierbare Gammarezeptor (FcγR)-abhängige Aktivitäten. FcγRs zeichnen sich durch ihre Affinität zum Fc-Fragment und die Immunantwort aus, die sie auslösen. Die Aktivierung von FcγRIIIa (CD16A) auf natürlichen Killerzellen (NK-Zellen) ist entscheidend für die Vermittlung der Antikörper-abhängigen zellulären Zytotoxizität (ADCC), während die Aktivierung von FcγRIIa (CD32A) und FcγRIIIa auf Makrophagen die antikörperabhängige zelluläre Phagozytose (ADCP) induziert15. Studien an Tiermodellen zeigten, dass Mäuse, denen die Rezeptoren FcγRI (CD64) und FcγRIII (CD16) fehlten, nicht in der Lage waren, schützende Immunantworten gegen tumorspezifische Antigene zu initiieren, was darauf hindeutet, dass ADCC wahrscheinlich ein wichtiger Wirkmechanismus für das mAb Trastuzumab16 ist.
Da NK-Zellen auf tumorzellgebundene Abs zurückgreifen, um Krebszellen durch ADCC abzutöten, ist die Expression von Fc-Rezeptoren entscheidend für eine effiziente Behandlung mit Trastuzumab17 (Abbildung 1). Darüber hinaus wird ihre Wirkung durch eine Stimulation aktivierender und hemmender Rezeptoren, z. B. Killerzell-Immunglobulin-ähnlicher (KIR)-Rezeptoren, effizient ausgeglichen18.
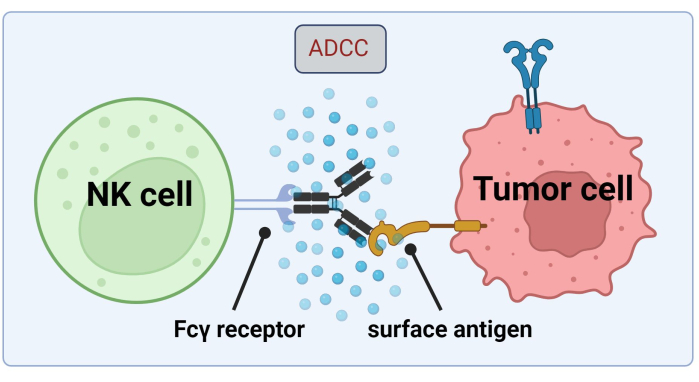
Abbildung 1. Mechanismus des ADCC im Kontext eines Antitumor-Ansprechens. Der Fcγ-Rezeptor einer natürlichen Killerzelle (NK-Zelle) erkennt die Fc-Region eines Antikörpers, der zuvor an ein Oberflächenantigen auf einer Krebszelle gebunden hatte. Diese immunologische Synapse führt zur Degranulation der NK-Zelle, die zytotoxische Mediatoren wie Granzyme und Perforin freisetzt. Diese Moleküle tragen zur Porenbildung in der Zellmembran bei und aktivieren apoptotische Signalwege, die zum programmierten Zelltod der Zielzelle führen (Bild erstellt mit Biorender.com). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Entwicklung von Immuntherapien für HER2+ BC stellt ein sich entwickelndes Feld dar. In diesem Fall sollte man Wechselwirkungen zwischen verschiedenen Komponenten des Immunsystems berücksichtigen. Darüber hinaus wurden in früheren Veröffentlichungen Kombinationstherapien mit allen Arten von traditionellen, Immun- oder Zelltherapien ausgiebig getestet, um synergistische Kombinationen zu identifizieren19.
Mehrere 3D-Modelle von HER2+ BC wurden bereits für die Wirkstoffforschung verwendet. Zum Beispiel verwendeten Balalaeva et al. SKBR-3-Sphäroide, die HER2 überexprimieren, um die Zytotoxizität des HER2-gerichteten Immuntoxins 4D5scFv-PE4020 zu bewerten. In einer weiteren Studie wurde ein 3D-Matrigel-basiertes HER2+ BC-Kultursystem etabliert, um das Zellwachstum als Reaktion auf Trastuzumab und endokrine Wirkstoffe zu messen21. Diese Studien unterstreichen die Bedeutung von Tumor-Sphäroidmodellen von HER2-überexprimierenden Krebszellen als wirksame Strategie zur klinischen Verbesserung des therapeutischen Ansprechens22.
Unsere Gruppe hat Sunitinib, einen multitargetierten Tyrosinkinase-Inhibitor, bereits in einem 2D-Kulturassay als Inhibitor des Trastuzumab-abhängigen ADCC in JIMT-1 HER2+ BC-Zellen identifiziert. Die Studie zeigte, dass Sunitinib Autophagie induziert und die Abtötungsfunktion von NK-Zellen beeinträchtigt, die HER2-Expression herunterreguliert und die Oberflächenanheftung von JIMT-1-Zellen verbessert17.
Hier haben wir ein neuartiges 3D-Sphäroid-ADCC-Modell (NK.92.CD16+Trastuzumab+JIMT-1-EGFP-Krebszellen) für Hochdurchsatz-Screening-Anwendungen etabliert und um die oben genannten Ergebnisse zu validieren, wurde Sunitinib als Modellsubstanz verwendet. Zuerst erzeugten wir EGFP, die JIMT-1 Zellenexprimieren 17 und züchteten Sphäroide aus diesen Zellen. ADCC wurde durch NK-Zellen zusammen mit Trastuzumab induziert, und die Sphäroide wurden 24 Stunden lang in Gegenwart oder Abwesenheit von Testsubstanzen in Kultur gehalten (Abbildung 2). Die Quantifizierung des ADCC basiert auf dem Nachweis des apoptotischen Krebszelltods (Annexin-V-Färbung) mit Hilfe eines High-Content-Analysesystems.
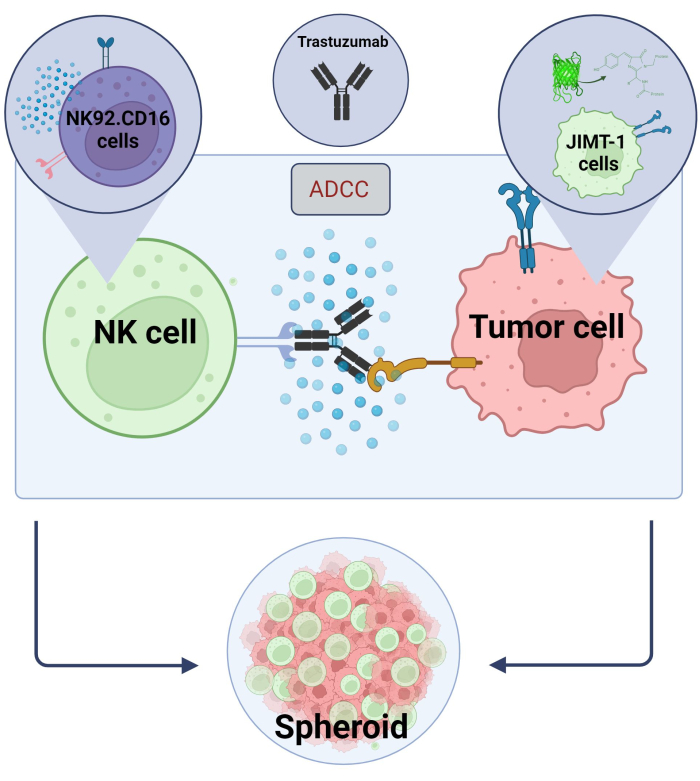
Abbildung 2. ADCC in einem 3D-Sphäroid-Co-Kultursystem. Unsere experimentellen Einstellungen basieren auf einem 3D-Sphäroidsystem, das die In-vivo-Mikroumgebung im Vergleich zu 2D-Modellen genauer modellieren kann. JIMT-1 EGFP-Brustkrebszellen wurden auf einem konkaven zellabweisenden Boden ausgesät, um einen runden Zellhaufen zu bilden, der als Sphäroid bezeichnet wird. ADCC wurde dann durch Hinzufügen von NK92 initiiert. CD16 natürliche Killerzellen (E:T-Verhältnis = 20:1) und ein monoklonaler Anti-HER2-Antikörper, Trastuzumab. Das experimentelle Modell hat sich als effizient und leicht anwendbar für die Identifizierung von ADCC-modifizierenden Testverbindungen erwiesen (Bild erstellt mit Biorender.com). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wir haben gezeigt, dass die Datenerfassung auf diese Weise in Echtzeit erfolgen kann und statistisch robust für den Einsatz im High-Content-Screening in der Krebswirkstoffforschung ist. Wichtig ist, dass dieses Modell eine erweiterte Validierung einer größeren Anzahl von Verbindungen ermöglicht und auf mehrere Assays von Interesse angewendet werden kann.
Protocol
Representative Results
Discussion
Trotz erheblicher Verbesserungen bei der Behandlung von BC in den letzten Jahrzehnten entwickeln Patienten immer noch regelmäßig Medikamentenresistenzen oder leiden unter negativen Nebenwirkungen24. Die hohe Morbidität und Mortalität im Zusammenhang mit BC erfordern eine kontinuierliche Untersuchung der zugrunde liegenden molekularen Mechanismen, ebenso wie robuste Screening-Plattformen, um neue Moleküle zu identifizieren, die für die therapeutische Entwicklung geeignet sind<sup class="xref"…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
LV erhielt Mittel aus den Zuschüssen des Nationalen Amtes für Forschung, Entwicklung und Innovation GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 und K147482. Dieses Projekt wurde vom Ungarischen Forschungsnetzwerk HUN-REN gefördert. CD16.176V.NK-92-Zellen wurden von Dr. Kerry S. Campbell (Fox Chase Center, Philadelphia, PA, im Auftrag von Brink Biologics, lnc. San Diego, CA), sind weltweit durch Patente geschützt und wurden von Nantkwest, lnc lizenziert. (www.nantkwest.com). Die Autoren danken György Vereb und Árpád Szöőr für ihre Hilfe bei der Verwendung der NK-92-Zelllinie und des TR-F(ab’)2 sowie für die technische Beratung.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Referenzen
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

