종양 스페로이드 모델에서 항체 의존성 세포 독성 정량화: 약물 발견을 위한 응용
Summary
여기에서는 항종양 항체의 중요한 암세포 사멸 기전인 ADCC 기전을 조절하는 화합물을 확인하는 방법을 제시합니다. NK 세포의 세포독성 효과는 트라스투주맙이 있는 유방암 세포 스페로이드에서 측정됩니다. 이미지 분석은 스페로이드에서 살아있는 킬러와 죽은 킬러와 표적 세포를 식별합니다.
Abstract
종양 항원을 표적으로 하는 단클론 항체 기반 면역 요법은 현재 암 치료의 중심입니다. 항체의 임상적으로 관련된 작용 기전 중 하나는 항체 의존성 세포 독성(ADCC)으로, 항체가 암세포에 결합하고 면역 체계의 세포 구성 요소(예: 자연 살해(NK) 세포)와 결합하여 종양 세포를 죽입니다. 이러한 치료법의 효과는 암세포의 민감도 또는 면역 세포의 효능을 증가시키는 보조 화합물을 식별함으로써 향상될 수 있습니다. 또한, 이전 질환 또는 암 관련 증상에 대해 병용투여한 암 환자에서 발견되지 않은 약물 상호작용이 항체 치료의 성공을 결정할 수 있습니다. 따라서 이러한 원치 않는 약물 상호 작용을 제거해야 합니다. 이러한 목표를 염두에 두고 암 ADCC 모델을 만들었으며 ADCC 조절 약물을 찾기 위한 간단한 프로토콜을 설명합니다. 암세포 스페로이드와 같은 3D 모델은 항암 치료에 대한 종양의 in vivo 반응을 예측하는 데 있어 2D 배양보다 우수하기 때문에 EGFP 발현 HER2+ JIMT-1 유방암 세포와 NK92의 스페로이드 공동 배양. CD16 세포주를 설정하고 HER2 양성 유방암에 대해 임상적으로 승인된 단일클론 항체인 트라스투주맙(Trastuzumab)으로 유도했습니다. JIMT-1 스페로이드는 세포 발수성 U-바닥 96웰 플레이트에서 형성되도록 허용되었습니다. 3일째에는 NK세포와 트라스투주맙을 추가하였다. 그런 다음 스페로이드를 Annexin V-Alexa 647로 염색하여 자가사멸 세포 사멸을 측정하고, 자동 현미경으로 스페로이드의 주변 영역에서 정량화했습니다. ADCC 조절 분자를 식별하기 위한 분석의 적용 가능성은 전이성 암에 대해 FDA가 승인한 수용체 티로신 키나아제 억제제인 Sunitinib이 ADCC를 거의 완전히 폐지한다는 것을 보여줌으로써 입증되었습니다. 스페로이드 생성과 이미지 획득 및 분석 파이프라인은 암세포 스페로이드의 ADCC 조절 화합물에 대한 고처리량 스크리닝과 호환됩니다.
Introduction
다세포 종양 스페로이드(MCTS)는 부착 세포가 응집하는 경향으로 인해 형성되는 널리 사용되는 3차원(3D) 모델로, 암세포 생물학에 대한 기계론적 통찰력을 얻기 위한 중요한 도구입니다. 액체 기반 및 스캐폴드 기반 3D 배양과 같은 다양한 기술을 통해 광범위한 세포 유형에서 생성할 수 있습니다1. 단층 2D 모델에 비해 가장 큰 장점은 종양 세포의 생물학적 거동, 특히 치료 탈출 및 약물 내성으로 이어지는 메커니즘을 모방하여 생체 내 종양의 주요 특징, 즉 구조적 조직 및 저산소증을 요약한다는 것입니다2. 따라서 MCTS는 독성 및 약물 감수성의 예측 가능성을 향상시킬 수 있기 때문에 3D에서 암을 연구하는 데 널리 사용되며 다양한 유형의 암에 대한 효과적인 약물 개발을 향상시킬 수 있습니다3.
모든 질병을 연구하려면 관련성 있고 편리한 모델이 매우 필요합니다. 암 면역학 연구를 위한 모델을 설정하는 것은 면역 체계가 여러 세포 유형으로 구성되어 있기 때문에 어렵습니다. 각 세포 유형에는 여러 하위 유형과 광범위한 활성화 상태가 있습니다. 이러한 다양한 면역 세포 유형은 암세포 및 기타 종양 구성 요소와 상호 작용하여 궁극적으로 질병의 결과에 영향을 미칩니다. 2D in vitro 세포 배양 방법은 번역성이 부족하고 시스템 수준(예: 조직)에서 약물의 작용을 예측할 수 없기 때문에 이러한 복잡한 세포 상호 작용을 재현하지 못합니다4,5. 더욱이 마우스 모델은 인간과 쥐의 면역 체계 사이의 근본적인 차이로 인해 심각한 한계를 가지고 있습니다. 따라서 3D 배양 시스템은 현재 사용 가능한 모델의 격차를 메우고 대체 방법을 제공하고 암 면역학에 대한 이해를 향상시킬 수 있습니다6. 구체적으로, 스페로이드 모델은 면역요법을 시험하는 데 사용될 수 있는데, 이는 주로 스페로이드 표적에 대한 면역세포 침윤 및 항종양 효과를 향상시키기 위한 약물 스크리닝 및 치료용 항체의 효율성을 평가하기 위한 것이다7. 또한, 기질 세포(예: 림프구, 대식세포, 섬유아세포)와 암세포 간의 상호작용을 연구하고 새로운 항암 전략을 개발하기 위한 다양한 대사 및 증식 상태의 세포로 구성된 MCTS의 잠재력은 충분히 입증되었습니다8. 따라서 종양 미세환경의 병태생리학을 고려하여 약물 테스트 프로세스를 강화하기 위해 예측 가능하고 정확한 플랫폼을 확증할 필요가 있습니다.
유방암(BC)은 전 세계적으로 여성에게 가장 많이 진단되는 암입니다. 이 이종 질환의 임상적 분류는 인간 표피 성장 인자 수용체 2(HER2) 단백질/종양유전자의 과발현 또는 증폭과 함께 에스트로겐(ER) 및 프로게스테론(PR) 수용체(총칭하여 호르몬 수용체, HR라고 함)와 같은 막관통 수용체의 존재를 기반으로 합니다. 이러한 수용체의 면역조직화학적 발현에 기초하여 일반적으로 루미날 A(HR+/HER2-), 루미날 B(HR+/HER2+), HER2 양성(HR-/HER2+) 및 삼중음성 유방암(HR-/HER2-)의 4가지 아형이 인식됩니다. HER2+ 그룹은 BC 증례의 10-15%를 차지하며, ER 및 PR이 없는 상태에서 HER2 발현이 높고, 내강 종양에 비해 예후가 나쁘며, HER2/neu 단백질에 대한 특정 약물이 필요한 것이 특징이다9.
BC 발달은 다단계 과정이며, 질병의 성공적인 치료를 위해서는 조기 진단이 필수적이다10. 그러나 최근 등장한 맞춤형 BC 치료 옵션(예: 내분비 및 항-HER2 항체 요법)에도 불구하고 BC는 계속해서 종양학자들에게 도전 과제를 안겨주고 있습니다. 수술, 화학요법 및 방사선 요법과 마찬가지로 이러한 맞춤형 치료법도 심각한 부작용을 일으킬 수 있으며 환자는 이러한 약제에 대한 내성을 갖게 될 수 있으므로 최상의 전략을 결정하는 것이 장기적으로 어려운 과제가 될 수 있다11,12. 따라서, 종양과 미세환경 사이의 상호작용에 대한 이해의 향상이 필수적이며, 다양한 BC 아형의 특이성을 고려한 새로운 치료법의 개발을 위한 새로운 방향을 제공할 것으로 기대된다13. 항체 약물 접합체, 입양 T 세포 치료제, 백신 및 새로운 HER2 지향 단클론 항체(mAb)와 같은 새로운 면역 요법이 HER2 발현 종양이 있는 광범위한 환자 집단에서 연구되고 있다14.
예를 들어, 트라스투주맙(Trastuzumab)은 HER2+ BC에 대한 효율적인 치료 방식을 나타냅니다. 작용 방식의 일환으로 트라스투주맙은 단편 결정화 가능한 감마 수용체(FcγR) 의존성 활성을 매개합니다. FcγR은 Fc 분절에 대한 친화력과 이들이 개시하는 면역 반응으로 구별됩니다. 자연살해(NK) 세포에서 FcγRIIIa(CD16A)를 활성화하는 것은 항체 의존성 세포 독성(ADCC)을 매개하는 데 중요하며, 대식세포에서 FcγRIIa(CD32A) 및 FcγRIIIa를 유발하면 항체 의존성 세포 식균작용(ADCP)을 유도합니다15. 동물 모델에 대한 연구에 따르면 FcγRI(CD64) 및 FcγRIII(CD16) 수용체가 결핍된 마우스는 종양 특이적 항원에 대한 보호 면역 반응을 시작할 수 없었으며, 이는 ADCC가 mAb Trastuzumab16의 주요 작용 기전일 가능성이 있음을 보여주었습니다.
NK 세포는 ADCC에 의한 암세포 사멸을 위해 종양 세포 결합 Abs에 의존하기 때문에 Fc 수용체의 발현은 Trastuzumab17 의 효율적인 치료에 매우 중요합니다(그림 1). 더욱이, 이들의 작용은 활성화 및 억제 수용체, 예를 들어, 킬러 세포 면역글로불린 유사(KIR) 수용체(18)의 자극에 의해 효율적으로 균형을 이룬다.
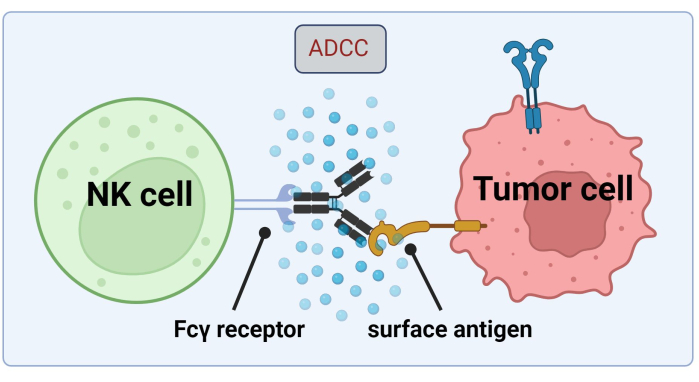
그림 1. 항종양 반응의 맥락에서 ADCC의 메커니즘. 자연살해(NK) 세포의 Fcγ 수용체는 이전에 암세포의 표면 항원에 결합했던 항체의 Fc 영역을 인식합니다. 이 면역학적 시냅스는 NK 세포의 탈과립화로 이어지고, NK 세포는 그랜자임(granzymes)과 퍼포린(perforin)과 같은 세포독성 매개체를 방출합니다. 이 분자는 세포막의 기공 형성에 기여하고 세포 사멸 경로를 활성화하여 표적 세포의 프로그램된 세포 사멸을 유발합니다( Biorender.com 로 생성된 이미지). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
HER2+ BC에 대한 면역 요법 개발은 진화하는 분야입니다. 이 경우 면역 체계의 다양한 구성 요소 간의 상호 작용을 고려해야 합니다. 또한, 이전 간행물에서는 시너지 효과를 내는 조합을 확인하기 위해 모든 유형의 전통적 치료법, 면역 요법 또는 세포 치료법을 포함하는 병용 요법을 광범위하게 테스트했다19.
HER2+ BC의 여러 3D 모델은 이전에 신약 개발에 사용되었습니다. 예를 들어, Balalaeva 등은 HER2를 과발현하는 SKBR-3 스페로이드를 사용하여 HER2 표적 면역독소 4D5scFv-PE40의 세포 독성을 평가했습니다20. 또 다른 연구에서는 트라스투주맙 및 내분비제에 대한 반응으로 세포 성장을 측정하기 위해 3D Matrigel 기반 HER2+ BC 배양 시스템을 구축했습니다21. 이러한 연구는 치료 반응을 임상적으로 개선하기 위한 효과적인 전략을 나타내는 데 있어 암세포를 과발현하는 HER2의 종양 스페로이드 모델의 중요성을 강조합니다22.
우리 그룹은 이전에 2D 배양 분석에서 JIMT-1 HER2+ BC 세포에서 트라스투주맙 의존성 ADCC의 억제제로 다중표적 티로신 키나아제 억제제인 Sunitinib을 확인했습니다. 이 연구는 수니티닙이 자가포식을 유도하고 NK 세포 사멸 기능을 손상시켜 HER2 발현을 하향 조절하고 JIMT-1 세포의 표면 부착을 향상시킨다는 것을 밝혔다17.
여기에서 우리는 고처리량 스크리닝 응용 분야에 사용할 새로운 3D 스페로이드 ADCC 모델(NK.92.CD16+Trastuzumab+JIMT-1-EGFP 암세포)을 확립했으며, 위에서 언급한 결과를 검증하기 위해 Sunitinib을 모델 화합물로 사용했습니다. 먼저, JIMT-1 세포를 발현하는 EGFP를 생성하고,이들 세포로부터 스페로이드를 성장시켰다. ADCC는 트라스투주맙과 함께 NK 세포에 의해 유도되었으며, 스페로이드는 시험 화합물의 유무에 관계없이 24시간 동안 배양된 상태로 유지되었습니다(그림 2). ADCC의 정량화는 High-Content Analysis 시스템을 사용한 자가사멸 암세포 사멸(Annexin V 염색) 검출을 기반으로 합니다.
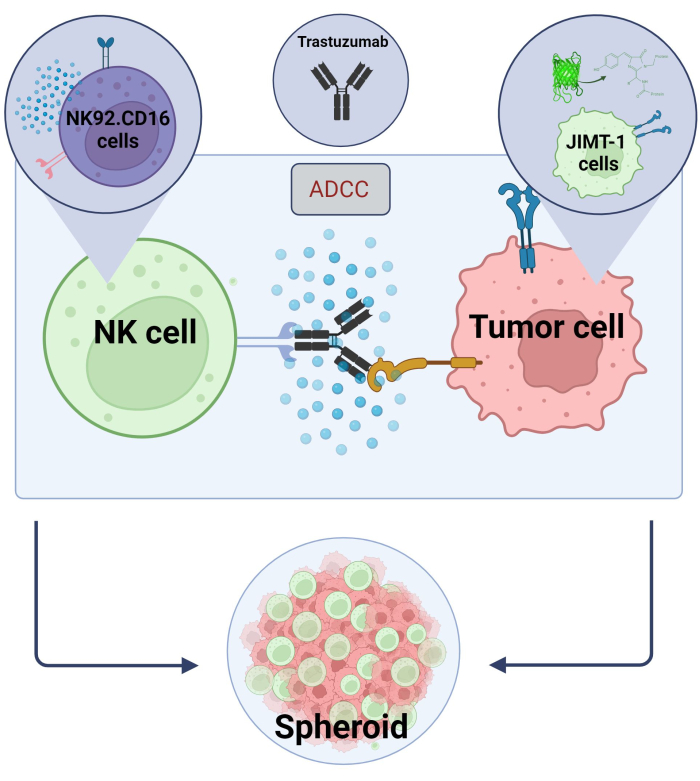
그림 2. 3D 스페로이드 공동 배양 시스템의 ADCC. 당사의 실험 설정은 2D 모델에 비해 생체 내 미세환경을 더 정확하게 모델링할 수 있는 3D 스페로이드 시스템을 기반으로 합니다. JIMT-1 EGFP 유방암 세포를 오목한 세포 퇴치제 바닥에 파종하여 스페로이드라고 하는 둥근 모양의 세포 클러스터를 형성했습니다. 그런 다음 NK92를 추가하여 ADCC를 시작했습니다. CD16 자연살해세포(E:T 비율 = 20:1) 및 항-HER2 단클론 항체인 트라스투주맙. 실험 모델은 ADCC 변형 테스트 화합물( Biorender.com 로 생성된 이미지)의 식별에 효율적이고 쉽게 적용할 수 있는 것으로 입증되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
우리는 이러한 방식으로 데이터를 수집할 수 있으며 암 약물 발견에서 high-content 스크리닝에 사용하기 위해 통계적으로 견고하다는 것을 입증했습니다. 중요한 것은 이 모델을 사용하면 더 큰 화합물 세트에 대한 확장된 검증이 가능하며 관심 있는 여러 분석에 적용할 수 있다는 것입니다.
Protocol
Representative Results
Discussion
지난 수십 년 동안 BC 치료가 크게 개선되었음에도 불구하고 환자들은 여전히 정기적으로 약물 내성을 일으키거나 부작용을 경험한다24. BC주와 관련된 높은 이환율과 사망률은 치료제 개발에 사용할 수 있는 새로운 분자를 식별하기 위한 강력한 스크리닝 플랫폼과 마찬가지로 근본적인 분자 메커니즘에 대한 지속적인 연구를 요구한다25. 이러한 전략에는 세포 …
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
LV는 GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 및 K147482. 이 프로젝트는 HUN-REN 헝가리 연구 네트워크로부터 자금을 지원받았습니다. CD16.176V.NK-92 세포는 Kerry S. Campbell 박사(Brink Biologics, lnc. San Diego, CA)는 전 세계 특허에 의해 보호되며 Nantkwest, lnc의 라이선스를 받았습니다. (www.nantkwest.com). 저자들은 NK-92 세포주와 TR-F(ab’)2의 사용에 도움을 주고 기술적 조언을 해준 György Vereb과 Árpád Szöőr에게 감사의 뜻을 전합니다.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Referenzen
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

