Quantificação da Citotoxicidade Celular Dependente de Anticorpos em Modelo Esferoide Tumoral: Aplicação para Descoberta de Fármacos
Summary
Aqui, apresentamos um método para identificar compostos que modulam o mecanismo ADCC, um importante mecanismo de morte de células cancerígenas de anticorpos antitumorais. O efeito citotóxico das células NK é medido em esferoides de células de câncer de mama na presença de trastuzumabe. A análise de imagens identifica células assassinas e alvo vivas e mortas em esferoides.
Abstract
A imunoterapia baseada em anticorpos monoclonais direcionada a antígenos tumorais é agora um pilar do tratamento do câncer. Um dos mecanismos clinicamente relevantes de ação dos anticorpos é a citotoxicidade celular dependente de anticorpos (ADCC), em que o anticorpo se liga às células cancerosas e engaja o componente celular do sistema imunológico, por exemplo, células natural killer (NK), para matar as células tumorais. A eficácia dessas terapias poderia ser melhorada pela identificação de compostos adjuvantes que aumentam a sensibilidade das células cancerosas ou a potência das células imunes. Além disso, interações medicamentosas não descobertas em pacientes com câncer comedicados para condições prévias ou sintomas associados ao câncer podem determinar o sucesso da terapia com anticorpos; portanto, tais interações medicamentosas indesejadas precisam ser eliminadas. Com esses objetivos em mente, criamos um modelo de ADCC para câncer e descrevemos aqui um protocolo simples para encontrar drogas moduladoras do ADCC. Uma vez que modelos 3D, como esferoides de células cancerosas, são superiores a culturas 2D na previsão de respostas in vivo de tumores a terapias anticâncer, co-culturas esferoides de células de câncer de mama HER2+ JIMT-1 que expressam EGFP e NK92. Linhagens celulares CD16 foram montadas e induzidas com trastuzumabe, um anticorpo monoclonal clinicamente aprovado contra o câncer de mama HER2-positivo. Esferoides JIMT-1 foram deixados formar em placas de 96 poços repelentes de células com fundo U. No dia 3, células NK e trastuzumabe foram adicionados. Os esferoides foram então corados com Annexin V-Alexa 647 para medir a morte celular apoptótica, que foi quantificada na zona periférica dos esferoides com um microscópio automatizado. A aplicabilidade de nosso ensaio para identificar moléculas moduladoras do ADCC é demonstrada mostrando que o Sunitinibe, um inibidor da tirosina quinase do receptor aprovado pelo FDA contra câncer metastático, abole quase completamente o ADCC. A geração dos esferoides e os pipelines de aquisição e análise de imagens são compatíveis com a triagem de alto rendimento para compostos moduladores de ADCC em esferoides de células cancerosas.
Introduction
Os esferoides tumorais multicelulares (STCM) são modelos tridimensionais (3D) amplamente utilizados que se formam devido à tendência das células aderentes em se agregarem e representam uma importante ferramenta para obter informações mecanicistas sobre a biologia das células cancerosas. Eles podem ser gerados a partir de uma ampla gama de tipos celulares por inúmeras técnicas, tais como culturas 3D baseadas em líquido e andaimes1. Sua principal vantagem sobre os modelos 2D monocamada é que eles recapitulam as principais características dos tumores in vivo , ou seja, a organização estrutural e a hipóxia, mimetizando o comportamento biológico das células tumorais, especialmente os mecanismos que levam ao escape terapêutico e à resistência adrogas2. Assim, uma vez que os TCM podem melhorar a previsibilidade da toxicidade e sensibilidade a drogas, eles são amplamente utilizados para estudar cânceres em 3D e poderiam melhorar o desenvolvimento de drogas eficazes para diferentes tipos decâncer3.
Para estudar qualquer doença, há uma necessidade crítica de modelos relevantes e convenientes. A criação de modelos para estudos de imunologia do câncer é um desafio porque o sistema imunológico consiste em vários tipos celulares. Cada tipo de célula tem vários subtipos e um amplo espectro de estados de ativação. Esses diferentes tipos de células imunes interagem com células cancerosas e outros componentes tumorais, influenciando o resultado da doença. Os métodos de cultura de células in vitro 2D falham em recapitular essas interações celulares complexas, pois não têm traduzibilidade e são incapazes de prever a ação de um fármaco no nível do sistema (por exemplo, em tecidos)4,5. Além disso, os modelos de camundongos também têm limitações severas devido às diferenças fundamentais entre os sistemas imunológico humano e murino. Sistemas de cultura 3D podem, portanto, preencher as lacunas atuais nos modelos disponíveis, fornecendo um método alternativo e melhorando nossa compreensão da imunologia do câncer6. Especificamente, modelos esferoides podem ser usados para testar imunoterapias, principalmente para avaliar a eficiência da triagem de drogas e anticorpos terapêuticos para aumentar a infiltração de células imunes e efeitos antitumorais contra os alvos esferoides7. Além disso, o potencial dos TCMS compostos por células em diferentes estados metabólicos e proliferativos para estudar as interações entre células do estroma (por exemplo, linfócitos, macrófagos, fibroblastos) e células cancerosas e para o desenvolvimento de novas estratégias anticâncer tem sido amplamentedemonstrado8. Assim, há uma necessidade vital de corroborar plataformas preditivas e precisas para impulsionar o processo de teste de drogas, levando em consideração a fisiopatologia do microambiente tumoral.
O câncer de mama (CB) é o câncer mais frequente diagnosticado em mulheres no mundo. A classificação clínica dessa doença heterogênea baseia-se na presença de receptores transmembrana, por exemplo, receptores de estrogênio (RE) e progesterona (RP) (coletivamente chamados de receptores hormonais, HR), juntamente com a superexpressão ou amplificação da proteína/oncogene receptor 2 do fator de crescimento epidérmico humano (HER2). Com base na expressão imunoistoquímica desses receptores, quatro subtipos são comumente reconhecidos: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-positivo (HR-/HER2+) e triplo-negativo câncer de mama (HR-/HER2-). O grupo HER2+ constitui 10-15% dos casos de CB e é caracterizado por alta expressão de HER2 com ausência de RE e RP, tendo pior prognóstico em relação aos tumores luminais e necessitando de drogas específicas direcionadas contraa proteína HER2/neu9.
O desenvolvimento de CB é um processo de várias etapas, sendo o diagnóstico precoce essencial para o sucesso do tratamento da doença10. No entanto, apesar das opções personalizadas de tratamento do BC recentemente surgidas (por exemplo, terapias endócrinas e de anticorpos anti-HER2), o CB continua a desafiar os oncologistas. Assim como a cirurgia, a quimioterapia e a radioterapia, essas terapias personalizadas também podem ter efeitos adversos graves e os pacientes podem desenvolver resistência a esses agentes, tornando-se um desafio a longo prazo determinar a melhor estratégia11,12. Assim, uma melhor compreensão da interação entre o tumor e seu microambiente é essencial e espera-se que forneça novas direções para o desenvolvimento de novos tratamentos que levem em conta as especificidades dos diferentes subtipos de CB13. Uma nova onda de imunoterapias, tais como conjugados de drogas de anticorpos, terapias adotivas de células T, vacinas e novos anticorpos monoclonais direcionados a HER2 (mAbs) estão sendo estudados em uma ampla população de pacientes com tumores que expressam HER214.
O trastuzumabe, por exemplo, representa uma modalidade de tratamento eficiente para HER2+ CB. Como parte de seu modo de ação, o trastuzumabe medeia atividades dependentes do receptor gama cristalizável de fragmentos (FcγR). Os FcγRs distinguem-se pela sua afinidade pelo fragmento Fc e pela resposta imune que iniciam. A ativação do FcγRIIIa (CD16A) em células natural killer (NK) é crucial para mediar a citotoxicidade celular dependente de anticorpos (ADCC), enquanto o desencadeamento de FcγRIIa (CD32A) e FcγRIIIa em macrófagos induz fagocitose celular dependente de anticorpos (ADCP)15. Estudos em modelos animais mostraram que camundongos sem receptores FcγRI (CD64) e FcγRIII (CD16) foram incapazes de iniciar respostas imunes protetoras contra antígenos tumor-específicos, revelando que o ADCC é provavelmente um importante mecanismo de ação para o mAb Trastuzumabe16.
Uma vez que as células NK recorrem ao Abs ligado às células tumorais para a morte de células cancerosas pelo ADCC, a expressão dos receptores Fc é crítica para um tratamento eficaz com Trastuzumabe17 (Figura 1). Além disso, sua ação é eficientemente balanceada por uma estimulação de receptores ativadores e inibitórios, por exemplo, receptores Killer-cell immunoglobulin-like (KIR)18.
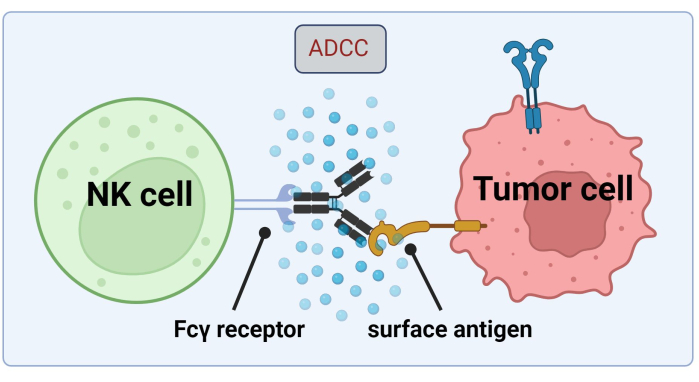
Gráfico 1. Mecanismo do ADCC no contexto de uma resposta antitumoral. O receptor Fcγ de uma célula natural killer (NK) reconhece a região Fc de um anticorpo, que anteriormente se ligou a um antígeno de superfície em uma célula cancerosa. Essa sinapse imunológica leva à degranulação da célula NK, que libera mediadores citotóxicos como granzimas e perforina. Essas moléculas contribuem para a formação de poros na membrana celular e ativam vias apoptóticas causando morte celular programada da célula-alvo (imagem criada com Biorender.com). Clique aqui para ver uma versão maior desta figura.
O desenvolvimento de imunoterapia para HER2+ BC representa um campo em evolução. Neste caso, deve-se considerar interações entre vários componentes do sistema imunológico. Além disso, publicações anteriores testaram extensivamente terapias combinadas envolvendo todos os tipos de terapias tradicionais, imunes ou celulares para identificar combinações sinérgicas19.
Vários modelos 3D de HER2+ BC já foram usados para a descoberta de drogas. Por exemplo, Balalaeva e col. utilizaram esferoides SKBR-3 superexpressando HER2 para avaliar a citotoxicidade da imunotoxina direcionada para HER2 4D5scFv-PE4020. Em outro estudo, um sistema de cultura HER2+ BC baseado em Matrigel 3D foi estabelecido para medir o crescimento celular em resposta ao trastuzumabe e agentes endócrinos21. Esses estudos destacam a importância de modelos esferoides tumorais de células cancerosas HER2 superexpressarem uma estratégia eficaz para melhorar clinicamente as respostasterapêuticas22.
Nosso grupo identificou previamente o Sunitinibe, um inibidor multidirecionado da tirosina quinase, como um inibidor do ADCC dependente de trastuzumabe em células JIMT-1 HER2+ BC em um ensaio de cultura 2D. O estudo revelou que o Sunitinib induz autofagia e prejudica a função de morte das células NK, diminuindo a expressão de HER2 e aumentando a fixação superficial das células JIMT-17.
Aqui estabelecemos um novo modelo 3D esferoide de ADCC (células cancerosas NK.92.CD16+Trastuzumab+JIMT-1-EGFP) para ser usado para aplicações de triagem de alto rendimento e, a fim de validar os achados acima mencionados, Sunitinib foi usado como um composto modelo. Primeiro, geramos EGFP expressando células JIMT-117 e crescemos esferoides a partir dessas células. O ADCC foi induzido por células NK juntamente com trastuzumabe, e os esferoides foram mantidos em cultura na presença ou ausência de compostos teste por 24 h (Figura 2). A quantificação do ADCC baseia-se na detecção de morte de células cancerosas apoptóticas (coloração da Anexina V) usando um sistema de Análise de Alto Conteúdo.
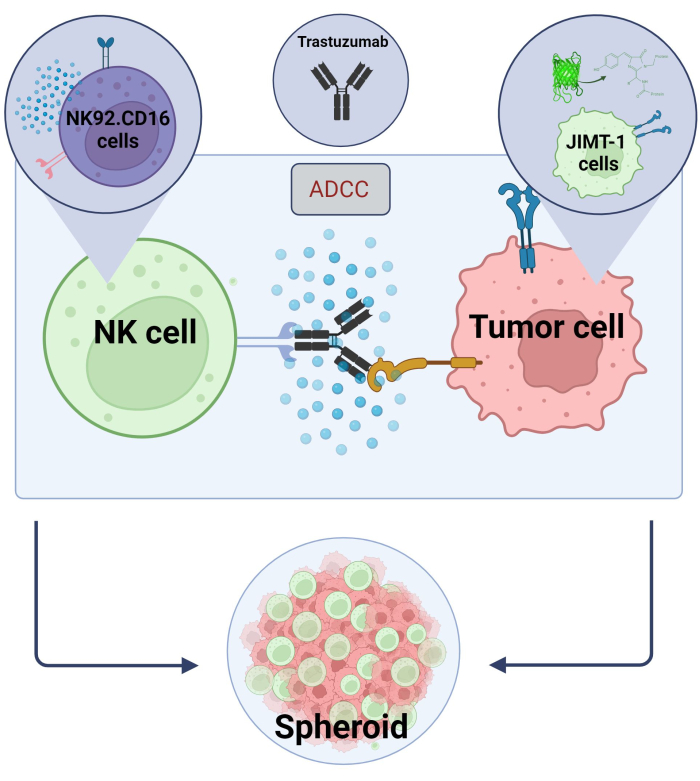
Gráfico 2. ADCC em um sistema de co-cultura esferoide 3D. Nossas configurações experimentais são baseadas em um sistema esferoide 3D que pode modelar com mais precisão o microambiente in vivo em comparação com modelos 2D. As células de câncer de mama JIMT-1 EGFP foram semeadas em um fundo repelente de células côncavas para formar um aglomerado celular de forma redonda, chamado esferoide. O ADCC foi então iniciado com a adição do NK92. células natural killer CD16 (relação E:T = 20:1) e um anticorpo monoclonal anti-HER2, o trastuzumabe. O modelo experimental mostrou-se eficiente e facilmente aplicável para a identificação de compostos modificadores do ADCC (imagem criada com Biorender.com). Clique aqui para ver uma versão maior desta figura.
Demonstramos que a aquisição de dados dessa maneira pode ser feita em tempo real e é estatisticamente robusta para o uso em rastreamento de alto conteúdo na descoberta de medicamentos contra o câncer. É importante ressaltar que este modelo permite uma validação estendida de um conjunto maior de compostos, e pode ser aplicado a vários ensaios de interesse.
Protocol
Representative Results
Discussion
Apesar das melhorias significativas no tratamento da CB nas últimas décadas, os pacientes ainda desenvolvem regularmente resistência aos medicamentos ou experimentam efeitos colaterais negativos24. A alta morbidade e mortalidade ligadas à CB exigem uma investigação contínua sobre os mecanismos moleculares subjacentes, assim como plataformas robustas de triagem para identificar novas moléculas acionáveis para o desenvolvimento terapêutico25. Essas estratégias requ…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
LV recebeu financiamento do National Research, Development and Innovation Office grants GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 e K147482. Este projeto recebeu financiamento da Rede Húngara de Investigação HUN-REN. As células CD16.176V.NK-92 foram obtidas do Dr. Kerry S. Campbell (Fox Chase Center, Filadélfia, PA, em nome da Brink Biologics, lnc. San Diego, CA), são protegidos por patentes em todo o mundo, e foram licenciados pela Nantkwest, lnc. (www.nantkwest.com). Os autores agradecem a György Vereb e Árpád Szöőr pela ajuda no uso da linhagem celular NK-92 e do TR-F(ab’)2, e pelo aconselhamento técnico.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Referenzen
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

