수소 환율 질량 분석을 사용하여 단백질의 역학 분석
Summary
단백질의 입체 구조와 역학은 단백질 구조 및 기능 사이의 관계를 이해하기위한 열쇠이다. 고해상도 질량 분광법과 결합 수소 교환은 단백질의 형태 적 역학 연구뿐만 아니라 접촉 인터페이스 및 알로 스테 릭 효과를 포함하여 단백질 – 리간드와 단백질 – 단백질 상호 작용을 특성화하기 위해 다양한 방법이다.
Abstract
모든 세포 과정은 단백질의 기능에 따라 달라집니다. 주어진 단백질의 기능은 독특한 아미노산 서열의 직접적인 결과이지만, 그것은 오직 하나의 정의 된 입체 배열 또는 더 일반적 interconverting 배좌의 앙상블로로 폴리펩티드 사슬의 접힘에 의해 실현된다. 단백질의 입체 구조와 기능 사이의 연결을 조사하는 것은 단백질이 작업에 자신의 큰 다양성을 충족 할 수있는 방법을 완전히 이해 필수적이다. 기능적 사이클을 통해 진행하면서 겪는 단백질 형태 적 변화를 연구하는 하나의 가능성은 수소 한 고분해능 질량 분석법 (HX-MS)와 조합 H / H 2 – 교환이다. HX-MS는 예를 들어, 결정학에 의해 얻어진 구조 정보에 새로운 차원을 추가하는 다양하고 강력한 방법입니다. 그것은 작은 몰의 결합, 폴딩 및 전개 단백질을 연구하는 데 사용됩니다ecule 리간드, 단백질 – 단백질 상호 작용, 촉매 반응을 효소 연결된 구조적 변경 및 allostery. 단백질의 양이 매우 제한적이거나 단백질의 결정화가 가능하지 않을 경우 또, HX-MS가 종종 사용된다. 여기에서 우리는 HX-MS와 단백질 역학을 공부하는 일반적인 프로토콜을 제공하는 방법과 복잡한에 두 단백질의 상호 작용 인터페이스를 공개하는 예를 들어 설명합니다.
Introduction
단백질 및 단백질 복합체의 결정 구조의 수는 최근에 급격히 증가 하였다. 그들은 이러한 단백질의 구조적 조직의 귀중한 스냅 선물 구조 – 기능 분석을위한 기초를 제공한다. 그러나, 단백질의 기능에 필수적인 구조적 변화의 역학은 거의 X-선 결정학에 의해 공개되지 않습니다. 극저온 electronmicroscopy, 반면에, 상이한 입체 형태로 단백질 및 단백질 복합체를 캡처 할 수 있지만, 일반적으로 이차 구조 레벨 1에 형태 적 변화를 해결할 수 없다. 원자 세부 사항 용액에 단백질의 구조적 역학은 NMR에 의해 해결 될 수 있지만,이 방법은 여전히 상대적으로 작은 크기 (일반적으로 ≤ 30 kDa의)의 단백질로 제한하고 실험을 방해하는 단백질의 높은 농도 (≥ 100 μM)를 필요로한다 올리고머 또는 집계 발생하기 쉬운 단백질 2. 한 가지 방법이고해상도의 X-선 결정학 및 크라이 electronmicroscopy 어느 사이 해소 할 수는 단백질의 크기 나 농도에 의해 제한되지 않는다 아미드 수소 한 질량 분석계 (MS)와 결합 H / 2 H 교환기 (HX)입니다. 최근 몇 년 동안이 방법은 단백질 역학, 단백질 접힘, 단백질의 안정성과 구조적 변화 3-5의 분석을위한 유용한 분석 도구를 개발했습니다. 이 방법의 분자 기초는 단백질 D 2 O 용액에 배치 될 때, 중수소 원자와 교환 할 것이다 단백질 백본 아미드 수소의 불안정한 성질이다. 시간에 따른 단백질 질량의 후속 증가는 고해상도 MS로 측정된다.
짧은 비정형 펩티드 만 온도, 촉매 농도에 따라 HX (OH -도 3 참조, H 3 O + 즉 산도) 및 유도, 고양이에 의한 인접 잔기의 아미노산 측쇄alytic 및 입체 효과. 고유 화학 환율 K의 채널에 이러한 효과는 우아 바이 등. (6)에 의해 정량화하고 프로그램은 pH와 온도에 따라 폴리펩티드 내의 각 아미노산 K의 채널을 계산 (예의 Z. 장), 사용할 수 있습니다. 중성 pH 및 주위 온도에서 K의 채널 10 1 -10 3 초 -1의 순서입니다. 단단히 접힌 단백질의 내부에 이온 – 접힌 단백질 HX는 주로 이차 구조의 수소 결합과 OH 수화의 접근 제한으로 인해 작은 정도 느리다 2-9 명령 할 수있다. 천연 단백질 HX 따라서 일부 또는 글로벌 전개, 화학 교환 및 식에 따라 기본 상태로 폴딩 연루 (1)과 K OBS 여는 속도 K의 영업 이익, 마감 환율 케이의 CL과 고유 화학 교환에 따라 관찰 환율 라TE K CH 식에 따라 (2).
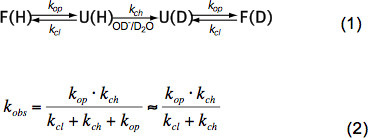
원시 상태의 조건에서 K의 영업 이익은 K의 채널보다 훨씬 작고 분모에서 무시 될 수있다. EX1과 EX2라는 두 개의 극단적 인 환율 제도가 있습니다. K 개의 CL은 K 개의 CH (EX1)보다 훨씬 작은 경우 관찰 속도는 개구율 실질적 같고 HX는 구조 부재의 전개를 즉시 관찰 할 수있다. 구조 요소의 열 때 한 번에 모든 아미드 양성자 교환, 동위 원소 피크 (7)의 바이 모달 분포에 의해 MS에서 쉽게 관찰 할 수 이러한 교환 정권. K의 CL은 K의 채널보다 훨씬 큰 경우 비례 상수는 접이식 전개 equilibriums에 해당된다 (EX2)는 관찰 된 비율은 K의 채널에 비례 상수 K U = K 영업 이익 </sub> / K CL. 동위 원소의 분포가 거의 동일하게 유지하면서 이러한 조건에서, 많은 개폐 이벤트는 평균 질량의 점진적인 증가로 이어지는, deuterons에 대한 모든 아미드 양성자 교환하기 전에 필요합니다. EX2 정권은 ΔG U 전개의 자유 에너지의 결정과 구조적 요소 때문에 안정성을 할 수 있습니다. 원시 상태의 조건에서 EX2 정권은 가장 일반적입니다. pH와 카오 트로픽 요원의 추가의 증가는 EX1에 교환 메커니즘을 전환 할 수 있습니다. 따라서, HX-MS는 열역학적을 탐구뿐만 아니라 단백질 접힘 및 구조적 변화의 운동 매개 변수를 사용할 수 있습니다.
HX 위에서 언급 한 바와 같이하는 것은 본질적으로 pH와 온도에 의존하고 백본 아미드 기의 완전히 용매 노출 된 양성자 교환 반감기>에 생리적 pH에서 5-400 밀리 초 (산도 7.6), 30 ° C,하지만 10 분 사이 pH가 2.9에서> 2 시간의 평균과 0 °와 15 시간(캘리포니아의 반감기. 1 ~ 2 분으로 교환하는 폴리 펩타이드의 첫 번째 백본 아미드 결합의 양자 제외) C. 느린 교환 조건 하에서 아웃이 혼입 deuterons에 포함 된 모든 정보를 잃고,이 조건 하에서 활성 단백질 분해 효소 (예 : 펩신)를 사용하여 샘플을 소화 할 수있다. 느린 교환 조건에서 소화 소화의 도입 이후, 전체 길이 단백질의 전체 HX 반응 속도뿐만 아니라 분석 할 수 있지만, HX는 특정 지역 8,9에 지역화 할 수 있습니다. 공간 해상도는 현재 10 ~ 30 잔기 사이에 일반에 발생하는 소화 파편의 크기로 제한됩니다. 그러나, 펩신으로 인해 분열의 비특이적 인 특성으로 생성 된 중복 조각은 공간 해상도의 증가로 이어질 수 있습니다. 또, 여러 다른 프로테아제는 급냉 조건 하에서 그러나 훨씬 덜 효율적인 열 펩신보다 활성 인 것으로 밝혀졌다. 또한 increa공간 해상도의 SE는 전자 캡쳐 해리 (ECD), 전자 전달 해리 (ETD) 및 적외선 다 광자 해리 (IRMPD) 11-13로서 중수소 패턴을 보존 방법에 의해 기체 상에있는 펩티드의 분열에 의해 도달 될 수있다. 이러한 기술에 의한 충돌 – 유도 해리 (CID)에 의해 관찰되는 분자 내 수소 이온 마이그레이션 ( "스크램블링"), 가장 일반적으로 사용되는 기술로 조각화 공간 해상도의 손실을 방지한다. 그러나 이러한 방법은 모든 개인 펩타이드에 대한 최적화를 필요로하고, 따라서 여전히 매우 도전이다.
HX-MS는 바이러스 캡시드 어셈블리 14-17 포함한 단백질 – 리간드와 단백질 – 단백질 상호 작용을 분석하는데 사용되어왔다. 단백질 전개 및 온도에 의한 구조적 변화가 7,18,19을 조사 하였다뿐만 아니라 접힘. 인산화 및 단일 아미노산 변이 관련 구조적는 16, 20 및 nucleot 변경IDE에 의한 변경 (21, 22)를 분석 하였다. 따라서,이 방법은 조립 및 분자 기계의 역학을 분석 할 이상적으로 적합한 것 같습니다. 그 메커니즘 위대한 장군 관심의 한 매력적인 후보,의 Hsp90 보호자 복잡합니다.
Protocol
Representative Results
Discussion
단백질 상호 작용 파트너의 결합은 필연적으로 결합 부위에 용매 접근성의 변화가 발생합니다. 또한, 많은 단백질은 실제 바인딩 인터페이스가 아닌 다른 지역에 영향을 바인딩에 따라 동적 구조적인 변화를 겪는다. HX-MS는 이러한 변경 사항을 모니터링 할 수있는 강력한 방법이며 다른 방법으로 커버 할 수없는 척도에 단백질의 구조적 변화를 드러내는도 할 수있다.
성공적…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
우리는 원고에 대한 의견에 대한 M. Boysen 감사합니다. 이 프로젝트는 (: CellNetworks EXC 1분의 81 우수 SFB638 및 MA MPM에 1278/4-1 및 클러스터) 도이치 Forschungsgemeinschaft에 의해 투자되었다. MPM은 우수 클러스터의 수사관이다 : CellNetworks.
Materials
| Reagent/Equipment | Company | Catalogue number | Comments (optional) |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
Referencias
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5′-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O’Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).

