Une nouvelle plate-forme d'étirement pour Applications dans cellulaire et tissulaire mécanobiologie
Summary
Nous présentons dans cet article une nouvelle plate-forme d'étirage qui peut être utilisé pour étudier les réponses des cellules individuelles à une déformation mécanique biaxial anisotrope complexe et quantifier les propriétés mécaniques des tissus biologiques.
Abstract
Des outils qui permettent l'application de forces mécaniques de cellules et de tissus ou qui peuvent quantifier les propriétés mécaniques des tissus biologiques ont contribué considérablement à la compréhension de mécanobiologie de base. Ces techniques ont été largement utilisés pour démontrer comment l'apparition et la progression de diverses maladies sont fortement influencés par des signaux mécaniques. Cet article présente une plate-forme multi-fonctionnelle étirage biaxial (Baxs) qui peuvent soit stimuler mécaniquement des cellules individuelles ou de quantifier la rigidité mécanique des tissus. La plate-forme est constituée de quatre Baxs moteurs à bobine mobile qui peuvent être contrôlés de manière indépendante. Les cellules individuelles peuvent être cultivés sur un substrat flexible qui peut être attaché aux moteurs permettant une pour exposer les cellules à des champs de contraintes complexes, dynamiques, et variant spatialement. A l'inverse, par incorporation d'une cellule force de charge, on peut aussi quantifier les propriétés mécaniques des tissus primaires tels qu'ils sont exposés à des cycles de déformation.Dans les deux cas, un ensemble propre de pinces doit être conçu et monté sur les moteurs de plate-forme Baxs afin de maintenir fermement le substrat flexible ou le tissu d'intérêt. La plate-forme Baxs peut être monté sur un microscope inversé pour effectuer simultanément la lumière transmise et / ou de l'imagerie de fluorescence d'examiner la réponse structurelle ou biochimique de l'échantillon au cours d'expériences d'étirement. Cet article fournit des détails expérimentaux de la conception et de l'utilisation de la plate-forme Baxs et présente les résultats pour une seule cellule et études de tissus entiers. La plate-forme Baxs été utilisé pour mesurer la déformation des noyaux dans des cellules de myoblastes de souris individuelles en réponse au substrat souche et de mesurer la rigidité d'aortes de souris isolées. La plate-forme Baxs est un outil polyvalent qui peut être combiné avec différentes microscopies optiques afin de fournir de nouveaux aperçus mécanobiologique au niveau des tissus sous-cellulaire, cellulaire et tout.
Introduction
Le micro-mécanique joue un rôle important dans de nombreuses fonctions cellulaires telles que la prolifération, la migration, la différenciation et qui ont un impact considérable dans le développement et l'homéostase des tissus et également dans des maladies 6.1. Au fil des ans, une multitude d'outils expérimentaux ont été utilisés pour stimuler mécaniquement les cellules ou les tissus et mesurer les propriétés mécaniques des tissus biologiques avec l'objectif d'accroître notre compréhension de mécanobiologie de base et l'étude de l'apparition et la progression des maladies 6-17. Cependant, il faut souvent compter plusieurs différents dispositifs expérimentaux en vue d'atteindre les objectifs d'une étude particulière. Cet article présente une plate-forme unique, multi-fonctionnel, étirage biaxial (Baxs) qui permet à des études qui se penchent sur le rôle que les propriétés mécaniques et les forces mécaniques jouent en biologie à la sous-cellulaire à des échelles de longueur de tissu ensemble. La plate-forme Baxs permet non seulement de la quantification des propriétés mécaniques des tissus isolés, mais aussi facilite l'aptitude à appliquer des champs de contrainte simples, complexes et dynamiques pour les cellules vivantes, pour comprendre leur réponse à l'étirement qui se produit in vivo. La plate-forme Baxs maintient également la capacité d'effectuer la microscopie de cellules vivantes au cours des essais et les perturbations mécaniques sur des cellules et des tissus.
La plate-forme Baxs est un appareil sur-mesure qui peut être utilisé pour étudier l'effet de la déformation du substrat au niveau cellulaire, et effectuer des essais de traction sur des tissus biologiques (Figure 1A). Un dispositif de chauffage de l'aluminium a été fabriquée pour recevoir une boîte de Petri de 10 cm standard et maintenir des solutions physiologiques à 37 ° C en utilisant un régulateur de température et chauffe kapton (Figure 1B). Cette plate-forme de Baxs peut être intégré sur un contraste de phase inversée et / ou le microscope de fluorescence et permet une imagerie simultanée (Figure 1C).En bref, la plate-forme Baxs se compose de quatre moteurs à bobine mobile linéaire dont les parties mobiles sont montées sur des mini-billes à mouvement linéaire portant des glissières orientées le long de deux axes perpendiculaires (figure 1D). Un étage de positionnement linéaire est monté à chacun des quatre moteurs pour permettre le mouvement vertical de l'ensemble de serrage qui sera utilisée (Figure 1E). La position de chaque moteur est contrôlée par un codeur optique avec une résolution de 500 nm (Figure 1F). Les quatre moteurs sont commandés indépendamment avec un contrôleur de mouvement employant retour codeur optique pour exécuter des commandes de mouvement (figure 1G). Une interface de LabVIEW fournit un contrôle total sur la grandeur de déplacement, la vitesse, et l'accélération de chaque moteur afin de générer une déformation complètement personnalisable, statique et dynamique, des cellules ou des échantillons de tissus.
La technique utilisée pour induire une déformation dans les cellules est obtenue par simple allowing de cellules à adhérer fermement à un substrat flexible et transparent, et puis en étirant ce substrat en utilisant les quatre moteurs de la plate-forme Baxs. La plate-forme Baxs permet le montage de n'importe quel ensemble de pinces pour fixer le substrat sur les moteurs à bobine mobile conçu sur mesure. A cet effet, nous avons conçu un ensemble de pinces à laquelle un substrat flexible et transparente, faite de polydiméthylsiloxane (PDMS), peut être fixé (figures 2A-C et Figure 3). Comme les pinces seront exposés à des solutions physiologiques, toutes les pièces ont été usinés à partir d'acier inoxydable pour permettre la stérilisation. Ces colliers de serrage ont été soigneusement conçus pour amener le substrat le plus près possible de l'objectif du microscope pour améliorer la qualité de l'image tout en réduisant au minimum la contrainte sur le substrat lors de l'étirage (Figure 2D).
La même plate-forme de Baxs peut également être utilisée pour quantifier la rigidité de petits échantillons de tissu, en utilisant un ensemble approprié de pinces avec des adapted supports pour les échantillons de tissu et une cellule de charge pour surveiller les forces. Plusieurs approches peuvent être utilisées pour monter un tissu pour les moteurs de plate-forme Baxs; dans ce cas, les inox minutiens insectes broches peuvent accrocher à travers l'ouverture des tissus vasculaires afin d'effectuer des essais de traction (figures 4A-B). En variante, pour les tissus épais sans une ouverture naturelle, des bords de tissus peuvent être soit maintenues en position avec les pinces fixées aux moteurs à bobine mobile ou collés sur les petites lames de verre avec de la colle biologique et attachés aux moteurs avec les pinces. Afin d'effectuer la traction teste une cellule de charge miniature est nécessaire et peut être facilement incorporée sur les moteurs de plate-forme Baxs et sert à mesurer la force agissant sur le tissu pendant un cycle d'étirage (Figure 4C). Comme la plate-forme Baxs est composé de quatre moteurs, l'introduction d'une seconde cellule de charge permet d'effectuer les essais de traction le long de deux directions orthogonales. Cette capacité permet de QUANTIFy la rigidité mécanique d'un tissu unique le long de deux directions perpendiculaires au cours de la même expérience.
Fait important, dans toutes les configurations, les cellules ou des échantillons de tissus d'intérêt sont toujours maintenues dans un bain à température contrôlée qui est accessible à l'utilisateur. Cette capacité permet l'introduction d'agents pharmacologiques échantillon pendant l'étirage, afin d'examiner la réponse temporelle de l'échantillon. De plus, comme l'axe optique du microscope inversé reste dégagée, toutes les formes de microscopie sont encore à la disposition de l'utilisateur. Enfin, comme toutes les quatre moteurs de la plate-forme Baxs sont indépendantes, il est possible d'appliquer des champs de déformation hautement configurables à l'échantillon d'intérêt. Dans des cellules et des tissus in vivo sont exposés au complexe et anisotrope étirement qui peut être plus appropriée imité dans cette plate-forme, par opposition à uniaxiale plate-forme d'étirement 7,13,15,18,19 traditionnelle. En outre, les caractéristiques physiquesdu champ de déformation peut être modifié à la volée lors d'une expérience. Ces capacités permettent à l'utilisateur d'examiner la réponse cellulaire et tissulaire à niveau d'un grand nombre de très complexe, anisotrope, temporellement et spatialement divers champs de déformation. Cet article décrit les avantages et les limites de la plate-forme Baxs ainsi que sa conception, les principes de fonctionnement et les détails expérimentaux pour une seule cellule et expériences de tissus entiers.

Figure 1. Vue d'ensemble de la plate-forme Baxs. A) Vue du haut de la plate-forme Baxs montrant les quatre moteurs à bobine mobile. B) de l'image détaillée de la boîte de chauffage Petri utilisé pour maintenir les cellules et les tissus à 37 ° C. C) La plate-forme peut être monté sur un microscope inversé à effectuer en direct imagerie cellulaire lors des expériences étirement.D) image détaillée du moteur à bobine mobile; la partie mobile de la plate-forme. E) image détaillée de la phase de positionnement linéaire permettant le déplacement vertical des systèmes de serrage. F) d'image détaillée de l'encodeur optique qui fournit la position en temps réel du moteur au contrôleur de mouvement G) de l'image détaillée. de la commande de mouvement montrant les quatre entrées du codeur optique et des sorties de puissance pour les quatre moteurs à bobine mobile.
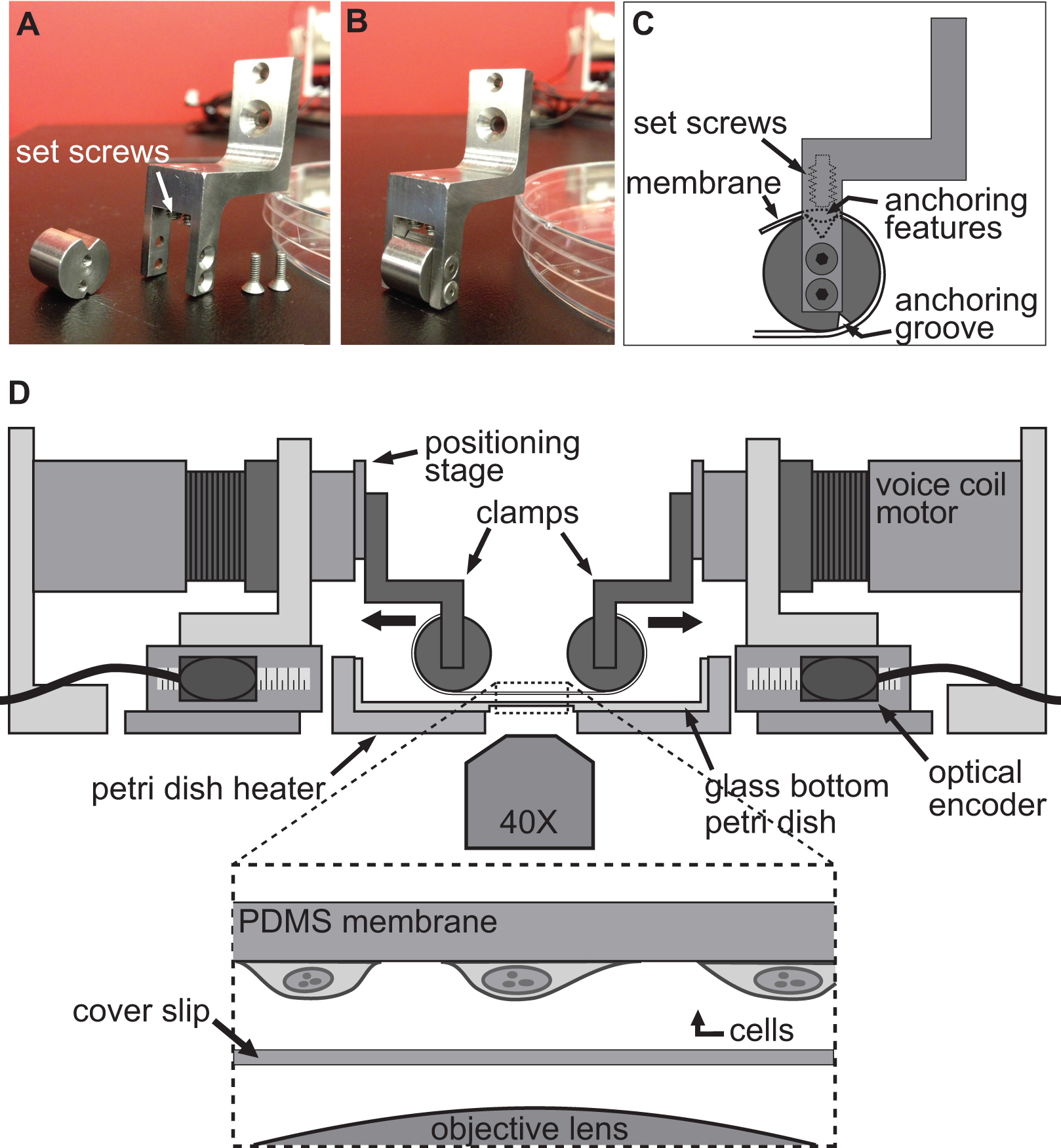
Figure 2. Système de serrage pour les expériences étirement des cellules. AB) Les photos montrant les détails des pinces servant à fixer le substrat de PDMS pour des moteurs à bobine mobile pour l'étirage. C) Le substrat est enroulé autour de la partie cylindrique de la bride d'ancrage avec son features assis dans la rainure en haut. Ensuite, le substrat est fixé à l'aide des vis de fixation qui poussent le substrat / ancrage fonctionnalités dans la rainure supérieure. D) Illustration de la plate-forme Baxs avec les pinces maintenir le substrat en place. L'encart montre une vue de détail du substrat de cellules attachées à elle repose juste au-dessus d'une lamelle couvre-objet et l'objectif de microscope.
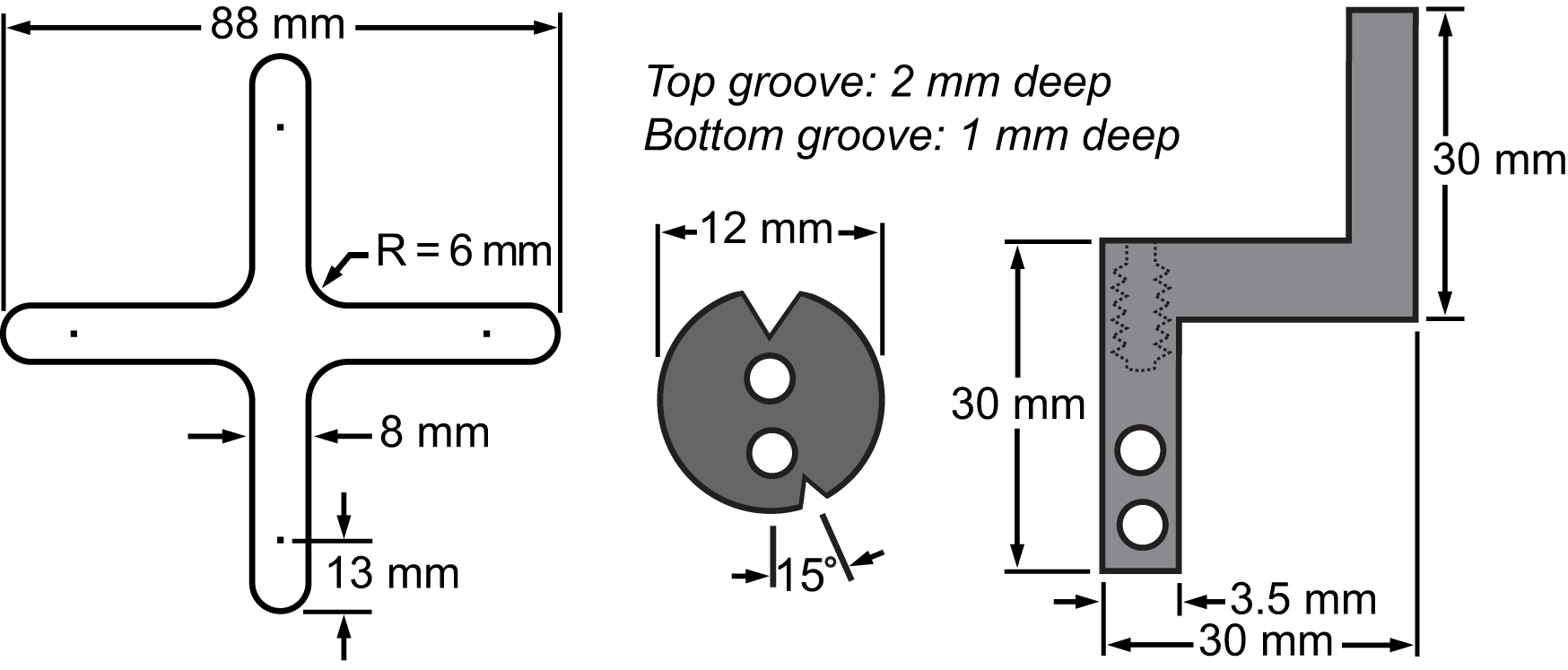
Figure 3. Projet de loi de matériaux de la membrane et son système de serrage. Dessins indiquant les dimensions des pièces principales intégrées à la plate-forme bi-axial pour effectuer des expériences étirement des cellules.
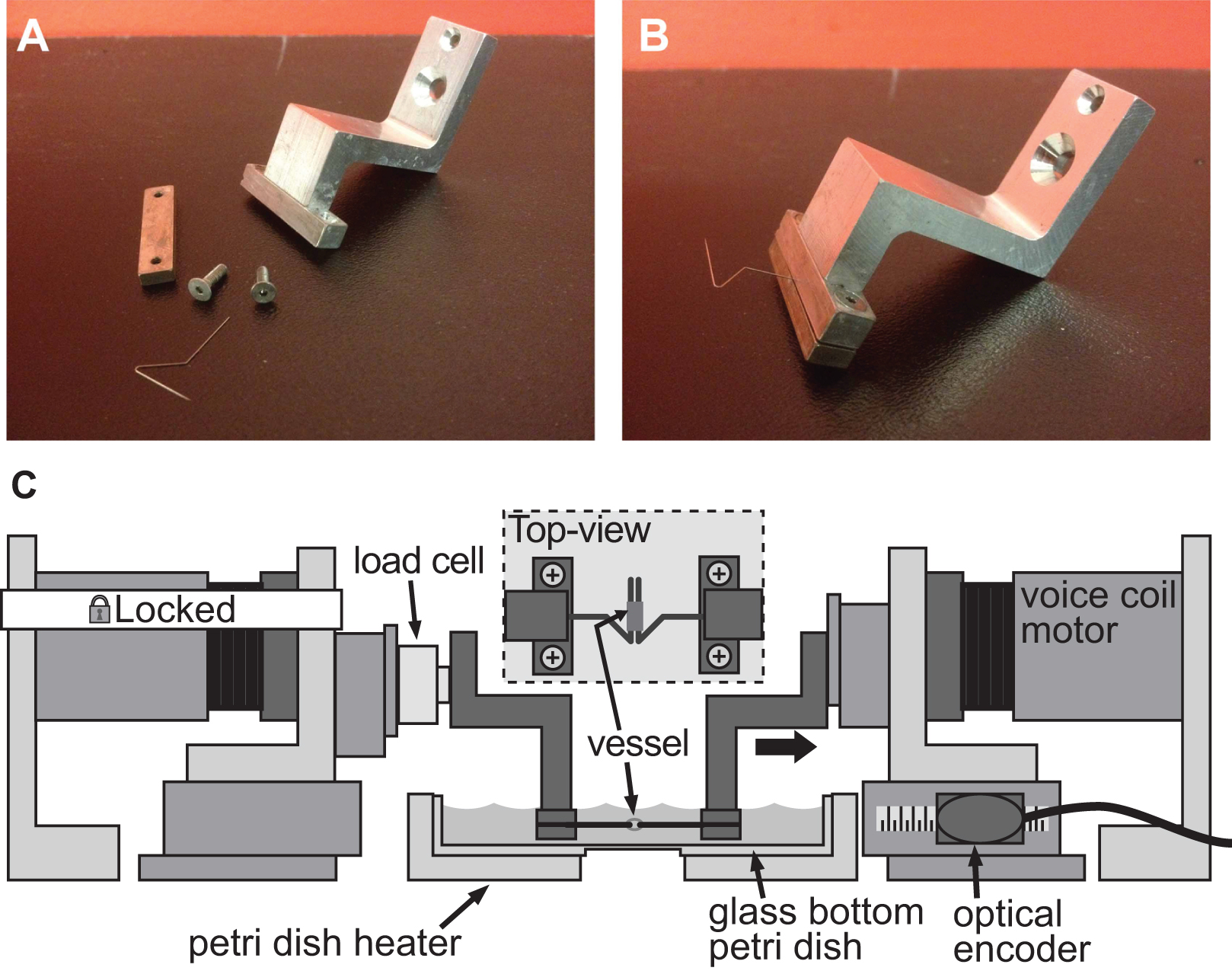
Figure 4. Exsuffisamment d'un système de serrage pour l'évaluation de la rigidité des petits vaisseaux de gros calibre. AB) des images détaillées de l'ensemble de serrage utilisé pour induire une déformation dans une aorte mm diamètre de la souris. Goupilles en acier inoxydable ont été soigneusement façonnés en triangles ouverts pour permettre au navire de coulisser sur les deux broches. C) Illustration de la plate-forme Baxs avec les pinces de fixation du récipient et une cellule de charge fixée entre le moteur et la bride fixe gauche. L'encart montre une vue de dessus détaillée du navire monté sur les broches.
Protocol
Representative Results
Discussion
La plate-forme Baxs présenté ici facilite de nombreuses expériences dans l'étude de mécanobiologie, des enquêtes de cellules individuelles dans les tissus entiers. En outre, la plate-forme est très flexible et configurable, permettant ainsi à de nombreuses expériences de stimulation mécanique et les essais de traction multi-axiale. La plate-forme permet en outre le maintien des cellules et des tissus dans des conditions physiologiques et permet une microscopie simultanée au cours d'expériences d'…
Divulgations
The authors have nothing to disclose.
Acknowledgements
DT a été soutenue par une bourse de recherche postdoctorale de Le Fonds de recherche du Québec-Nature et Technologies (FQRNT) et un MITACS Elevate bourse stratégique. CMC a été soutenue par une bourse postdoctorale du Fonds le de Recherche en Santé du Québec (FRSQ) et Ernest et Margaret Ford cardiologie doté bourse de recherche de l'Université de l'Institut de cardiologie d'Ottawa. EOB a été soutenu par des subventions d'exploitation MOP80204 de l'Institut canadien de recherche en santé du Canada (IRSC) et T6335 de la Fondation des maladies de l'Ontario. Les IRSC et Medtronic fournissent collectivement EOB avec une chaire de recherche évaluées par les pairs (URC # 57093). AEP est financé par les sciences naturelles et en génie (CRSNG) subvention à la découverte, un supplément CRSNG Discovery Accelerator et reconnaît avec gratitude le soutien des chaires de recherche du Canada (CRC) et une bourse de nouveau chercheur de la province de l'Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

