Una piattaforma Novel Stretching per applicazioni in cellule e tessuti mechanobiology
Summary
Presentiamo in questo articolo un romanzo stiramento piattaforma che può essere usato per studiare le risposte delle cellule singole a complessi anisotropo deformazione meccanica biassiale e quantificare le proprietà meccaniche dei tessuti biologici.
Abstract
Strumenti che consentono l'applicazione di forze meccaniche alle cellule e tessuti o che possono quantificare le proprietà meccaniche dei tessuti biologici hanno contribuito notevolmente alla comprensione della mechanobiology base. Queste tecniche sono stati ampiamente utilizzati per dimostrare come l'insorgenza e la progressione di diverse malattie sono fortemente influenzati da stimoli meccanici. Questo articolo presenta un allungamento biassiale (BAXS) piattaforma multi-funzionale che può sia stimolare meccanicamente le cellule singole o quantificare la rigidità meccanica dei tessuti. La piattaforma BAXS consiste di quattro motori voice coil che possono essere controllati in modo indipendente. Singole cellule possono essere coltivate su un substrato flessibile che può essere collegato ai motori permettendo di esporre le cellule a campi di deformazione complessi, dinamici e spazialmente variabili. Viceversa, incorporando una cella di carico forza, si può anche quantificare le proprietà meccaniche dei tessuti primari come sono esposti a cicli di deformazione.In entrambi i casi, un adeguato sistema di aggancio deve essere progettato e montato ai motori piattaforma BAXS per trattenere saldamente il substrato flessibile o tessuto di interesse. La piattaforma BAXS può essere montato su un microscopio invertito effettuare simultanea luce trasmessa e / o fluorescenza per esaminare la risposta strutturale o biochimica del campione durante gli esperimenti di stretching. Questo articolo fornisce dettagli sperimentali di progettazione e l'utilizzo della piattaforma BAXS e presenta risultati per singola cella e gli studi di tutto il tessuto. La piattaforma BAXS stato usato per misurare la deformazione di nuclei in cellule singole topo mioblasti in risposta al substrato ceppo e per misurare la rigidità di isolato aorte topo. La piattaforma BAXS è uno strumento versatile che può essere combinato con vari microscopia ottica al fine di fornire nuovi approfondimenti mechanobiological ai livelli tissutali sub-cellulari, cellulari e complesso.
Introduction
Il microambiente meccanica svolge un ruolo importante in molte funzioni cellulari come la proliferazione, migrazione e differenziazione, che hanno un profondo impatto nello sviluppo e omeostasi dei tessuti e anche in malattie 1-6. Nel corso degli anni, una moltitudine di strumenti sperimentali sono stati utilizzati per stimolare meccanicamente cellule o tessuti e misurare le proprietà meccaniche dei tessuti biologici con l'obiettivo di aumentare la nostra comprensione di mechanobiology base e studiando l'insorgenza e la progressione delle malattie 6-17. Tuttavia, si deve spesso basarsi su varie differenti dispositivi sperimentali per conseguire gli obiettivi di un particolare studio. Questo articolo presenta un unico multi-funzionale, allungamento biassiale (BAXS) piattaforma, che consente per gli studi che indagano il ruolo che le proprietà meccaniche e le forze meccaniche giocano in biologia a livello sub-cellulare per intere scale di lunghezza del tessuto. La piattaforma BAXS permette non solo per la quantification delle proprietà meccaniche dei tessuti isolati, ma agevola anche la capacità di applicare campi di deformazione semplici, complessi e dinamici di cellule viventi per capire le loro risposte a deformazione che si verifica in vivo. La piattaforma BAXS mantiene anche la capacità di eseguire la microscopia live-cell durante le prove meccaniche e perturbazioni sulle cellule e tessuti.
La piattaforma BAXS è un apparecchio su misura che può essere usato per studiare l'effetto di substrato deformazione a livello cellulare ed eseguire prove di trazione sui tessuti biologici (Figura 1A). Un riscaldatore di alluminio è stato fabbricato per accogliere un piatto 10 cm Petri standard mantenere le soluzioni fisiologiche a 37 ° C utilizzando un regolatore di temperatura e riscaldatori kapton (Figura 1B). Questa piattaforma BAXS può essere integrato su un contrasto di fase invertita e / o microscopio a fluorescenza e permette l'imaging simultaneo (Figura 1C).In breve, la piattaforma BAXS consiste di quattro motori voice coil lineari i cui movimenti sono montati su sfere in miniatura movimento lineare guide a orientate lungo due assi ortogonali (Figura 1D). Una tavola di posizionamento lineare è montato a ciascuno dei quattro motori per consentire il movimento verticale del sistema di bloccaggio che verrà utilizzato (Figura 1E). La posizione di ciascun motore è controllato da un encoder ottico con una risoluzione di 500 nm (Figura 1F). Tutti e quattro i motori sono controllati in modo indipendente con un controller di movimento impiegando encoder ottici per eseguire comandi di movimento (Figura 1G). Un'interfaccia LabVIEW fornisce il pieno controllo della grandezza spostamento, velocità e accelerazione di ciascun motore per generare deformazioni completamente personalizzabile, statica e dinamica, delle cellule o campioni di tessuto.
La tecnica utilizzata per indurre una deformazione in cellule avviene semplicemente allowincellule g di aderire saldamente ad un substrato flessibile e trasparente e poi si estende questo supporto con i quattro motori della piattaforma BAXS. La piattaforma BAXS permette il montaggio di un set custom-designed di morsetti per il fissaggio del supporto sui motori voice coil. A questo scopo, abbiamo progettato una serie di morsetti per cui un substrato flessibile e trasparente, fatta di polidimetilsilossano (PDMS), può essere fissata (figure 2A-C e Figura 3). Come i morsetti saranno esposti a soluzioni fisiologiche, tutte le parti sono state lavorate da acciaio inossidabile per consentire la sterilizzazione. Questi morsetti sono stati accuratamente progettati per portare il substrato più vicino possibile al microscopio obiettivo di migliorare la qualità dell'immagine riducendo al minimo lo stress sul substrato durante stiramento (Figura 2D).
La stessa piattaforma BAXS può anche essere usato per quantificare la rigidità di piccoli campioni di tessuto, utilizzando un insieme appropriato di pinze con adattatoreTED supporti per i campioni di tessuto e una cella di carico per controllare le forze. Diversi approcci possono essere adottate per montare un tessuto ai motori piattaforma BAXS; in questo caso l'acciaio inossidabile minutiens insetti spilli possono agganciare attraverso l'apertura di tessuti vascolari per eseguire prove di trazione (Figure 4A-B). In alternativa, per i tessuti spessi senza apertura naturale, bordi di tessuto può essere tenuto in posizione con i morsetti collegati ai motori voice coil o incollati ai piccoli vetrini con colla biologica e collegati ai motori con le pinze. Al fine di effettuare test di trazione è richiesta una cella di carico miniatura e facilmente integrabile sui motori piattaforma BAXS e usato per misurare la forza che agisce sul tessuto durante un ciclo stiramento (Figura 4C). Mentre la piattaforma BAXS è composta di quattro motori, l'introduzione di una seconda cella di carico permette di eseguire prove di trazione lungo due direzioni ortogonali. Questa capacità consente di quantify la rigidità meccanica di un singolo tessuto lungo due direzioni perpendicolari durante lo stesso esperimento.
È importante sottolineare che, in tutte le configurazioni, le cellule o campioni di tessuto di interesse sono sempre mantenuti in un bagno a temperatura controllata che è accessibile all'utente. Questa capacità consente l'introduzione di agenti farmacologici durante campione estende per esaminare la risposta temporale del campione. Inoltre, come l'asse ottico del microscopio invertito rimane libera, tutte le forme di microscopia sono ancora disponibili per l'utente. Infine, come tutti i quattro motori della piattaforma BAXS sono indipendenti è possibile applicare campi di deformazione altamente configurabili al campione di interesse. In vivo cellule e tessuti sono esposti a complessi e anisotropo stiramento che può essere più appropriatamente imitato in questa piattaforma rispetto tradizionali monoassiale allungamento piattaforma 7,13,15,18,19. Inoltre, le caratteristiche fisichedel campo di deformazione può essere modificato al volo durante un esperimento. Queste capacità consentono all'utente di esaminare la risposta cellulare e tissutale livello ad un ampio numero di elevata complessità, anisotropo, temporalmente, e campi di deformazione spazialmente variabili. Questo articolo descrive i vantaggi e le limitazioni della piattaforma BAXS così come il suo design, principi di funzionamento, ed i dettagli sperimentali per singola cella e gli esperimenti dei tessuti interi.

Figura 1. Panoramica della piattaforma BAXS. A) Vista dall'alto della piattaforma BAXS che mostra i quattro motori voice coil. B) quadro dettagliato del riscaldatore piastra di Petri usato per mantenere le cellule e tessuti a 37 ° C. C) La piattaforma può essere montato su un microscopio invertito per eseguire live- imaging cellulare durante gli esperimenti di stretching.D) Immagine dettagliata del motore bobina; la parte mobile della piattaforma. E) quadro dettagliato della fase di posizionamento lineare che permette lo spostamento verticale dei sistemi di bloccaggio. F) quadro dettagliato del encoder ottico che fornisce la posizione in tempo reale del motore per il controller di movimento. G) Immagine dettagliata del controller di movimento che mostra i quattro ingressi encoder ottici e le uscite di potenza per i quattro motori voice coil.
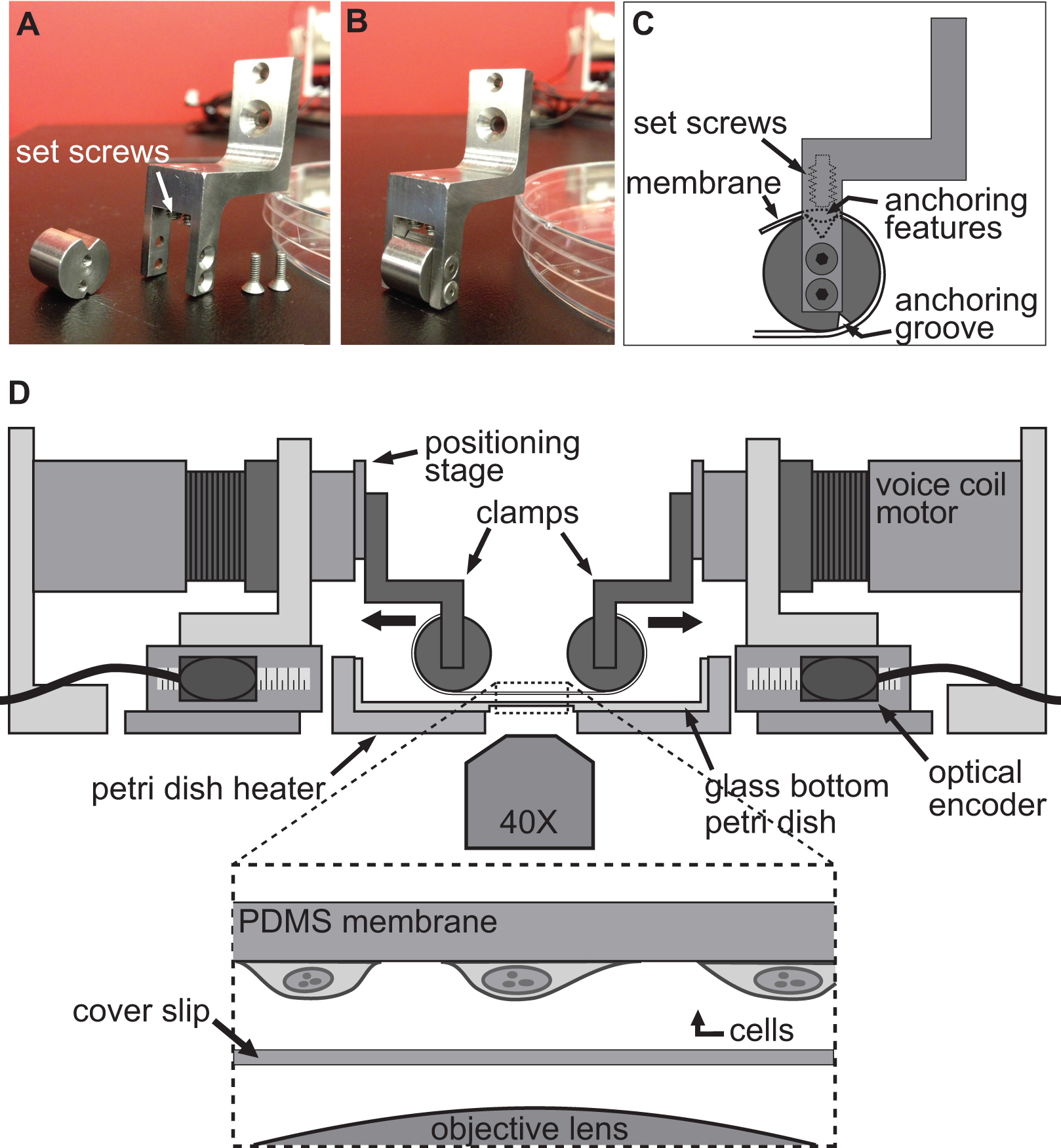
Figura 2. Sistema di bloccaggio per esperimenti sulle cellule stretching. AB) immagini che mostrano i dettagli dei morsetti utilizzati per fissare il substrato PDMS ai motori voice coil per stiramento. C) Il substrato è avvolto attorno alla parte cilindrica del morsetto con la sua featur ancoraggioes seduto nella scanalatura in alto. Poi il substrato è fissato con le viti che spingono il substrato / ancoraggio caratteristiche nella scanalatura superiore. D) Illustrazione della piattaforma BAXS con i morsetti tenendo il substrato in posto. L'inserto mostra una vista dettagliata del substrato con cellule attaccate ad esso seduto sopra un vetrino e l'obiettivo microscopio.
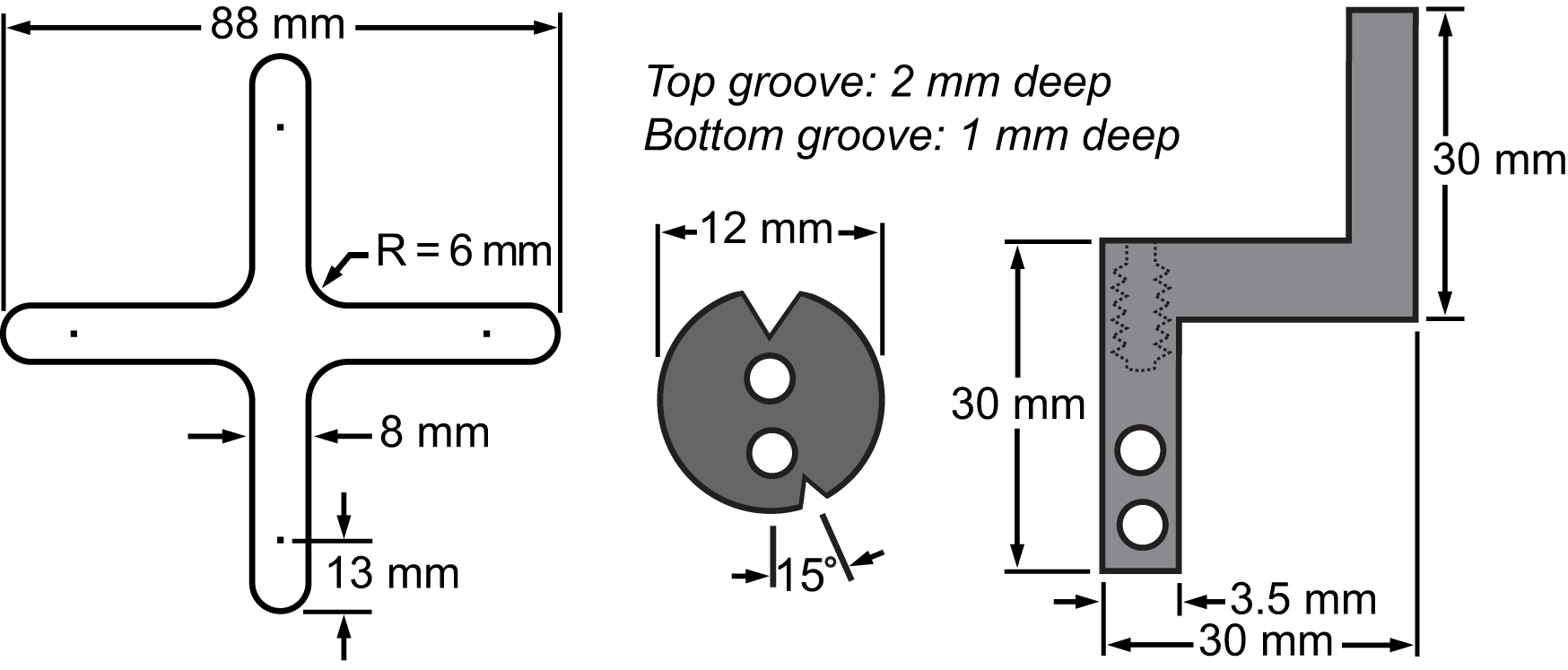
Figura 3. Distinte dei materiali della membrana e del suo sistema di bloccaggio. Disegni con le dimensioni delle parti principali integrati alla piattaforma biassiale effettuare esperimenti sulle cellule stretching.
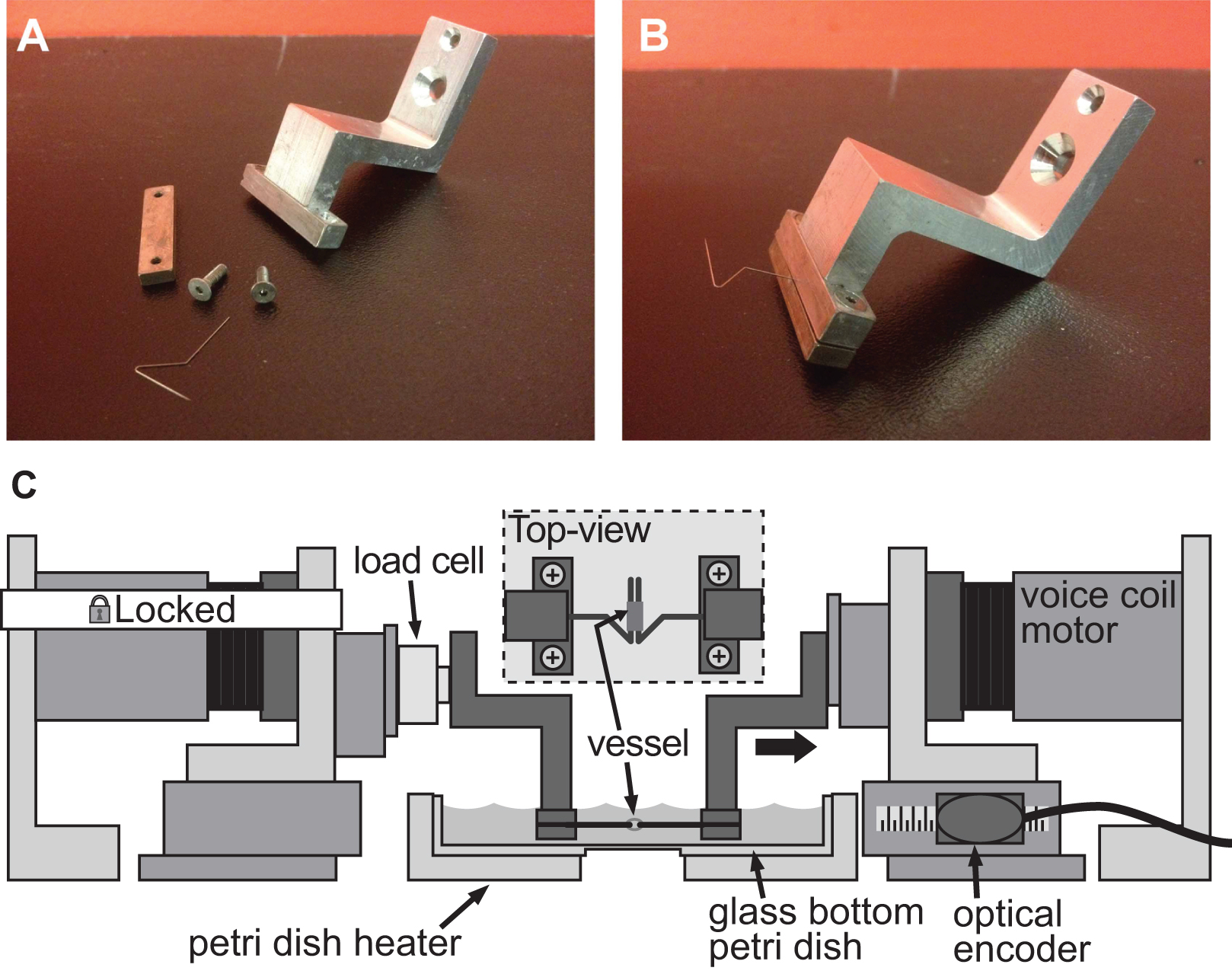
Figura 4. Exampio di un sistema di bloccaggio per valutare la rigidità di vasi di piccolo calibro. AB) Quadri dettagliati del dispositivo di fissaggio utilizzato per indurre la deformazione in una aorta topo diametro di 1 mm. Spilli di acciaio inossidabile sono stati accuratamente modellate in triangoli aperti per permettere alla nave di scivolare su entrambi i pin. C) Illustrazione della piattaforma BAXS con i morsetti mantenere la nave e una cella di carico divisoria tra motore fisso e il morsetto sinistro. L'inserto mostra una vista dall'alto dettagliata della nave montato sui perni.
Protocol
Representative Results
Discussion
La piattaforma BAXS qui presentato facilita numerosi esperimenti nello studio di mechanobiology, dalle indagini di singole cellule ai tessuti interi. Inoltre, la piattaforma è altamente flessibile e configurabile, consentendo numerosi esperimenti di stimolazione meccanici e prove di trazione multiassiale. La piattaforma consente anche la manutenzione di cellule e tessuti in condizioni fisiologiche e permette di microscopia simultanea durante gli esperimenti di stretching. I due esperimenti descritti nelle sezioni prece…
Divulgations
The authors have nothing to disclose.
Acknowledgements
DT è stato sostenuto da una borsa di studio post-dottorato da Le Fonds de Recherche du Québec-Natura et Technologies (FQRNT) e ha una MITACS Elevate strategico Fellowship. CMC è stato sostenuto da una borsa di studio post-dottorato da Le Fonds de Recherche en Santé du Québec (FRSQ) e Ernest e Margaret Ford cardiologia dotato ricerca borsa di studio presso l'Università di Ottawa Heart Institute. EOB è stato sostenuto da sovvenzioni di funzionamento MOP80204 dal Canadian Institute for Health Research (CIHR) e T6335 dalla Heart and Stroke Foundation of Ontario. Il CIHR e Medtronic collettivamente forniscono EOB con una sedia di ricerca peer-reviewed (URC # 57093). AEP è finanziato dalle scienze naturali e ingegneria Research Council (NSERC) Discovery Grant, un supplemento NSERC Discovery Accelerator e riconosce con gratitudine il sostegno dei presidenti di ricerca Canada (CRC) del programma e di un ricercatore Award anticipata dalla Provincia dell'Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

