פלטפורמה חדשני מתיחה עבור יישומים בתאים והרקמות mechanobiology
Summary
אנו מציגים במאמר זה פלטפורמה חדשני מתיחה שיכול לשמש כדי לחקור את תגובות תא בודדות לעיוות מכאנית biaxial איזוטרופי מורכב ולכמת את התכונות מכאניות של רקמות ביולוגיות.
Abstract
כלים המאפשרים היישום של כוחות מכאניים לתאים ורקמות או שיכולים לכמת את התכונות מכאניות של רקמות ביולוגיות תרמו באופן משמעותי להבנה של mechanobiology הבסיסי. טכניקות אלה היו בשימוש נרחב על מנת להדגים כיצד התפרצות וההתקדמות של מחלות שונות מושפעות במידה רבה על ידי רמזים מכאניים. מאמר זה מציג פלטפורמת biaxial רב תפקודית מתיחה (BAXS) שגם יכול מכניים לעורר תאים בודדים או לכמת את הנוקשות מכאניות של רקמות. פלטפורמת BAXS מורכבת מארבעה מנועים סליל קול שניתן לשלוט באופן עצמאי. יכולים להיות מתורבת תאים בודדים על מצע גמיש שיכול להיות מחובר למנועים המאפשרים אחד כדי לחשוף את התאים לשדות זן מורכבים, דינמיים, ומרחבית שונה. לעומת זאת, על ידי שילוב של תא כוח עומס, אפשר גם לכמת את התכונות מכאניות של רקמות עיקריות כפי שהם נחשפים למחזורי עיוות.בשני המקרים, סט נכון של מלחציים חייב להיות מתוכנן ורכוב על מנועים פלטפורמת BAXS כדי להחזיק את המצע גמיש או הרקמות של עניין בתוקף. פלטפורמת BAXS יכולה להיות מותקנת על מיקרוסקופ הפוכה לבצע אור מסור בו זמנית ו / או דימות פלואורסצנטי כדי לבחון את התגובה המבנית או ביוכימי של המדגם במהלך ניסויי מתיחה. מאמר זה מספק פרטים ניסיוניים של העיצוב ושימוש בפלטפורמת BAXS ומציג תוצאות עבור תא בודד ומחקרי רקמה כולה. פלטפורמת BAXS שימשה למדידת העיוות של גרעינים בתאים והיצמדות למנגנון עכבר אחת בתגובה למצע מתח ולמדוד את הנוקשות של aortas עכבר הבודד. פלטפורמת BAXS היא כלי תכליתי שיכול להיות משולב עם microscopies האופטי השונים על מנת לספק תובנות mechanobiological רומן ברמות המשנה הסלולר, סלולארי וכל הרקמות.
Introduction
Microenvironment המכני משחק תפקיד חשוב בפונקציות רבות תא, כגון התפשטות, הגירה, ובידול, שיש לו השפעה עמוקה בפיתוח והומאוסטזיס של רקמות וגם במחלות 1-6. במהלך השנים, מספר רב של כלים ניסיוניים כבר בשימוש כדי לעורר מכאני תאים או רקמות ולמדוד תכונות מכאניות של רקמות ביולוגיות, במטרה להגביר את ההבנה של mechanobiology הבסיסי שלנו ולומד את תחילת התקדמות של מחלות 6-17. עם זאת, יש לעתים קרובות מסתמך על מספר התקני ניסויים שונים על מנת להשיג את מטרותיו של מחקר מסוים. מאמר זה מציג פלטפורמה אחת, רב תפקודית, biaxial מתיחה (BAXS) המאפשרת למחקרים הבודקים את התפקיד שתכונות מכאניות וכוחות מכאניים לשחק בביולוגיה במשנה הסלולר לסולמות אורך רקמה כולה. פלטפורמת BAXS לא רק מאפשרת לquantification של תכונות מכאניות של רקמות מבודדות, אלא גם מקל על היכולת ליישם את שדות זן פשוטים, מורכבים, ודינמיים לתאי חיים כדי להבין את התגובות שלהם למתיחה המתרחשת בגוף חי. פלטפורמת BAXS גם שומרת על היכולת לבצע מיקרוסקופיה לחיות תאים במהלך בדיקה מכאנית והפרעות בתאים וברקמות.
פלטפורמת BAXS היא מנגנון שהותקן בם ניתן להשתמש כדי לחקור את ההשפעה של עיוות מצע ברמה התאית ולבצע בדיקות מתיחה ברקמות ביולוגיות (איור 1 א). דוד אלומיניום היה מפוברק כדי להכיל מנה 10 ס"מ פטרי סטנדרטי ולתחזק פתרונות פיסיולוגיים כלשהי על 37 מעלות צלזיוס באמצעות בקר טמפרטורה ותנורי Kapton (איור 1). פלטפורמת BAXS זה יכול להיות משולב על גבי לעומת שלב הפוך ו / או מיקרוסקופ פלואורסצנטי ומאפשרת הדמיה בו זמנית (תרשים 1C).בקיצור, פלטפורמת BAXS מורכבת מארבעת מנועים הסליל ליניארי של אשר החלקים הנעים הם רכובים על שקופיות נושאת תנועה ליניארית כדור הזעיר בכיוון לאורך שני צירים מאונכים (1D איור). שלב מיצוב יניארי הוא רכוב לכל אחד מארבעת מנועים, כדי לאפשר תנועה אנכית של מערכת ההידוק שישמש (איור 1E). המיקום של כל מנוע מנוטר על ידי מקודד אופטי עם רזולוציה של 500 ננומטר (איור 1F). כל ארבעה מנועים באופן עצמאי נשלטים עם בקר תנועת העסקת משוב מקודד אופטי כדי לבצע פקודות תנועה (איור 1G). ממשק LabVIEW מספק שליטה מלאה על עוצמת התזוזה, מהירות ותאוצה של כל מנוע על מנת ליצור עיוות לחלוטין להתאמה אישית, סטטית ודינמית, של התאים או דגימות רקמה.
הטכניקה המשמשת כדי לגרום לעיוות בתאים מושגת על ידי פשוט allowinתאים גרם לדבוק בתקיפות למצע גמיש ושקוף ולאחר מכן מתיחות מצע זה באמצעות ארבעה מנועים של פלטפורמת BAXS. פלטפורמת BAXS מאפשרת הרכבה של כל קבוצה מותאמת במיוחד מלחציים לצרף את המצע על מנועים סליל קול. לצורך כך, עיצבנו סט של מהדק שאליו מצע גמיש ושקוף, עשוי polydimethylsiloxane (PDMS), יכול להיות מחובר (איורים 2A-C ו איור 3). כמו מלחציים יהיו חשופים לפתרונות פיסיולוגיים, כל החלקים היו במכונה מנירוסטה כדי לאפשר לעיקור. מלחציים אלה תוכננו בקפידה כדי להביא את המצע הקרוב ככל האפשר למטרת מיקרוסקופ כדי לשפר את איכות תמונה, תוך מזעור הלחץ על המצע במהלך המתיחה (איור 2 ד).
גם אותה פלטפורמת BAXS יכולה לשמש כדי לכמת את הנוקשות של דגימות רקמה קטנות, תוך שימוש בסט מתאים של מלחציים עם ADAPטד תומך לדגימות הרקמה ותא מטען כדי לפקח על כוחות. ניתן לנקוט במספר גישות להר רקמות למנועי פלטפורמת BAXS; במקרה זה סיכות minutiens החרקים הנירוסטה יכולות להתחבר דרך הפתח של רקמות כלי דם על מנת לבצע בדיקות מתיחה (איורים 4 א-B). לחלופין, לרקמות עבות ללא פתיחה טבעית, יכולים להיות שנערכו קצות רקמות בעמדה עם מלחציים מחוברים למנועי סליל קול או דבוקים לשקופיות זכוכית קטנות עם דבק ביולוגי ומחוברים למנועים עם מהדק. על מנת לבצע מתיחה בדיקות תא עומס מיניאטורי נדרש ויכול להיות משולב בקלות על מנועים פלטפורמת BAXS ומשמש למדידת הכוח הפועל על הרקמות במהלך מחזור (איור 4C) מתיחה. כפלטפורמת BAXS מורכבת מארבעה מנועים, את ההקדמה של תא עומס שני מאפשרת לבצע בדיקות מתיחים לאורך שני כיוונים מאונך. יכולת זו מאפשרת לאדם quantify הנוקשות מכאניות של רקמה אחת לאורך שני כיוונים ניצבת במהלך אותו הניסוי.
חשוב לציין, בכל התצורות, התאים או דגימות רקמה של העניין תמיד נשמרו באמבט בטמפרטורה מבוקרת, כי הוא נגיש למשתמש. יכולת זו מאפשרת להקדמה של סוכנים תרופתיים במהלך מדגם מתיחה על מנת לבחון את התגובה הזמנית של המדגם. בנוסף, כציר האופטי של המיקרוסקופ ההפוך נותר בלא הפרעה, כל הצורות של מיקרוסקופיה עדיין זמינות למשתמש. לבסוף, כמו בכל ארבעת מנועים של פלטפורמת BAXS הם בלתי תלויים זה אפשרי ליישם את שדות זן מאוד להגדרה למדגם של עניין. בvivo תאים ורקמות חשופים למורכב ואיזוטרופי מתיחה שיכולה להיות הולם יותר חיקה בפלטפורמה זו בניגוד ל7,13,15,18,19 uniaxial מסורתי מתיחת פלטפורמה. יתר על כן, מאפיינים הפיזייםשל שדה המתח ניתן לשנות על לטוס במהלך ניסוי. יכולות אלו מאפשרות למשתמש לבחון את התגובה התאית ורקמות ברמה למספר רחב של המורכב ביותר, איזוטרופי, באופן זמני, ושדות מתח מרחבית שונים. מאמר זה מתאר את היתרונות ומגבלות של פלטפורמת BAXS כמו גם העיצוב שלו, עקרונות פעולה, ואת פרטי ניסיוני לתא בודד וניסויים רקמה כולה.

איור 1. סקירה כללית של פלטפורמת BAXS. א) להציג לראש פלטפורמת BAXS מראה את ארבעת מנועים סליל קול. ב ') תמונה מפורטת של דוד צלחת פטרי משמש כדי לשמור על תאים ורקמות ב37 ° C. C) הפלטפורמה יכולה להיות מותקנת על מיקרוסקופ הפוכה לבצע-live הדמיה תא במהלך ניסויי מתיחה.ד) תמונה מפורטת של מנוע סליל קול; תמונת החלק הנע של הפלטפורמה. ה) מפורטת של שלב המיקום ליניארי ומאפשר תזוזה אנכית של מערכות הידוק תמונה מפורטת. F) של המקודד האופטי המספק עמדה של המנוע בזמן אמת לבקר התנועה.) תמונה מפורטת G של בקר התנועה המראה את ארבע כניסות מקודד אופטיות ותפוקות כוח לארבעה מנועים סליל קול.
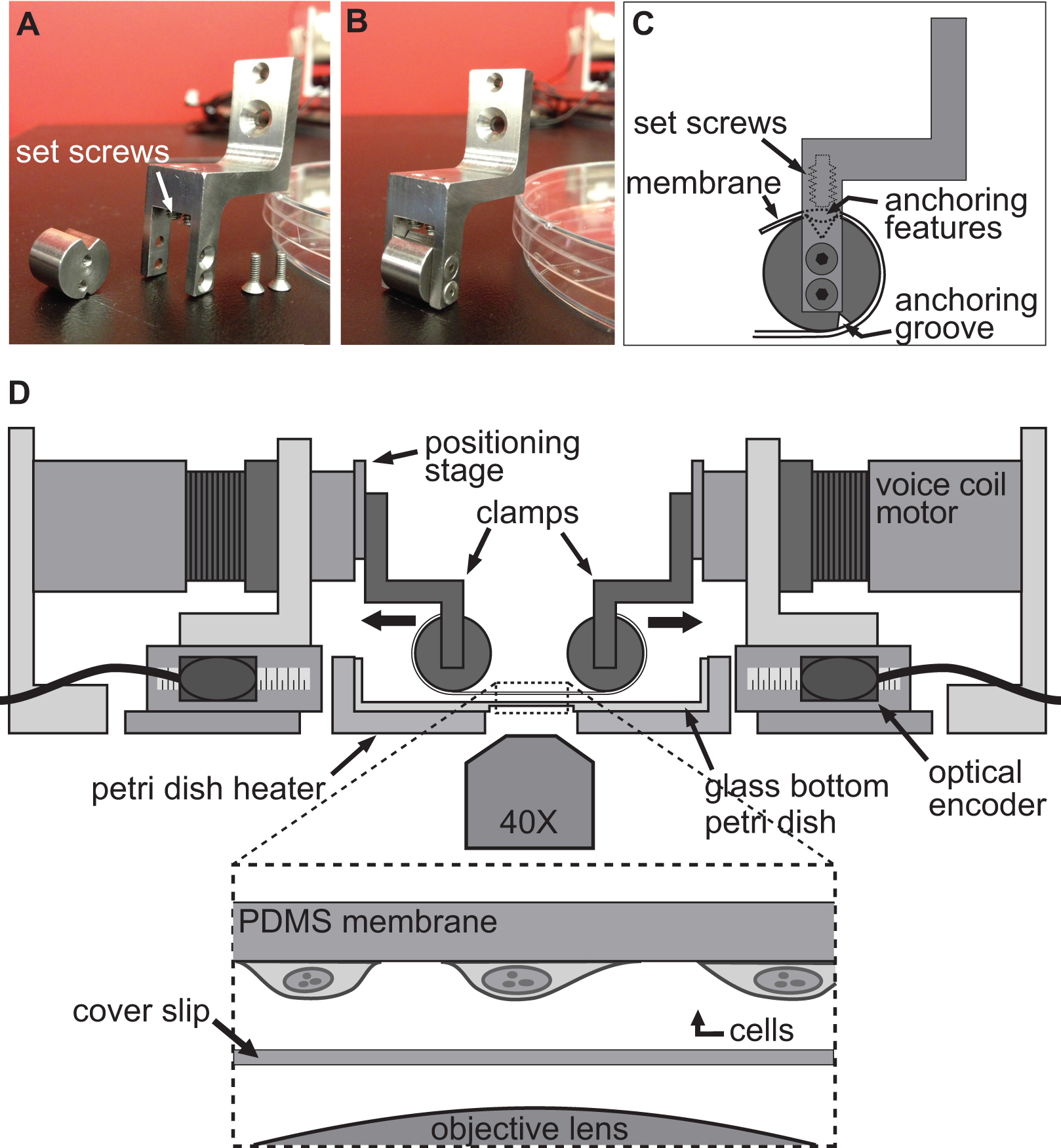
איור 2. הידוק מערכת לניסויי תא מתיחה. תמונות א.ב.) מציגים את הפרטים של מלחציים משמשים לצרף את מצע PDMS למנועי סליל קול למתיחה. C) המצע כרוך סביב החלק הגלילי של המהדק עם featur עיגונהes יושב לתוך החריץ בחלק העליון. אז המצע הוא מאובטח באמצעות setscrews כי לדחוף את המצע / עיגון תכונות לתוך החריץ העליון. D איור) של פלטפורמת BAXS עם מלחציים מחזיקים המצע במקום. הבלעה מראה תצוגה מפורטת של המצע עם התאים קשורים אליו יושבים בדיוק מעל להחליק את מכסה ואובייקטיבי מיקרוסקופ.
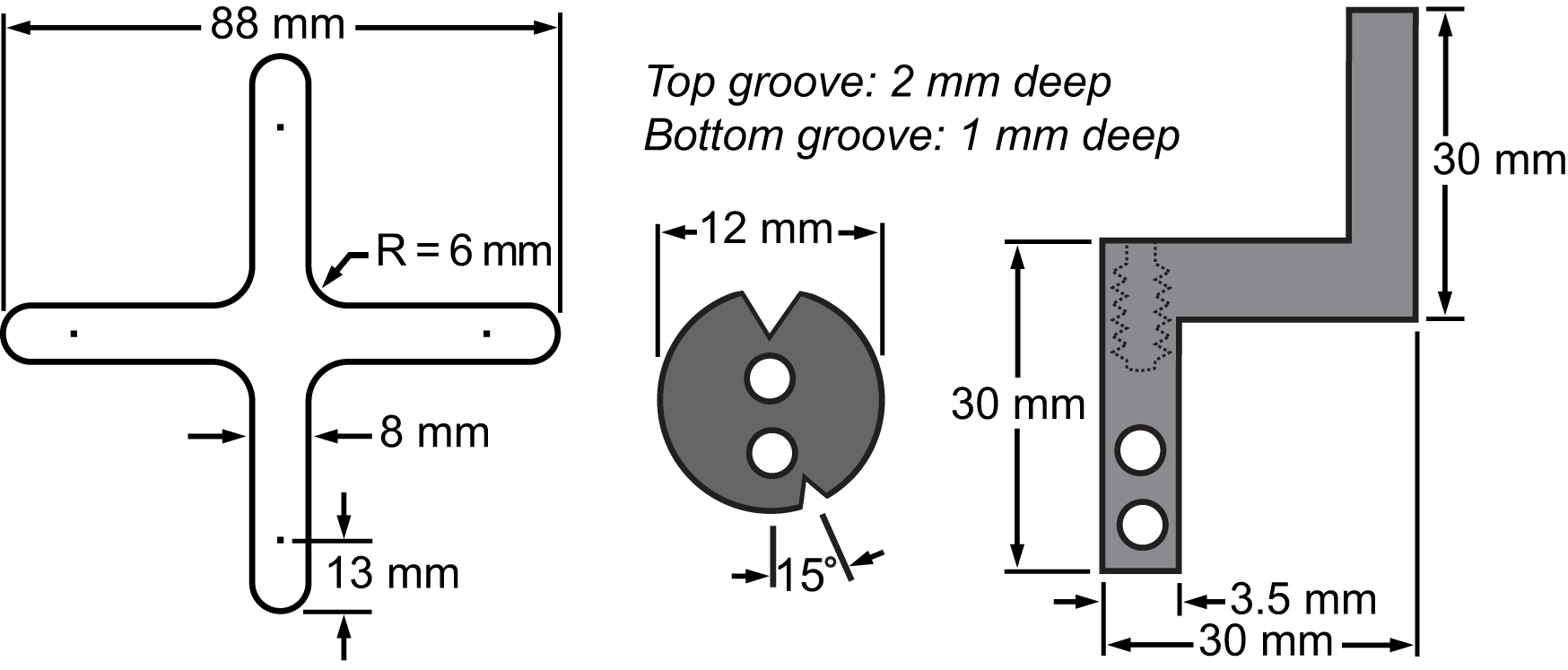
איור 3. ביל של חומרים של מערכת ההידוק שלה הקרום ו. שרטוטים מראים את הממדים של החלקים העיקריים משולבים לפלטפורמת biaxial לבצע ניסויי תא מתיחה.
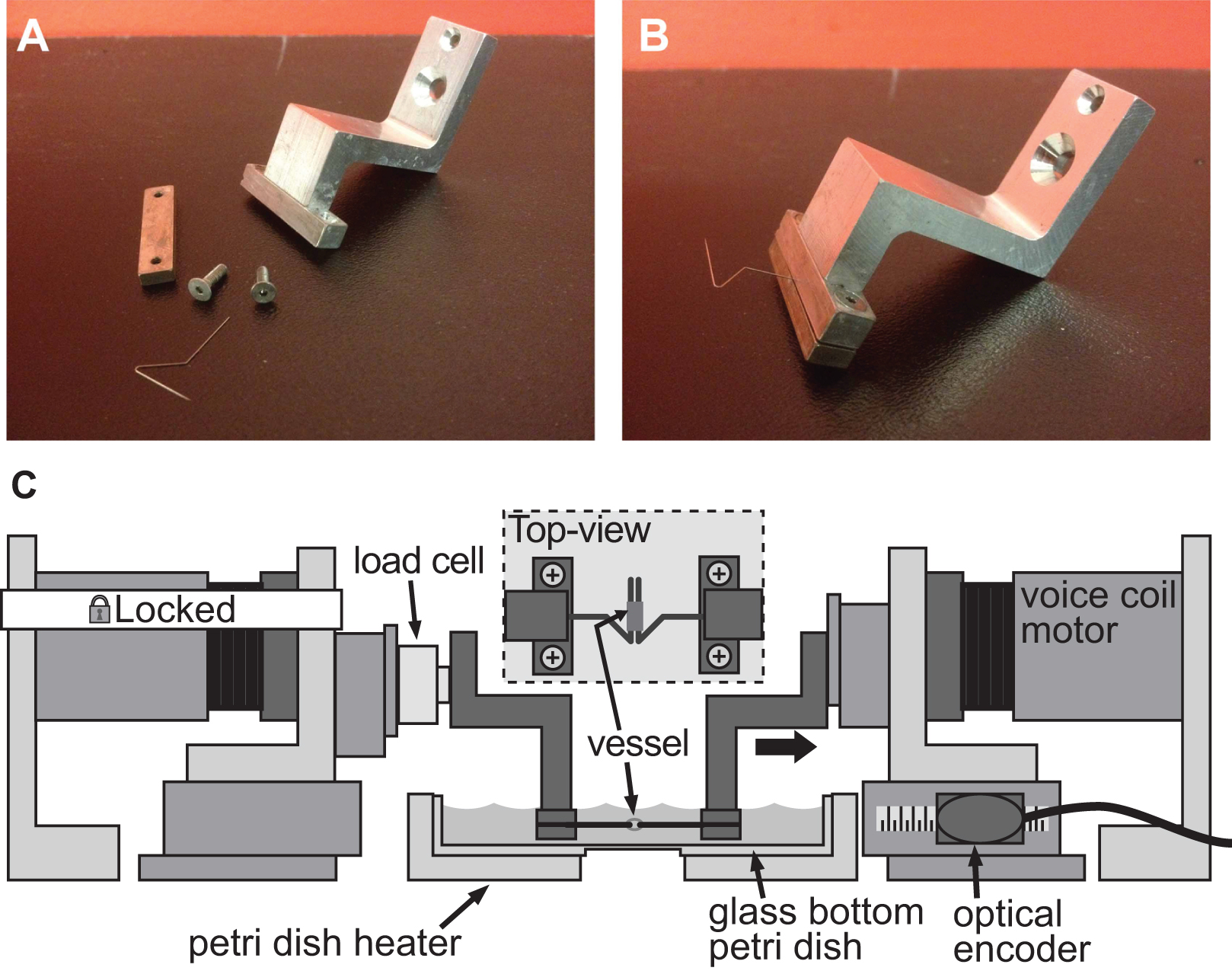
איור 4. אקסשפע של מערכת הידוק להערכת נוקשות של כלי קליבר קטנים תמונות מפורטות. א.ב.) של מערכת הידוק שימוש כדי לגרום לעיוות באב העורקים עכבר בקוטר 1 מ"מ. סיכות נירוסטה עוצבו בקפידה למשולשים פתוחים על מנת לאפשר את הכלי כדי להחליק על שני סיכות איור. C) של פלטפורמת BAXS עם מלחציים מחזיקים את הכלי ותא עומס המחובר בין המנוע הקבוע ומהדק את השמאל. הבלעה מראה עליונה תצוגה מפורטת של הכלי רכוב על הסיכות.
Protocol
Representative Results
Discussion
פלטפורמת BAXS שהוצגה כאן מאפשרת מספר רב של ניסויים בחקר mechanobiology, מחקירות של תאים בודדים לכל רקמות. בנוסף, הפלטפורמה גמישה מאוד להגדרה, ומאפשרת למספר רב של ניסויים מכאניים גירוי ובדיקת מתיחה רב צירית. הפלטפורמה מאפשרת גם התחזוקה של תאים ורקמות בתנאים פיסיולוגיים ומאפשר…
Divulgations
The authors have nothing to disclose.
Acknowledgements
DT נתמכה על ידי מלגת לימודים פוסט דוקטורט מle Fonds דה משוכלל ונדיר du Québec-Nature et טכנולוגיות (FQRNT) וMITACS לרומם אסטרטגית מלגה. CMC נתמכה על ידי מלגת לימודים פוסט דוקטורט מle Fonds דה משוכלל ונדיר en סנטה du קוויבק (FRSQ) וארנסט ומענק מחקר קרדיולוגיה ניחן מרגרט פורד מאוניברסיטת אוטווה לב המכון. EOB נתמכה על ידי MOP80204 הפעלת מענקים מהמכון הקנדי לבריאות מחקר (CIHR) וT6335 מהלב ושבץ קרן של אונטריו. CIHR ומדטרוניק לספק קולקטיבי EOB עם מחקר קתדרת ביקורת עמיתים (URC # 57,093). AEP ממומן על ידי למדעי הטבע והנדסת מועצת המחקר (NSERC) דיסקברי גרנט, מוסף NSERC Discovery Accelerator והכרת תודה מכיר את תמיכתם של כיסאות קנדה מחקר תכנית (CRC) ופרס חוקר מוקדם ממחוז אונטריו.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

