من السريع إلى التصوير الإسفار الجزيئية قانون إنتشار على أغشية الخلايا الحية في المجهر التجاري
Summary
Spatial distribution and temporal dynamics of plasma membrane proteins and lipids is a hot topic in biology. Here this issue is addressed by a spatio-temporal image fluctuation analysis that provides conceptually the same physical quantities of single particle tracking, but it uses small molecular labels and standard microscopy setups.
Abstract
أصبح من الواضح بشكل متزايد أن التوزيع المكاني وحركة مكونات غشاء مثل الدهون والبروتينات هي عوامل أساسية في تنظيم العديد من الوظائف الخلوية. ولكن نظرا لديناميكية سريعة وهياكل صغيرة المعنية، مطلوب قرار المكانية والزمانية عالية جدا للقبض على السلوك الحقيقي من الجزيئات. هنا نقدم بروتوكول تجريبي لدراسة ديناميات البروتينات والدهون البلازما غشاء fluorescently المسمى في الخلايا الحية لقرار الزمانية المكانية عالية. والجدير بالذكر، لا يحتاج هذا النهج لتتبع كل جزيء، لكنه يحسب سلوك السكان الذين يستخدمون جميع الجزيئات في منطقة معينة من الغشاء. نقطة البداية هي التصوير السريع في منطقة ما على غشاء. بعد ذلك، يتم احتساب المكانية والزمانية وظيفة كاملة الارتباط الذاتي ربط الصور المكتسبة في زيادة تأخير الوقت، على سبيل المثال كل 2، 3، ن التكرار. فمن الممكن إثبات أن العرضمن ذروة المكانية زيادات ظيفة الارتباط الذاتي في زيادة تأخير الوقت بوصفها وظيفة من حركة الجسيمات بسبب نشر. لذا، من المناسب من سلسلة من الوظائف تمكن الارتباط الذاتي لاستخراج البروتين الفعلي يعني تشريد مربع من التصوير (iMSD)، قدم هنا في شكل واضح انتشارية مقابل متوسط النزوح. هذه تعطي الرأي الكمي من متوسط ديناميكية الجزيئات واحدة مع دقة نانومتر. باستخدام متغير GFP الموسومة من مستقبلات ترانسفيرين (TFR) وATTO488 المسمى 1-بالميتويل-2-هيدروكسي SN -glycero-3-phosphoethanolamine (PPE) فمن الممكن لمراقبة تنظيم الزماني المكاني للبروتين والدهون نشر على المناطق غشاء ميكرون الحجم في نطاق الوقت الجزئي لملي ثانية.
Introduction
بدءا من النموذج الأصلي "فسيفساء السائل" حسب المغني ونيكلسون، وصورة من الغشاء البلازمي الخلوي قد تم تحديثه بشكل مستمر خلال العقود الماضية من أجل إدراج دور الناشئة في الهيكل الخلوي والدهون المجالات 1،2.
تم الحصول على الملاحظات الأولى الانتعاش بعد photobleaching من الفلورسنت (FRAP) إزاحة الستار أن جزءا كبيرا من البروتينات الغشاء هو متحرك 3-5. هذه الدراسات الرائدة، على الرغم مفيدة للغاية، عانى من قرار فقيرة نسبيا في الفضاء (ميكرون) والزمن (ثانية) من الاجهزة FRAP. أيضا، ويجري قياس المتوسط الفرقة، FRAP يفتقر في إعطاء معلومات عن سلوك جزيء واحد.
في هذا السياق، وإمكانية لتسمية تحديدا جزيء واحد مع علامات مشرقة جدا (السماح دراسة عملية الانتشار جزيء في وقت واحد) كان ناجحا جدا. بشكل خاص، عن طريق دفعقرار وقت نهج احدة تتبع الجسيمات (SPT) إلى الجدول الزمني ميكروثانية، Kusumi، وآخرون. تمكنت من الوصول إلى ميزات لم تكن معروفة من الدهون والبروتين الديناميات التي أسهمت إلى حد كبير في التعرف على دور القائم على الأكتين هيكل عظمي في غشاء غشاء علم وظائف الأعضاء 6 7. ولدت هذه النتائج ما يسمى في "اعتصام والسور 'النموذج، الذي ينظم الدهون والبروتين نشر بواسطة هيكل عظمي القائم الأكتين. ومع ذلك، من أجل الحصول على كمية هائلة من المعلومات التي قدمتها SPT العديد من القضايا التجريبية لا بد من معالجتها. خاصة، وعادة ما تتألف الإجراء وضع العلامات خطوات كثيرة مثل إنتاج وتنقية وإدخال الأنواع المسمى في النظام. وعلاوة على ذلك، والعلامات الكبيرة، مثل نقاط الكم أو الجسيمات النانوية المعدنية، وغالبا ما يطلب للوصول إلى الجدول الزمني ميلي ثانية واحدة فرعية ويشابك من الجزيئات المستهدفة من قبل التسمية لا يمكن تجنبها في كثير من الحالات. أخيرا، العديد من مساراتوقد ليتم تسجيلها لتناسب المعايير الإحصائية وبصورة متزامنة مطلوب كثافة منخفضة التسمية للسماح تتبع.
مقارنة SPT، مضان الطيفي الارتباط (FCS)، والتغلب على كثير من هذه السلبيات، يمثل نهجا واعدا جدا لدراسة ديناميات الجزيئية. في الواقع، يعمل FCS جيدا أيضا مع تسميات قاتمة وكثيفة، مما يتيح لدراسة ديناميكية الجزيئات الموسومة بروتين فلوري في خلايا عابر. أيضا، فإنه يتيح الوصول إلى إحصاءات عالية في كمية محدودة من الزمن. وأخيرا، على الرغم من "عالية" كثافة العلامات يوفر معلومات FCS الجزيئات واحدة. بفضل كل هذه الخصائص، FCS يمثل نهجا واضحة جدا وطبقت على نطاق واسع لدراسة الدهون والبروتين ديناميكية في كل من الأغشية ونموذج في الخلايا الحية 8-10. لقد تم اقتراح العديد من الطرق المختلفة لزيادة قدرة FCS للكشف عن تفاصيل الانتشار الجزيئي. على سبيل المثال، كان SHالخاصة التي عن طريق أداء FCS على مختلف المناطق الملاحظة الحجم يمكن لأحد أن تعريف "القانون نشر FCS" ملامح المنير الخفية للحركة الجزيئات 11،12. إضافة إلى كونه تختلف في الحجم، وقد تتكرر مجال التركيز أيضا 13، وانتقل في الفضاء على طول خطوط 14-20 أو مترافق مع الكاميرات سريعة 21،22. باستخدام هذه العلاقة "المكانية والزمانية" النهج، وقد وصفت المعلمات البيولوجية ذات الصلة من عدة مكونات غشاء كميا على كل الأغشية البيولوجية نموذج ومنها الفعلية، وبالتالي البصيرة ذات العوائد إلى غشاء التنظيم المكاني.
ومع ذلك، في كل FRAP والتطبيقات FCS وصفها حتى الآن حجم المنطقة المحورية يمثل الحد في القرار المكانية التي لا يمكن التغلب عليها. وقد وضعت عدة طرق التصوير فائقة الدقة مؤخرا لتجاوز هذا الحد. وتقوم بعض على دقة الترجمة، مثل إعادة الإعمار العشوائية المجهر الضوئي (STORM) <سوب> 23،24، تنشيط ضوئي توطين المجهري (النخيل) 25، PALM مضان (FPALM) 26، واحد الجسيمات تتبع PALM (sptPALM) 27: على كمية كبيرة نسبيا من الفوتونات المطلوبة في كل لقطة، ومع ذلك، يحد القرار وقت هذه الأساليب لعدة ميلي ثانية على الأقل، مما يعيق إمكانية تطبيقها في الجسم الحي.
في المقابل، تم فتح بديلا واعدا للقرار التصوير الفاخر وتحوير مكانيا انبعاث مضان مع طرق استنزاف الانبعاث المستحث (STED أو عكسها تشبع التحولات مضان البصرية (RESOLFT)) 28،29. الجمع بين هذه النهج في تشكيل حجم الملاحظة أقل بكثير من الحد حيود مع إمكانية استخدام المجاهر المسح السريع وأنظمة الكشف. في تركيبة مع تحليل مضان التذبذب، STED المجهري يسمح للتحقيق مباشرة ديناميات الزمانية المكانية النانو من الدهون وصroteins في أغشية الخلايا الحية 30،31.
ويمكن الحصول على نفس الكميات الفيزيائية المجهر مقرها STED من قبل معدلة المكانية والزمانية صورة ارتباط التحليل الطيفي (عصي 32،33) الطريقة التي هي مناسبة لدراسة ديناميات بروتينات fluorescently الموسومة الغشاء و / أو الدهون في الخلايا الحية وبواسطة المجهر التجاري. ويتكون البروتوكول التجريبي المقدمة هنا خطوات قليلة. أول واحد يتطلب التصوير السريع من منطقة الفائدة على الغشاء. ثم، يتم استخدام كومة الناتجة من الصور لحساب متوسط ظائف علاقة المكانية والزمانية. عن طريق تركيب سلسلة من المهام ارتباط والجزيئي "القانون نشر" يمكن الحصول عليها مباشرة من التصوير في شكل واضح انتشارية (D التطبيق) – مقابل متوسط درجات مؤامرة التهجير. هذه المؤامرة يعتمد بشكل حاسم على البيئة استكشافها من قبل الجزيئات ويسمح تدرك مباشرة وسائط نشر الفعليةمن الدهون / البروتين من الفائدة.
في مزيد من التفاصيل، كما هو موضح سابقا 34 وظيفة لصناعة السيارات في العلاقة المكانية والزمانية من سلسلة صورة المكتسبة يعتمد بشكل حاسم على ديناميكية الجزيئات تتحرك في صورة سلسلة جمعها (يرجى ملاحظة أن نفس المنطق يمكن تطبيقه في اقتناء خط حيث يعتبر البعد واحد فقط في الفضاء). على وجه الخصوص، نحدد وظيفة العلاقة على النحو التالي:
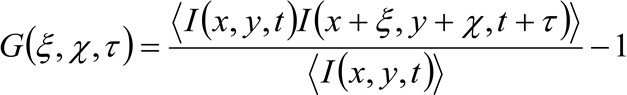 (1)
(1)
أين 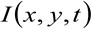 يمثل قياس كثافة مضان في موقف X، Y و في الزمن t،
يمثل قياس كثافة مضان في موقف X، Y و في الزمن t، ![]() و
و ![]() يمثل المسافة في x والاتجاهات ذ التوالي،
يمثل المسافة في x والاتجاهات ذ التوالي، ![]() يمثل تأخر الوقت، و
يمثل تأخر الوقت، و ![]() يمثل المعدل. هذه الوظيفة يمكن التعبير عنها على النحو التالي:
يمثل المعدل. هذه الوظيفة يمكن التعبير عنها على النحو التالي:
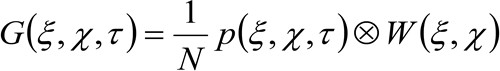 (2)
(2)
حيث يمثل 'N' متوسط عدد الجزيئات في مجال المراقبة، ![]() تمثل عملية الالتواء في الفضاء، و
تمثل عملية الالتواء في الفضاء، و 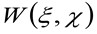 يمثل الارتباط الذاتي من الخصر فعال. هذا الأخير يمكن أن تفسر على أنها مقياس لمدى تنتشر الفوتونات من باعث واحد في الفضاء بسبب البصرية / تسجيل الإعداد (ما يسمى انتشار نقطة وظيفة، قوات الأمن الفلسطينية، الجينيحشد يقترب بشكل جيد من قبل وظيفة جاوس). أخيرا،
يمثل الارتباط الذاتي من الخصر فعال. هذا الأخير يمكن أن تفسر على أنها مقياس لمدى تنتشر الفوتونات من باعث واحد في الفضاء بسبب البصرية / تسجيل الإعداد (ما يسمى انتشار نقطة وظيفة، قوات الأمن الفلسطينية، الجينيحشد يقترب بشكل جيد من قبل وظيفة جاوس). أخيرا، 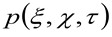 يمثل احتمال لإيجاد الجسيمات على مسافة
يمثل احتمال لإيجاد الجسيمات على مسافة ![]() و
و ![]() بعد فترة زمنية
بعد فترة زمنية ![]() . إذا اعتبرنا ديناميكية ناشر، والتي تتحرك الجزيئات بشكل عشوائي في جميع الاتجاهات وصافي التدفقات ليست موجودة، وهذه الوظيفة أيضا يقترب بشكل جيد من قبل وظيفة جاوس حيث يمكن تحديد التباين مثل متوسط ميدان الإزاحة (MSD) للجسيمات تتحرك . وهكذا، فإن الخصر وظيفة ارتباط (ويشار أيضا
. إذا اعتبرنا ديناميكية ناشر، والتي تتحرك الجزيئات بشكل عشوائي في جميع الاتجاهات وصافي التدفقات ليست موجودة، وهذه الوظيفة أيضا يقترب بشكل جيد من قبل وظيفة جاوس حيث يمكن تحديد التباين مثل متوسط ميدان الإزاحة (MSD) للجسيمات تتحرك . وهكذا، فإن الخصر وظيفة ارتباط (ويشار أيضا ![]() )، يمكن تعريفها بأنها مجموع الجسيمات المشاكل العضلية الهيكلية والخصر فعال ويمكن قياس نوبة جاوستينغ وظيفة ارتباط لكل تأخير الوقت. ويقاس ط MSD يمكن استخدامها لحساب انتشارية واضح من الجزيئات تتحرك
)، يمكن تعريفها بأنها مجموع الجسيمات المشاكل العضلية الهيكلية والخصر فعال ويمكن قياس نوبة جاوستينغ وظيفة ارتباط لكل تأخير الوقت. ويقاس ط MSD يمكن استخدامها لحساب انتشارية واضح من الجزيئات تتحرك ![]() والتشريد متوسط
والتشريد متوسط ![]() على النحو التالي:
على النحو التالي:
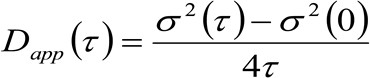 (3)
(3)
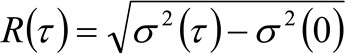 (4)
(4)
بعض الاعتبارات على الإعداد التجريبية المستخدمة يمكن أن توجه القارئ طوال الأقسام التالية. من أجل إثارة انتقائي fluorophores على الغشاء القاعدي الخلايا سوف نستخدم مجموع التأمل الداخلي (TIR) إضاءة الحية، باستخدام TIR التجاري مضان (TIRF) المجهر (التفاصيل يمكن العثور عليها في قسم المواد). وعلاوة على ذلك، من أجل جمع عشرالبريد مضان سوف نستخدم هدف تضخم عالية (100X NA 1.47، مطلوب الفتحة العددية العالية للإضاءة TIRF) وكاميرا EMCCD (الحجم الفعلي للبكسل على ميكرون رقاقة 16). ليصل إلى حجم بكسل من 100 نانومتر نطبق عدسة التكبير إضافية من 1.6X. كما هو مبين أدناه، ستكون هناك حاجة إلى حل وقت أقل من 1 مللي ثانية لوصف صحيح ديناميات نسبة الدهون في غشاء بسرعة أقل من 100 نانومتر. من أجل الوصول إلى هذا القرار الزماني نحن بحاجة إلى تحديد المنطقة ذات الاهتمام (ROI) أصغر من شريحة كاملة من الكاميرا (512 x 512). في هذه الطريقة، فإن الكاميرا قراءة انخفاض عدد خطوط زيادة القرار الوقت. ومع ذلك، في هذا النظام قراءات الإطار الزمني سيكون محدودا من الوقت اللازم لتحويل الرسوم من التعرض لرقاقة قراءات على الكاميرا وعادة ما تكون في حدود 512 ميلي ثانية لX 512 بكسل EMCCD. للتغلب على هذا الحد، تكنولوجيا ناشئة تتيح تحويل خطوط العائد على الاستثمار فقط بدلا من الإطار كله، ثإيث انخفاض فعالية العملي لحجم رقاقة يتعرض (اقتصاص دعا الاستشعار الوضع في EMCCD لدينا). لهذا التكوين لتكون فعالة، يجب أن تغطي الشريحة خارج العائد على الاستثمار من قبل اثنين من الشقوق التي تقام في مسار بصري. ويمكن تحقيق ذلك بفضل هذا الإعداد قرار الوقت وصولا الى 10 -4 ثواني. يرجى ملاحظة، مع ذلك، أن هذا النهج يمكن أن يقترن مع العديد من الاجهزة التجريبية المختلفة، كما هو موضح في قسم 'نقاش' و.
وسوف تقدم دليلا على الأسلوب في الخلايا الحية، وذلك باستخدام كلا من ATTO488 المسمى 1-بالميتويل-2-هيدروكسي SN -glycero-3-phosphoethanolamine (ATTO488-PPE) ومتغير المسمى GFP من مستقبلات ترانسفيرين (GFP- معدل الخصوبة الإجمالي). في حالة ATTO488-PPE هذا النهج يمكن استرداد بنجاح D التطبيق المستمر تقريبا بوصفها وظيفة من النزوح متوسط يدل على نشر معظمها مجانا، كما ذكرت سابقا 30،35. على النقيض من ذلك، يظهر معدل الخصوبة الإجمالي GFP-D لخفض <suب> التطبيق بوصفها وظيفة من متوسط النزوح، مما يشير إلى انتشار تقتصر جزئيا-6. وعلاوة على ذلك، في الحالة الأخيرة فمن الممكن لتحديد ثابت الانتشار المحلي ومتوسط مساحة الحبس على العديد من ميكرون على متن الطائرة الغشاء.
Protocol
Representative Results
Discussion
واحدة تتبع الجسيمات (SPT) يمثل واحدة من الاستراتيجيات الأكثر شيوعا لدراسة ديناميات الجزيئية ولها ميزة كبيرة لقياس مسارات الجسيمات. هذا بدوره يسمح يحقق في سلوك الجسيمات قليلة حتى وصفت في نظام معقد. ومع ذلك، للوصول إلى هذه الميزة SPT يحتاج عادة كثافة منخفضة من التحقيق ومل…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work is supported in part by NIH-P41 P41-RRO3155 and NIH P50-GM076516 (grant to EG), and Fondazione Monte dei Paschi di Siena (grant to FB).
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| iXon Ultra 897 | Andor | DU-897U-CS0 | |
| Solis | Andor | ||
| CHO-K1 | ATCC | CCL-61 | |
| ATTO 488 labeled PPE | ATTO-TEC GmbH | AD 488-151 | |
| DOPE | Avanti Polar Lipids, Inc. | 850725 | |
| DOTAP | Avanti Polar Lipids, Inc. | 890890 | |
| 100X Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | |
| DMEM/F-12 | Gibco | 21331 | |
| FBS | Gibco | 10082147 | |
| HEPES | Gibco | 15630-106 | |
| PBS | Gibco | 10010-023 | |
| SimFCS 3.0 | Globals Software | the software can be downloaded here: http://www.lfd.uci.edu/globals/ | |
| DMI6000 with TIRF modulus | Leica | ||
| LAS AF | Leica | ||
| Lipofectamine 2000 | Lipofectamine | 11668019 | |
| Matlab | MathWork | ||
| Imagej | NIH | ||
| C-terminal GFP tagged Tranferrin Receptor | OriGene | RG200980 | |
| Agar | Sigma Aldrich | A5306 | |
| Chloroform | Sigma Aldrich | 528730 | |
| Latex beads, fluorescent yellow-green, 30 nm | Sigma Aldrich | L5155 | |
| SONICA Ultrasonic Cleaners | SOLTEC | ETH S3 | |
| Petri Dishes | Willco | GWSt-3522 | |
| Bio-Format importer for Matlab | http://www.openmicroscopy.org/site/support/bio-formats5/users/matlab/ | ||
| ICS-MatLab Tools | https://www.cellmigration.org/resource/imaging/software/ICSMATLAB_28-02-06.zip | ||
| Simulation by Matlab Tutorial | https://www.cellmigration.org/resource/imaging/icsmatlab/ICSTutorial.html | ||
| Simulation by SimFCS Tutorial | https://www.cellmigration.org/resource/imaging/ppt-pdf/RICS%20Simulations.ppt |
References
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Vereb, G., et al. yet structured: The cell membrane three decades after the Singer-Nicolson model. Proc. Natl. Acad. Sci. U. S. A. 100 (14), 8053-8058 (1073).
- Ishihara, A., Hou, Y., Jacobson, K. The Thy-1 antigen exhibits rapid lateral diffusion in the plasma membrane of rodent lymphoid cells and fibroblasts. 84 (5), 1290-1293 (1987).
- Axelrod, D., et al. Lateral motion of fluorescently labeled acetylcholine receptors in membranes of developing muscle fibers. Proc. Natl. Acad. Sci. U. S. A. 73 (12), 4594-4598 (1976).
- Jacobson, K., Derzko, Z., Wu, E. S., Hou, Y., Poste, G. Measurement of the lateral mobility of cell surface components in single, living cells by fluorescence recovery after photobleaching. J. Supramol. Struct. 5 (4), 10-1002 (1976).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annu. Rev. Biophys. Biomol. Struct. 34, 351-378 (2005).
- Kusumi, A., Ike, H., Nakada, C., Murase, K., Fujiwara, T. Single-molecule tracking of membrane molecules: plasma membrane compartmentalization and dynamic assembly of raft-philic signaling molecules. Semin. Immunol. 17 (1), 3-21 (2005).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36, 176-182 (1999).
- Gielen, E., et al. Diffusion of sphingomyelin and myelin oligodendrocyte glycoprotein in the membrane of OLN-93 oligodendroglial cells studied by fluorescence correlation spectroscopy. C. R. Biol. 328 (12), 1057-1064 (2005).
- Weiss, M., Hashimoto, H., Nilsson, T. Anomalous protein diffusion in living cells as seen by fluorescence correlation spectroscopy. Biophys. J. 84, 4043-4052 (2003).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophys. J. 89 (6), 4029-4042 (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO J. 25 (14), 3245-3256 (2006).
- Ries, J., Schwille, P. Studying slow membrane dynamics with continuous wave scanning fluorescence correlation spectroscopy. Biophys. J. 91 (5), 1915-1924 (2006).
- Ruan, Q., Cheng, M. A., Levi, M., Gratton, E., Mantulin, W. W. Spatial-temporal studies of membrane dynamics: scanning fluorescence correlation spectroscopy (SFCS). Biophys. J. 87 (2), 1260-1267 (2004).
- Berland, K. M., So, P. T., Chen, Y., Mantulin, W. W., Gratton, E. Scanning two-photon fluctuation correlation spectroscopy: particle counting measurements for detection of molecular aggregation. Biophys. J. 71, 410-420 (1996).
- Heinemann, F., Betaneli, V., Thomas, F. A., Schwille, P. Quantifying lipid diffusion by fluorescence correlation spectroscopy: a critical treatise. Langmuir. 28 (37), 13395-13404 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Capturing directed molecular motion in the nuclear pore complex of live cells. Proc. Natl. Acad. Sci. U. S. A. 109 (25), 9863-9868 (2012).
- Sanchez, S. A., Tricerri, M. A., Gratton, E. Laurdan generalized polarization fluctuations measures membrane packing micro-heterogeneity in vivo. Proc. Natl. Acad. Sci. U. S. A. 109 (19), 7314-7319 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Fluorescence correlation spectroscopy of intact nuclear pore complexes. Biophys. J. 101 (4), 27-29 (2012).
- Di Rienzo, C., et al. Unveiling LOX-1 receptor interplay with nanotopography: mechanotransduction and atherosclerosis onset. Sci. Rep. 3, 10-1038 (2013).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophys. J. 95 (11), 5385-5398 (2008).
- Kannan, B., et al. Electron multiplying charge-coupled device camera based fluorescence correlation spectroscopy. Anal. Chem. 78 (10), 3444-3451 (2006).
- Jones, S. A., Shim, S. H., He, J., Fast Zhuang, X. three-dimensional super-resolution imaging of live cells. Nat. Methods. 8 (6), 499-508 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy. 3 (10), 793-795 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Klar, T. A., Hell, S. W. Subdiffraction resolution in far-field fluorescence microscopy. Opt. Lett. 24 (14), 954-956 (1999).
- Eggeling, C., et al. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457 (7233), 1159-1162 (2009).
- Hedde, P. N., et al. Stimulated emission depletion-based raster image correlation spectroscopy reveals biomolecular dynamics in live cells. Nat. Commun. 4, .
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88 (5), 3601-3614 (2005).
- Brown, C. M., et al. Probing the integrin-actin linkage using high-resolution protein velocity mapping. J. Cell Sci. 119, 5204-5214 (2006).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proc. Natl. Acad. Sci. U. S. A. 110 (30), 12307-12312 (2013).
- Mueller, V., et al. STED nanoscopy reveals molecular details of cholesterol- and cytoskeleton-modulated lipid interactions in living cells. Biophys. J. 101 (7), 1651-1660 (2011).
- Kleusch, C., Hersch, N., Hoffmann, B., Merkel, R., Csiszar, A. Fluorescent lipids: functional parts of fusogenic liposomes and tools for cell membrane labeling and visualization. Molecules. 17 (1), 1055-1073 (2012).
- Ries, J., Chiantia, S., Schwille, P. Accurate determination of membrane dynamics with line-scan FCS. Biophys. J. 96 (5), 1999-2008 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49 (3), 141-164 (2007).
- Digman, M. A., et al. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89 (2), 1317-1327 (2005).
- Ritchie, K., et al. Detection of non-Brownian diffusion in the cell membrane in single molecule tracking. Biophys. J. 88 (3), 2266-2277 (2005).
- Voie, A. H., Burns, D. H., Spelman, F. A. Orthogonal-plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J. Microsc. 170, 229-236 (1993).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Wohland, T., Shi, X., Sankaran, J., Stelzer, E. H. Single plane illumination fluorescence correlation spectroscopy (SPIM-FCS) probes inhomogeneous three-dimensional environments. Opt. Express. 18 (10), 10627-10641 (2010).

